力竭运动后不同时相大鼠心肌Egr-1蛋白的变化及其在运动性心肌微损伤发生中的作用
袁旭鑫,常 芸
力竭运动后不同时相大鼠心肌Egr-1蛋白的变化及其在运动性心肌微损伤发生中的作用
袁旭鑫,常 芸
目的:探讨力竭运动后不同时相心肌早期生长应答基因Egr-1在蛋白水平的变化特点,为运动性心肌微损伤及心肌功能异常发生机制的阐释提供实验依据。方法:100只健康成年雄性SD大鼠,分为一次力竭游泳运动组、两周反复力竭游泳运动组及安静对照组,分别于力竭运动后即刻、6 h、12 h及24 h取材,应用免疫荧光组化技术和图像分析方法研究大鼠心肌Egr-1蛋白含量的变化。结果:一次力竭运动组大鼠心脏各部位Egr-1蛋白含量即刻组与对照组相比显著性升高(P< 0. 05),24 h组与对照组相比显著性降低( P<0. 05);反复力竭运动组大鼠心脏各部位Egr-1蛋白含量即刻组与对照组相比显著性升高(P< 0. 05),6 h组、12 h组、24 h组大鼠心脏各部位Egr-1蛋白含量均显著低于对照组 (P<0. 05)。结论:不同力竭运动后心脏各部位Egr-1在运动后即刻明显升高,表明心肌细胞Egr-1对力竭运动刺激产生快速应激反应,可能诱导炎性细胞的趋化、聚集以及氧自由基的产生。而心脏各部位Egr-1在力竭运动后24 h内恢复到正常水平,说明力竭运动后心脏Egr-1改变属早期应激反应,且此反应属可复性改变。
力竭运动;大鼠;心肌;早期生长应答基因-1(Egr-1)
研究表明适度运动可以有效地改善心血管功能,有利于保持人体健康和运动能力,但剧烈运动尤其是超负荷反复运动或力竭运动会诱导运动性心脏损伤。力竭性运动时,心脏消耗增加,而机体供给量却在减少,此时心肌处于相对缺血缺氧状态。有研究认为,运动性心肌微损伤类似于临床上的缺血再灌注损伤,氧自由基增多、钙超载、心肌能量代谢障碍、血管内皮细胞功能障碍、一氧化氮减少、细胞结构蛋白的降解和细胞凋亡异常等均可能参与运动性心肌微损伤的病理过程。在此过程中,多种因素均可使原本处于休眠状态的早期生长应答基因被激活。
早期生长应答基因-1(Egr-1)为即刻早期基因(IEG)家族成员,是原癌基因家族中一类能被第二信使诱导的原癌基因,受刺激后最先表达该类基因,固亦称快速反应基因。Egr-1具有3个锌指样结构的转录因子,它通过对其靶基因的诱导将多种细胞外环境的刺激信号(缺血缺氧、氧化应激、机械损伤等)与机体复杂的生物反应耦联起来,因此是联系细胞生化改变与细胞最终对刺激发生特异性反应的中介物,在生理状态下可调整机体细胞的生长、分化和细胞内信息的传递,参与正常细胞的生长和发育过程,是心血管系统生长发育所必需的基因。目前关于不同力竭运动后心肌Egr-1蛋白含量在不同时相的变化尚无研究报道。
因此,本研究通过一次力竭游泳和反复力竭游泳运动建立运动性心肌微损伤的实验动物模型,研究大鼠心肌Egr-1在力竭运动后不同时相的蛋白表达变化,探讨其在运动性心肌微损伤及心肌功能异常发生中的调节作用,试图为大强度运动和过度训练所致心脏问题的医务监督提供理论与实验依据。
1 材料与方法
1.1 实验对象
选用纯种SD雄性大鼠100只(维通利华公司提供),体重220±8 g,8月龄,国家标准啮齿动物干燥饲料喂养,自由饮食,动物室内温度18~22℃,光照时间12 h,相对湿度40%~55%。
1.2 实验动物分组
将100只SD大鼠首先随机分为一次力竭游泳运动和2周反复力竭游泳运动及其相应对照组,各组间大鼠初始体重无显著性差异(P>0.05),具体分组和体重情况见表1。
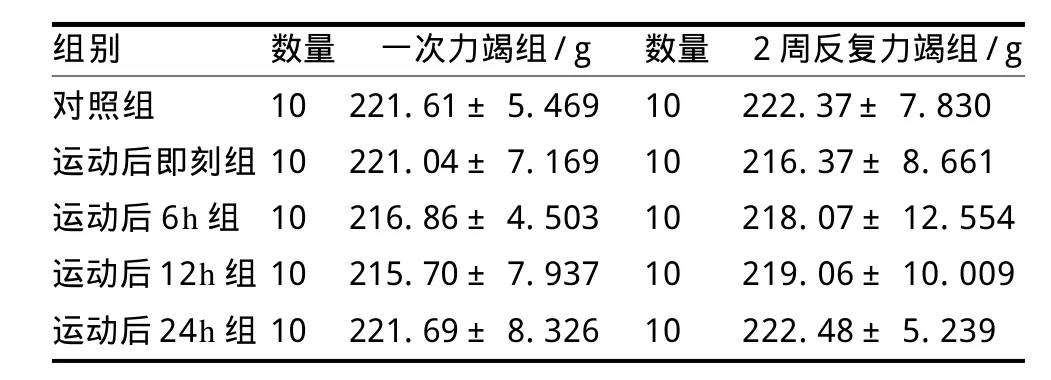
表1 分组时大鼠各组体重TableⅠ Weight of the Rats at the Time of Being Divided into Groups
1.3 动物模型的建立
依据经典的Thomas实验方案,通过一次力竭游泳和反复力竭游泳运动建立不同程度的运动性心肌微损伤实验动物模型。
1.3.1 运动环境条件
PVC特制泳池,规格为1.6 m×0.8 m×1.2 m,内壁光滑,水深约60 cm,超过大鼠身长2倍,控制水温在30~33℃。
1.3.2 运动负荷方案
安静对照组不运动。运动组大鼠进入动物房后首先适应3 d,然后进行2 d适应性游泳运动(20 min/次)。
一次性力竭组进行一次性游泳运动,游泳大鼠在尾部负重(负重量为体重3%),直至力竭,力竭标准参照Thomas DP报道[1],即连续沉入水中超过10 s,捞出后置于平面不能完成翻正反射;对于时间相对较短就发生力竭的大鼠,捞出休息5 min后,再让其继续游泳运动,使每次运动时间不少于2 h。
反复力竭运动组每天1次力竭运动,游泳大鼠在尾部负重(负重量为体重3%)。每周运动6 d,共运动2周。每次运动时间不少于2 h。每次运动结束后,迅速用毛巾擦干水分,然后用电吹风彻底吹干后,再放回笼中休息。
1.4 实验方法
1.4.1 大鼠心肌冰冻切片的制备
一次性和反复力竭运动组分别于运动后0 h、6 h、12 h、24 h取材,首先进行腹腔注射10%水合氯醛(1 ml/100 g体重)麻醉后,迅速开胸取血,然后迅速取出心脏,心脏经灭菌生理盐水清洗后,滤纸吸干并称重,滴加O CT包埋剂后置于液氮冷冻20 s后转入冰冻切片机恒温箱(-25℃),切取7 μ m厚度的冰冻切片置于-70℃超低温冰箱待用。
1.4.2 免疫荧光染色
主要试剂:兔多克隆Egr-1抗体购于美国Santa Cruze公司;FITC标记山羊抗兔IgG购于北京中杉生物技术有限公司;DAPI染液购于碧云天生物技术研究所。
从低温冰箱取出心肌冰冻切片后,室温复温30 min;入冷丙酮(4 ℃)固定10 min,PBS洗3次,每次5 min;滴加10%封闭用羊血清(PBS稀释,工作浓度1:50),室温放置30 min,倾去血清,勿洗;滴加一抗(Egr-1多克隆抗体,工作浓度1∶50),4℃放置14 minPBS洗3次,每次5 min;滴加荧光素标记二抗(工作浓度1∶100),37 ℃避光放置45min,PBS洗3次,每次5 min;滴加DAPI原液7min,PBS洗3次,每次5 min;60%缓冲甘油封片,立即置镜下观察。PBS代替一抗作阴性对照。
1.4.3 图像采集与分析
使用Leica As MDW活细胞多维图成像工作站进行图像采集以及图像分析,具体操作参照仪器操作规范进行,所有图片按照相同的曝光时间及条件进行。用于FITC的激发波长为490 nm,激发DAPI的波长为390 nm,放大倍数为200倍,图像存为1024×1024像素类型,每张切片左心室、室间隔、右心室各随机选择心肌细胞的横切3个视野。应用Leica Qwin图像分析系统对Egr-1的免疫荧光图进行分析,以积分灰度值(Intergrated Grey)为评价标准,对Egr-1进行半定量分析。
1.4.4 数据收集及处理方法
实验所有数据均数SPSS15.0统计软件进行统计分析,组间进行单因素方差分析,不同因子间进行相关性分析,结果均以平均数±标准差表示,其中P<0.05为显著性差异, P<0.01为非常显著性差异。
1.5 实验主要使用仪器
实验中使用的冰冻切片机、多维成像工作站和形态学图像分析系统皆为LEICA公司生产,试验所用全部仪器为国家体育总局体育科学研究所实验中心提供,操作者按照实验操作说明规范操作。
2 结果
2.1 大鼠心脏形态肉眼观察
对照组大鼠心脏颜色鲜红,弹性好;一次力竭游泳运动各组大鼠心脏有充血现象,颜色略深,表面冠状血管充盈;反复力竭游泳运动各组大鼠心脏充血程度较一次力竭大鼠更为显著,颜色暗紫,表面血管怒张明显,且有心房充血扩张。
2.2 大鼠心系数变化
各组大鼠心系数见表2。一次力竭游泳运动各组大鼠心系数与对照组之间无统计学差异(P>0.05),各时相组之间亦无统计学差异(P>0.05)。2周反复力竭游泳运动后即刻、6 h、12 h、24 h各组心系数均显著高于对照组心脏重量指数(P<0.01),各时相组之间无统计学差异(P>0.05)。
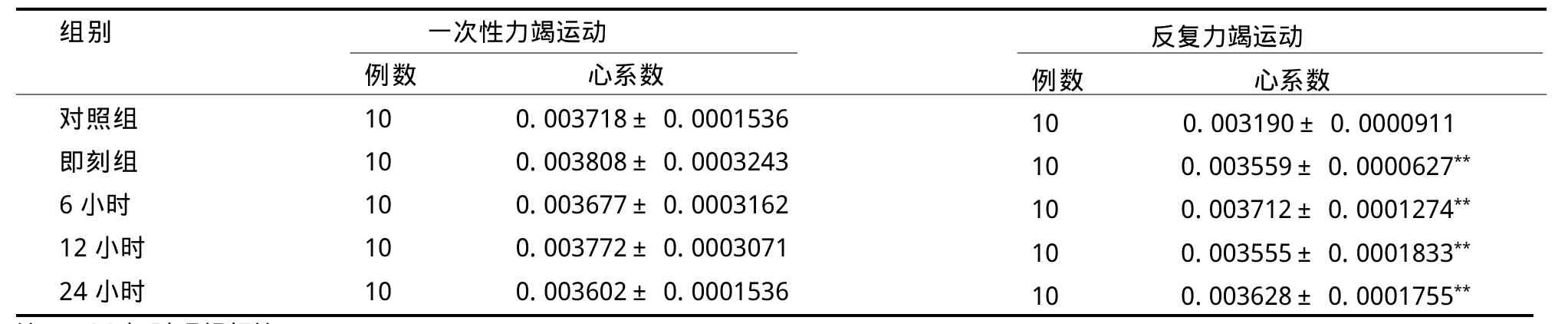
表2不同游泳运动后各组大鼠心系数的变化TableⅡ Variation of the Heart Coefficient of the Different Group Rats after the Different Exhaustive Exercises
2.3 Egr-1免疫荧光染色结果
如图1所示,大鼠心肌横切图,绿色点状或条索状荧光斑为FITC标记的Egr-1蛋白阳性表达(图1①)。蓝色荧光斑为细胞核(DAP I标记)(图1②)。双荧光染色图像(图1 ③)。一次力竭组、反复力竭组与对照组相比,光斑数量、光斑面积、光密度大小、亮度强弱均发生改变,并可见心肌细胞Egr-1受刺激后在核内出现。
2.4 力竭运动后Egr-1蛋白表达
应用图像分析系统对Egr-1的免疫荧光图进行分析。由于积分灰度值是对荧光斑面积和荧光强度的一个综合评价,因此本次实验图像以积分灰度值为评价标准,对Egr-1进行半定量分析。
一次力竭运动大鼠除24 h组以外,Egr-1蛋白含量在运动后整体上调,运动后即刻Egr-1即可在核内出现,运动后即刻、6 h组、12 h组、24 h组蛋白表达呈现先上升再下降再上升再下降的变化趋势,24 h组出现显著性降低(见表3)。

表3 一次力竭运动后大鼠心肌E g r-1蛋白表达积分灰度值变化TableⅢ Changes of Rat Heart Muscle Egr-1 Protein Integral Expression of Gray Value after One-time Exhaustive Exercise
反复力竭运动组,Egr-1蛋白含量运动后即刻上升,但6 h后显著性下降,随后的12 h和24 h蛋白含量虽略呈上升趋势,但显著低于对照组(见表4)。
3 讨论
在运动医学研究中,大鼠动物实验最常用的方法有游泳和跑台两种方法,但各有利弊。应用跑台训练大鼠跑步易于量化运动强度,但训练时需采用电击刺激或恐吓等手段驱赶,易引起大鼠生理改变和机械性损伤,从而影响试验结果。由于大鼠天生就会游泳,故大多学者认为游泳比跑台优点更多。大鼠在接受游泳训练时,不会产生强烈的抵触情绪,运动强度能维持在较高水平,对心脏的影响比较显著,且承受体力外的不良刺激少。为保证试验效果,查阅文献多推荐大鼠游泳时水温略低于体温最为适宜,因而采用30~33℃的水温。大鼠游泳时还要保证每只大鼠要有足够的空间,一般每只大鼠至少应有300 cm2的水面,而水的深度至少超过大鼠身长加尾长,从而避免大鼠尾部支撑池底休息。在本次实验中,参照Thomas等[1]、朱全等[2]的报道,游泳时大鼠负重为体重的3%,训练至力竭时间一般为2~3 h,力竭标准是沉没水中10 s仍不能回到水面,并且捞出水后不能完成翻正反射即为力竭。McArdle[3]从可信度和相关性两个方面,考察了“经10 s仍不能回到水面”的疲劳指标和“所有协调运动中止,大鼠不再能返回水面”的力竭指标间的关系,证实这两个指标的可信度相似且高度相关(r=0.99),而前者显然安全得多,因此我们选择使用“经10 s后仍不能返回水面”作衡量游泳能力时的观察指标。
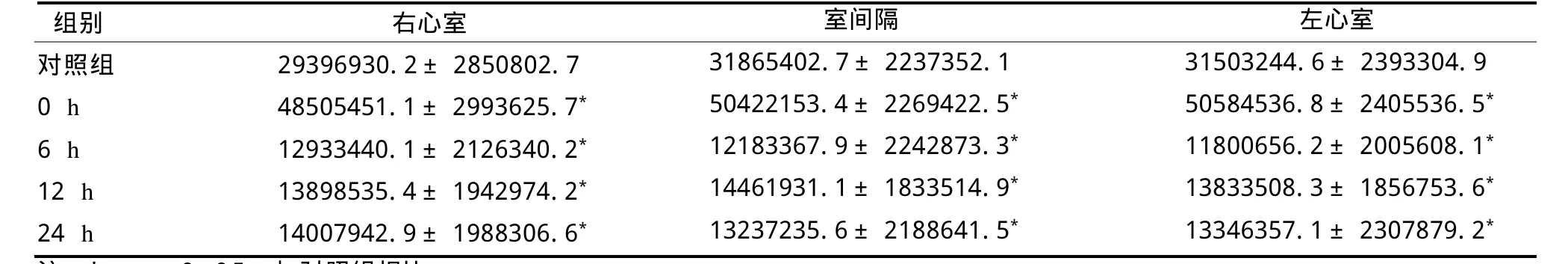
表4 反复力竭运动后大鼠心肌E g r-1蛋白表达积分灰度值变化TableⅣ Changes of Rat Heart Muscle Egr-1 Protein Integral Expression of Gray Value after Repeated Exhaustive Exercises
Egr-1属即刻早期基因,是原癌基因家族中一类能被第二信使所诱导的原癌基因,由于细胞经外部刺激后最先表达该类基因,固亦称快速反应基因。近年来研究表明[4-8],Egr-1是联系细胞生化改变与细胞最终对刺激发生特异性反应的中介物。Egr-1蛋白是一种含有3个锌指状结构的转录因子[21],能与核DNA某区段结合,诱发附近若干基因转录变化,从而抑制细胞生长,还能作用于细胞周期,起调节细胞生长和分化的作用,使细胞不过度生长。在生理状态下可调整机体细胞的生长、分化和细胞内信息的传递,参与正常细胞的生长和发育过程,是心血管系统生长发育所必需的基因。在病理情况下,这些基因表达及调控的变化与多种疾病的发生发展有关。力竭运动使机体发生许多生理生化的变化,包括体温升高、Ca2+浓度升高、体内自由基生成增加、局部组织缺血缺氧、糖原耗竭、能量储备减少等,这些变化常导致生物体细胞Egr-1含量改变,此外心脏内如血压负荷、牵拉、血管紧张素Ⅱ等多种刺激因素也可诱导Egr-1的表达异常。异常表达的Egr-1又可进一步诱导一系列下游基因的表达,包括白细胞介素(IL)-1β、巨噬细胞炎性蛋白-2(MIP-2)、细胞间黏附分子-1(ICAM-1)、组织因子(TF)等,这些因子随后启动炎性反应、凝血和血管通透性改变。此外有文献认为[9],Egr-1上调与心肌肥厚存在某种联系,Egr-1还影响SERCA2及心肌β受体的表达,从而直接影响了心肌细胞的收缩和舒张功能。
本次试验各种力竭运动组即刻心肌Egr-1蛋白含量均升高,体现Egr-1快速反应的特性。其中一次力竭运动组即刻Egr-1蛋白含量与对照组差异显著(P< 0.05),大量研究表明Egr-1表达异常与细胞损伤关系密切,Egr-1可参与调控多种基因触发炎性细胞的趋化、聚集、激活凝血系统、产生氧自由基、形成微循环紊乱等。而后Egr-1蛋白含量在一次力竭运动6 h至12 h呈上升趋势,研究发现[10-12],一次力竭运动对机体产生不利影响,可导致运动性疲劳与损伤的发生,尤其是运动性心肌微损伤,王东辉等[13]研究发现,力竭运动引起的心肌损伤表现特点与临床上心肌缺血再灌注损伤相似,这种损伤在6 h的时相较严重,24 h后有所减轻,但临床病理性缺血时机体通常处于静息状态,而运动时由于血液动力学性质改变和高负荷致心肌强烈收缩的力学因素,使心肌肌原纤维结构改变十分明显。此外,多数学者认为原癌基因的诱发在缺血后的再灌注期,认为其诱导和表达为缺血再灌注损伤引起的继发反应,包括:再灌注引起的自由基造成的组织损伤;直接缺血损伤之后的修复过程的开始;细胞增生的激活;离子流动(尤其是Ca2+)的改变,缺血后蛋白质的合成抑制;细胞内各种蛋白激酶的激活;多肽生长因子释放;激素分泌等。12~24 h Egr-1蛋白含量明显下降,证实Egr-1在心内表达时间较短。反复力竭运动组由于心肌出现疲劳和损伤的积累,导致除即刻组外Egr-1蛋白含量均显著低于对照组含量(P<0.05),并最终没有恢复到对照组水平,笔者认为与运动性心肌损伤有关。研究发现,反复力竭运动对心肌造成的缺血缺氧损伤较一次力竭运动严重,反复力竭运动过程中心肌能量代谢异常,心肌疲劳与损伤累积叠加,最终导致心肌结构和功能的不可逆改变。由于各种力竭运动对心肌损伤过程相当复杂,因此笔者认为Egr-1表达异常与心肌超负荷应激过程及其产物、心肌缺血、再灌流及二者共同作用产物、心肌修复过程及其产物皆有联系。
4 小结
4.1 不同力竭运动后心脏各部位Egr-1在运动后即刻明显升高,表明心肌细胞Egr-1对力竭运动刺激产生快速应激反应,可能诱导炎性细胞的趋化、聚集以及氧自由基的产生。
[1]Thomas D P. (1988).Effect of repeated exhaustive exercise on myocardial sub cellular membrane structures. Int-J-sports-Med.9 (4):257-260.
[2]朱全,浦钧宗.大鼠游泳训练在运动实验中的应用方法[J].中国运动医学杂志,1996,2:125-129.
[3]McArdle W D, Montoye H J. (1966). Reliability of exhaustive swimming in the laboratory rat[J]. J Appl Physiol, 21(4):1431-1434.
[4]Cao X, Mahendran R, Guy GR, et al.(1993). Detection and characterization of cellular Egr-1 binding to its recognition site [J].J Biol Chem, 268(23):16949-16957.
[5]Yan SF, Lu J, Zou YS, et al. (2000). Protein kinase C-beta and oxygen deprivation. A novel Egr-1-dependent pathway for fibrin deposition in hypoxemic vasculature[J]. J Biol Chem, 275 (16):11921-11928.
[6]Yan SF, Lu J, Xu L, et al. (2000). Pulmonary expression of early growth response-1: biphasic time course and effect of oxygen concentration[J]. J Appl Physiol, 88(6):2303-2309.
[7]Yan SF,Fujita T, Lu JS et al.(2000). Egr-1, a master switch coordinating upregulation of divergent gene families underlying ischemic stress[J]. Nature Med, 6(12): 1355-1361.
[8]Slinker BK, Stephens RL, Fisher SA, et al. (1996).Immediateearly gene responses to different cardiac loads in the ejecting rabbit left ventricule[J]. J Mol Cell Cardiol, 28: 1565-1574.
[9]Kolbeck-Ruhmkorff C, Zimmer H. (1995). Proto-oncogene expression in the isolated working rat heart combination of pressure and volume overload with nor epinephrine [J]. J Mol Cell Cardiol, 279(1):501-511.
[10]Tata CA, Hyek MF, Taffet GE. (1994). Mechanisms for the responses of cardiac muscle to physical activity in age[J]. Med Sci Sports Exerc, 26(5): 561-567.
[11]Anversa P, Beghi C, Levichy V, et al.(1982). Morphomity of right ventricular hypertrophy induced by strenuous exercise in rat[J]. Am J Physiol, 243: H856-H861.
[12]Anversa P, Lecichy V, Beghi C, et al. (1983).Morphometry of exercise induced right ventricular hypertrophy in the rat[J]. Cir Res, 52:57-64.
[13]王东辉,熊若虹,郑兵等.大鼠力竭游泳运动后不同时相心肌和血清SOD、GSH-Px、M DA和Ca2+的变化[J].沈阳体育学院学报,2 0 0 4,2 3(3):3 3 2.
[14]VIHKO V, SALMINEN A. (1983). Acid hydrolase activity in tissues of mice after physical stress[J]. Comp Biochem Physiol B, 76(2):341-344.
[15]HELAINE MA, ANN EH, SZILVIA N, et al. (2005). Exercise improves biomarkers of health and stress in animals fed ad libitum [J]. Physiol Behav, 84(7):65-72.
[16]PEDREANEZ A, ARCAYA JL, CARRIZO E, el al. (2006). Forced swimming test increases superoxide anion positive cells and angio-tensin ¢ò positive cells in the cerebrum and cerebellum of the rat[J]. Brain Res Bull, 71(13):18-22.
[17]常芸,袁箭峰,王莱芮等.运动与心脏微损伤机制的研究[A],第七届全国体育科学大会,论文摘要汇编(二)[C].北京:中国体育科学学会主办,2 0 0 4
[18]宋熔,柳君泽.哺乳动物核呼吸因子研究进展[J].生理科学进展.2005,36(2):183-185.
[19]常芸.运动心脏理论与实践[M].北京:人民体育出版社,2008. 106-132
[20]Fu M, Zhang J, Lin Y, et al. (2002). Early growth response factor-1 is a critical transcriptional mediator of peroxisome proliferators-activated receptor-gamma 1 gene expression in human aortic smooth muscle cells[J]. J Biol Chem, 277 (30): 26808-26814.
[21]Thiel G, Cibelli G.(2002). Regulation of life and death by the zinc finger transcription factor Egr-1[J].J Cell Physiol, 193(3): 287-292.
(责任编辑:何聪)
Changes of Egr-1 Protein and It's Functions in the occurrence of Athletic Myocardial Micro-damage at the Different Phases after Exhaustive Exercise
YUAN Xu-xin, CHANG Yun
(China Institute of Sport Science, Beijing 100061, China)
Objective To explore the variation characteristics of early growth response genes Egr-1 protein level so as to provide experimental reference for the occurrence mechanism of athletic myocardial micro-damage and myocardial dysfunction. Method 100 healthy adult male SD rats were divided into three groups of one-time exhaustive swimming group, two-week repeated exhaustive swimming group and noexercise control group. Samples were collected immediately, 6 hours, 12 hours and 24 hours after exhaustive exercise. Immunofluorescence technology and image analysis were adopted to study the changes of rat myocardium Egr-1 protein level. Result The immediate Egr-1 protein levels of the different parts of rat myocardium increased significantly (P<0.05). Samples collected at 24 hours decreased distinctly compared to those of the control group (P<0.05). In repeated exhaustive group, the immediate Egr-1 protein levels of the different parts of rat myocardium increased significantly (P<0.05). Samples of Egr-1 protein levels of the different parts of rat myocardium at 6 hours, 12 hours and 24 hours were clearly lower than the control group (P<0.05). Conclusion Egr-1 of the different parts of heart increases immediately after the different exhaustive exercises shows that there is a rapid stress response of myocardial cell Egr-1 toward the stimulation of exhaustive exercise. This might lead to chemotaxis and aggregation of inflammatory cells and the production of OFR. Egr-1 of the different parts of heart returns normal level 24 hours after exhaustive exercise. This shows that Egr-1 after exhaustive exercise belongs to early-stage stress response and this response is reversible.
exhaustive exercise; rat; myocardium; early-stage growth response gene (Egr-1)
G804.5
A
1006-1207(2012)04-0030-05
2012-06-27
国家体育总局体育科学研究所基本科研业务经费(09-10)
袁旭鑫,男,研究生. 主要研究方向:运动心脏病理与医学监督.
国家体育总局体育科学研究所,北京体育馆路11号,北京100061

