牛布氏杆菌试管凝集试验不确定度研究
李冰玲 马贵平 刘会英 谷强 刘全国 李炎鑫 史喜菊
(1.北京出入境检验检疫局 北京 101113;2.国家知识产权局专利审查协作北京中心)
1 前言
试管凝集试验是微生物学检验中常用的试验方法,即用已知细菌作为抗原液与一系列稀释的受检血清混合,保温后根据试管内抗原凝集程度和产生明显凝集现象的血清最高稀释度(血清中抗体的效价、滴度)来判断动物的感染状态,如对牛布氏杆菌病、马流产病的血清学检测。该试验还可通过已知抗血清来检测未知病原,如对沙门氏菌和链球菌进行检测和血清分型[1]。传统的试管凝集试验为半定量试验,当被检血清中含有目标抗体时,就会与溶液中的抗原发生反应,反应物凝结沉降到管底,降低溶液的浑浊度,抗体浓度越高,溶液的浑浊度就越低。将待测管与事先配制好的比浊管进行眼观比较,可以得出待测血清的半定量结果(++++,+++,++,+,-)。为了评估试验结果的不确定度,本研究采用浊度计对反应液的浑浊度进行定量测定,得出浊度值(NTU),并对测定结果进行不确定度分析。
2 材料与方法
2.1 材料
2.1.1 试剂
稀释液:0.5%石炭酸生理盐水(0.85%氯化钠溶液,含0.5%石炭酸);牛布氏杆菌标准抗原、牛布氏杆菌标准阳性血清、标准阴性血清:中国兽药监察所细菌实验室提供。
2.1.2 器材
试管架;玻璃试管:规格为13 mm ×100 mm,圆底,洁净;微量移液器:0-50 μL,0-200 μL,0-1000μL;浊度计:上海昕瑞 WGZ-2000,量程0-2000 NTU。
2.2 方法[2]
2.2.1 被检血清
采用购买的标准阳性血清进行倍比稀释,稀释起点为1:50,设定5个稀释度。方法为:
每份被检血清用4支试管,标记检验编号后第1管加1.2 mL稀释液和50μL被检血清,第2-4管各加入0.5mL稀释液;将第1管的稀释液和被检血清充分混匀后吸弃0.25 mL,然后吸取0.5mL加入到第2管,混合均匀后,再从第2管吸取0.5 mL至第3管,如此倍比稀释从最后一管弃去0.5 mL。
2.2.2 加抗原
将0.5 m L抗原(1:20)加入已稀释好的各血清管中。各反应管反应总量为1 mL。
2.2.3 设立对照
每次试验都设立下列对照:
阴性血清对照:阴性血清的稀释和加抗原的方法与被检血清同。
阳性血清对照:阳性血清的最高稀释度应超过其效价滴度,加抗原的方法与被检血清同。
抗原对照:在0.5 mL稀释液中,加0.5 mL抗原(1:20)。
2.2.4 配制比浊管
每次试验均配制比浊管作为判定凝集反应程度的依据。先将抗原(1:20)用等量稀释液作一倍稀释,然后按表1配制比浊管。
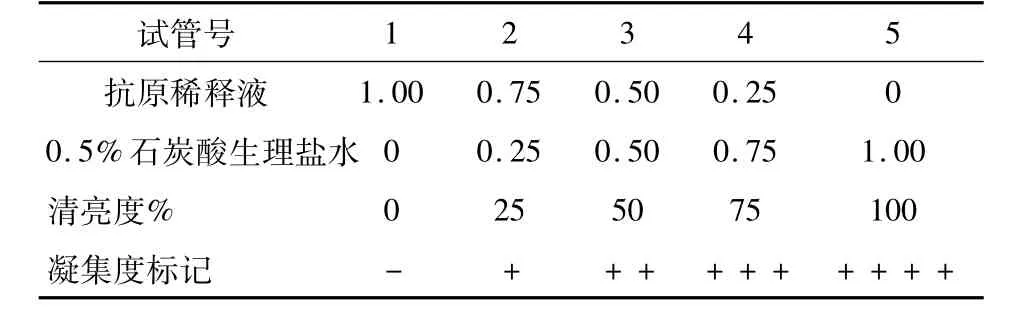
表1 比浊管的配制
2.2.5 感作
所有试验管充分震荡后,置37℃温箱感作20h。
2.2.6 结果判定
比照比浊管判读,出现++以上凝集现象的最高血清稀释度为血清凝集价。
当阴性血清和抗原对照不出现凝集,阳性血清的凝集价达到其标准效价±1个滴度,则证明试验成立,可以进行待检血清阴阳性判定。否则,试验重做。
2.2.7 试管凝集试验结果不确定度来源分析
试管凝集试验结果的不确定度按照试验过程分析,主要来源于两个过程:试管凝集试验过程和对反应结果的仪器测定过程,分为A类不确定度和B类不确定度。
来源于试管凝集试验过程的不确定度的分量即重复检测引入的不确定度。来源于浊度计测定过程的不确定度包括:浊度计测量的不重复性引入的不确定度、移液器引入的不确定度、测量瓶引入的不确定度、浊度标准物质引入的不确定度。不确定度来源汇总见表2。

表2 不确定度来源汇总
2.2.7.1 不确定度传播公式[3]
u2(y)=u2(R)+ +u2(M)
u2(R)——重复检测引入的方差
u2(M)——浊度计测定过程引入的方差
扩展不确定度:U(y)=k u(y)
2.2.7.2 比浊管浊度值的测定
对5个浓度的比浊管进行浊度测试,试验结果数据见表3。

表3 比浊管浊度值的测定
2.2.7.3 试验用阳性血清稀释度的确定
将阳性血清进行7个稀释度的倍比稀释,即:1:50、1:100、1:200、1:400、1:800、1:1600、1:3200,按照试验程序进行试验后,对结果进行判定并测定浊度值。
试验结果数据见表4。
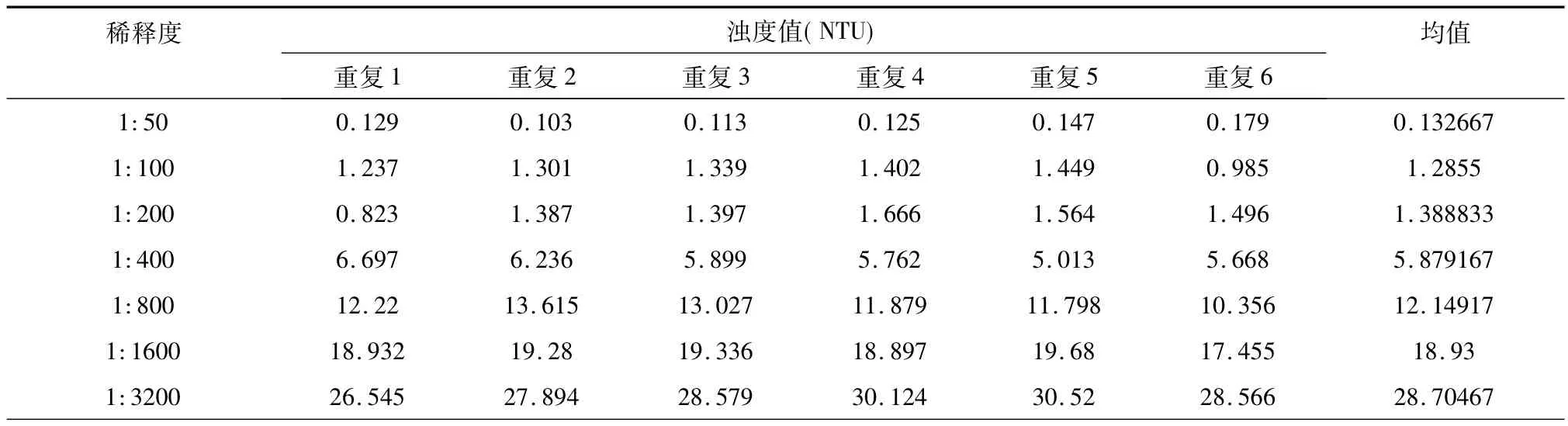
表4 阳性血清稀释度的确定
根据试验结果,选择眼观浊度与比浊管相对应,且平均浊度值与比浊管最为接近的不同的5个稀释度的值进行计算,即:1:50、1:400、1:800、1:1600、1:3200。
2.2.7.4 重复检测引入的不确定度根据贝塞尔公式[3],由重复试验引入的方差:

计算各稀释度对应的方差见表5。

表5 各稀释度对应的方差
2.2.7.5 浊度计测定过程的方差u2(M)的计算
依据JJG 880-2006,浊度仪示值的相对误差按式(1)计算:
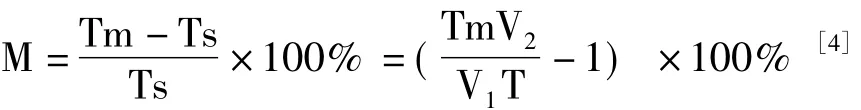
式中:M— —仪器示值相对误差;
Tm— —浊度测量的平均值,NTU;
Ts— —稀释后浊度标准物质的标准值,NTU;
V2— —测量瓶定容体积,mL;
V1— —移液器取样体积,mL;
T— —浊度标准物质标准值,NTU。
根据 u2c(y) = Σ[∂f/∂xi]2u2(xi) ,可知:

其中:c1=∂Δ/∂Tm=V2/V1T;
c2= ∂Δ/∂V2=Tm/V1T
c3= ∂Δ/∂V1=TmV2/TV21;
c4= ∂Δ/∂T=TmV2/V1T2
浊度计测定过程的不确定度主要来源于以下几方面:仪器重复测量引入的不确定度;标准溶液稀释后浊度标准值引入的不确定度(包括标准物质的定值不确定度、标准物质的稀释以及温度对溶液稀释的影响引入的不确定度)。
选择与稀释度 1:50、1:400、1:800、1:1600、1:3200的平均浊度测量值相近的标准溶液的稀释度进行试验,即 0NTU、5NTU、12NTU、18NTU、28NTU的标准溶液的稀释液进行浊度计测定过程的不确定度评估,见表6。

表6 浊度计测定过程的方差u2(M)各分量
(1)浊度计测量的重复性引入的不确定度
根据浊度计说明书,该仪器的测量重复性≤1%,按照1%计算,计算结果如表7。

表7 测量重复性方差u2(Tm)

18.205 0.1822 5 28.17 0.2817 4 2
(2)移液器引入的不确定度
本实验使用的是量程范围为20-100μL和100-1000μL的移液器。由于20-100μL移液器带来的不确定度很小,可以忽略不计,只需计算100-1000μL的移液器带来的不确定度。根据该移液器校准证书,该量程误差为0.46%。根据公式:u(V1)=a/k,由移液器引入的方差的计算结果如表8。
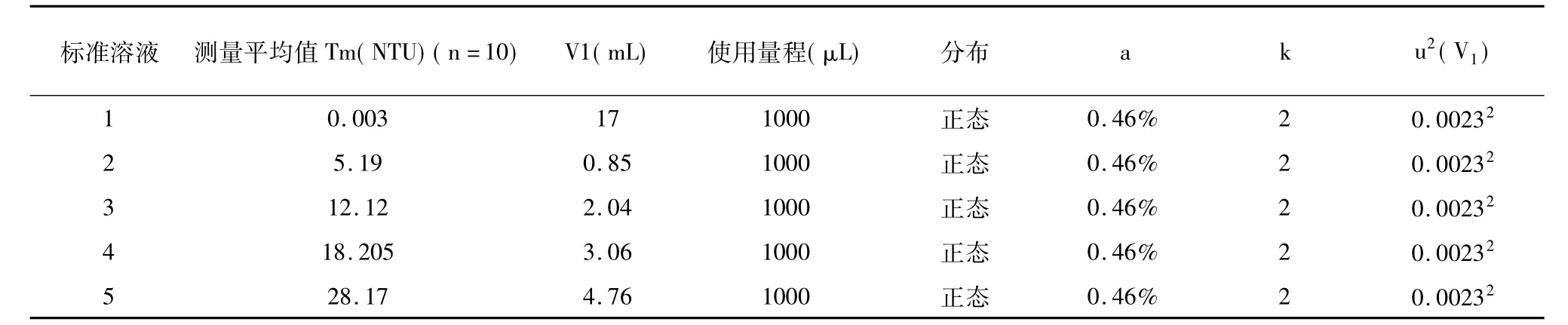
表8 移液器引入的方差u2(V1)
(3)测量瓶引入的不确定度
测量瓶引入的方差主要有2个来源:
①测量瓶体积校准:所用测量瓶体积为17.00±0.02 mL,为均匀分布;
②测量时测量瓶和溶液温度与校准时温度不同引入的不确定度:测量瓶的校准温度为25℃,而实验室温度在25℃ ±4℃范围内变化。由于溶液体积膨胀系数明显大于测量瓶体积的膨胀系数,因此可以只考虑前者的影响。水的体积膨胀系数为2.1×10-4/℃,温度带来的方差计算公式为:膨胀系数×温度变化半宽度×测量瓶体积,为均匀分布。测量瓶引入的方差计算结果如表9。
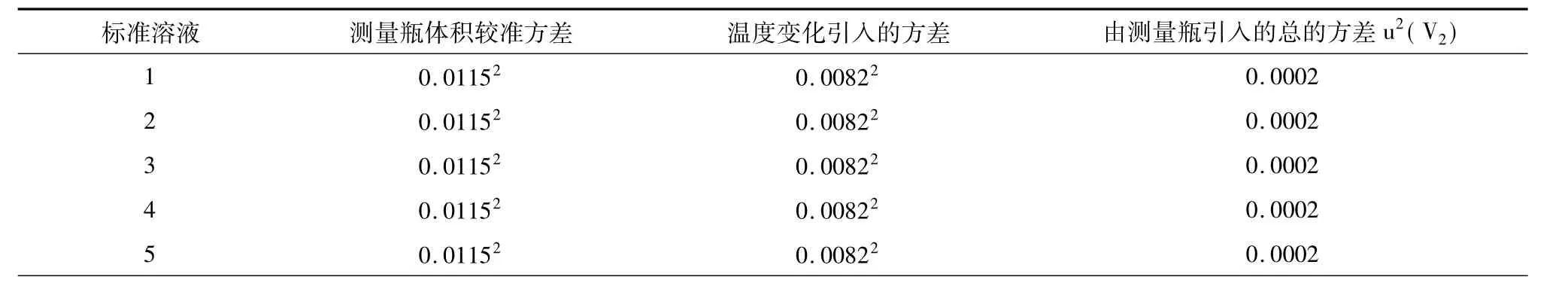
表9 测量瓶引入的方差u2(V2)
(4)浊度标准物质引入的不确定度
浊度标准物质证书给出相对扩展不确定度为Uref=3% ,换算为扩展不确定度为:
U=400×3%=12(NTU)
取包含因子k=2,故标准不确定度:
U(T)=12/2=6(NTU)
U2(T)=36(NTU2)[5]
(5)浊度计测定过程的合成不确定度

表10 各浊度范围对应的合成不确定度
2.2.7.5 总合成不确定度不确定度见表11。

表11 各浊度范围对应的总合成不确定度

2 1:400 +++ 0.571 3 1:800 ++ 1.125 4 1:1600 + 0.78 5 1:3200 - 1.4619
2.2.7.6 扩展不确定度
取包含因子 k=2,根据公式 U(y)=ku(y)[5],则相应的扩展不确定度见表12。

表12 各浊度范围对应的扩展不确定度
2.2.7.7 各方差组分对结果总方差的贡献
根据不确定度传播公式:u2(y)=u2(R)+u2(M)
总方差等于检测过程引入的方差与浊度计测定过程引入的方差之和,表13显示了各稀释度对应的检测过程引入的方差u2(R)和浊度计测定过程引入的方差u2(M)对结果总方差的贡献。
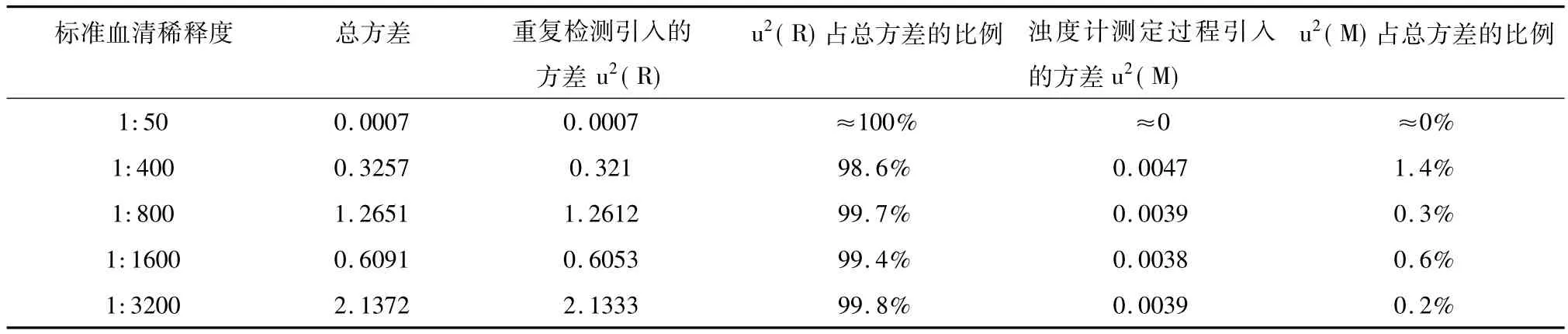
表13 牛布氏杆菌病试管凝集实验各方差分量对结果总方差的贡献
3 结果分析和应用
牛布氏杆菌病试管凝集实验结果的不确定度主要来源于两个过程:试管凝集实验过程和对反应结果的仪器测定过程,即重复检测引入的不确定度和浊度计测定过程的不确定度。来源于浊度计测定过程的不确定度又包括浊度计测量的不重复性引入的不确定度、移液器引入的不确定度、测量瓶引入的不确定度、浊度标准物质引入的不确定度。
由表13可以看出,对于各标准血清稀释度(测量值的浊度范围),不确定度主要来自于重复检测引入的不确定度,即来自于实验过程;浊度计测定过程引入的不确定度相对较小;实验过程中产生的不确定度大于浊度计测定过程中产生不确定度的3倍以上。因此在实验过程中,应严格遵照实验条件进行标准化操作,保证结果的准确性,降低检测的不确定性。
动物检疫实验室进行试管凝集试验时,大多要求对血清样品在一个指定校价(浓度)的情况下进行检测,如“被检血清1:6阴性”。这时,实验室将被检血清做1:6稀释后加入相应稀释好的抗原进行反应。如果凝集价达到“++”或“+++”、“++++”,即被认为是阳性反应。本研究计算了不同血清稀释度检测结果的不确定度,可以看出,不同稀释度样品检测结果的不确定度有差异,应该重点关注的是涉及到阴阳性判定检测结果。对于本实验来说,需要重点关注的就是“++”和“+”的结果。
(1)“++”的检测结果
对于一个给定的样品,可以采用与定量检测结果相同的方式表述该类实验检测结果真值的范围,即检测值(浊度值)±不确定度,即可得到测得值的分散范围。
在本实验中,对于“++”的检测结果,应该考虑其数值的上限(“++”检测值+不确定度)是否有大于“+”比浊管浊度值的下限(“+”比浊管检测值-比浊管不确定度)的可能。
如果:X(++)+U(y)(++)≥ X(+比浊管)- U(y)(+比浊管)
说明检测结果为“++”样品的检测结果有超出阴性检测结果下限的可能,检测结果值的范围有交叉,则应谨慎对待检测结果。见图1。

图1 “++”检测结果的判定
在以上3种情况下,检测结果为“++”样品的检测结果上限均超出了“+”比浊管的浊度值下限,说明该检测结果可疑,该应考虑重复实验。
(2)“+”的检测结果
对于“+”的检测结果,应该考虑其数值的下限(“+”检测值-不确定度)是否有小于“++”比浊管浊度值的上限(“++”比浊管检测值+比浊管不确定度)的可能。
如 果: X(+)- U(y)(+)≤ X(++比浊管)+U(y)(++比浊管)
说明检测结果为“+”样品的检测结果有超出阳性检测结果上限的可能,检测结果值的范围有交叉,则应谨慎对待检测结果。见图2。

图2 “+”检测结果的判定
在以上3种情况下,检测结果为“+”样品的检测结果下限均超出了“++”比浊管浊度值的上限,说明该检测结果可疑,该应考虑重复实验。
4 讨论
根据《测量不确定度表示指南》(GUM),测量不确定度是与测量结果相关联的一个参数,用以表征合理地赋予被测量之值的分散性。在测量科学领域,不确定度目前已经应用的较为广泛,但在动物检疫领域,不确定度的应用还是一个很新的概念,多数工作还停留在理论研究阶段,许多技术人员对不确定度缺乏了解,更谈不上应用。
由于生物检测过程的复杂性和实验过程中的种种不确定性,使得对于检测结果不确定度的评估很困难。很多的动物检疫实验的检测结果属于定性结果或者半定量结果,无法对检测结果进行不确定性的评估,从而对检测结果的可信度不能进行量化,使得实验室间检测结果的比较变得十分困难。因此,国内外动物检疫实验室检测方法不确定度的评估仍处于初步探讨的阶段。
本研究以牛布氏杆菌病为例,研究了试管凝集实验测量不确定度的评估方法。试验中引入了浊度的概念,将试管凝集实验的结果进行量化,转化成为数值,从而使对该实验不确定度的评估成为可能。将总的不确定度按照实验过程分解成了实验过程中产生的不确定度和浊度计测定过程中产生的不确定度,建立了对该试验不确定度的评估方法。
本研究对不同血清稀释度的检测结果进行了不确定度的评估。研究结果表明,不同抗体浓度下,检测结果的不确定度不同。在本试验中,需要关注的是检测结果为“++”和“+”样品的不确定度。但在不同的实验中,对于不同的检测结果判定标准,需要关注的目标可能不同。本研究总结出了实际工作中应用不确定度数值的方法,为如何确定试管凝集实验检测结果真值的范围提供有益的参考,为动物检疫领域半定量和定性类检测结果的不确定度评估提供了思路。
[1] NATIONAL STANDARD METHOD:AGGLUTINATION TEST(BSOPTP 3).Issued by Standards Unit,Department for Evaluations,Standards and Training,Health Protection Agency of Ireland.
[2] SN/T1088-2010布氏杆菌检疫技术规范[S].
[3] JJF 1059-1999测量结果的不确定度评定[S].
[4] JJG 880 -2006浊度计检定规程[S].
[5] 中国合格评定国家认可委员会秘书处.实验室认可与管理基础知识(试行版).2007.

