不同品种山葡萄果皮和酒中非花色苷酚的成分分析1)
赵 权
(吉林农业科技学院,吉林,132101)
王 军
(中国农业大学)
杨成君
(东北林业大学)
酚类物质是葡萄浆果中一种重要的次生代谢产物,对葡萄浆果和葡萄酒的感官质量有重要影响,尤其对红葡萄酒的色泽、苦味、收敛性、澄清度和稳定性等起重要作用[1-3]。前人研究表明,酚类物质具有防癌抗癌[4-7]、免疫调节活性[8]、预防心脑血管疾病[9]、抗疲劳[10]、抗过敏及抗炎、改善视觉功能[11]、保护肝脏、清除自由基、抗突变、降低血清胆固醇等作用[12]。非花色苷酚类物质是指除花色苷以外的酚类物质,包括苯甲酸类、肉桂酸类、黄烷-3-醇类、黄酮醇类、白藜芦醇类。这些物质在葡萄酒发酵及陈酿过程中的变化极其复杂,对葡萄酒的质量有很大的影响[13-15]。葡萄浆果中含有大量非花色苷酚类物质,主要分布于果皮、种子和果梗中,在葡萄酒酿造过程中这些物质被浸渍到葡萄酒中。山葡萄(Vitis amuremsis Rupr.)是东北地区酿造葡萄酒的主要原料,山葡萄酒具有甜酸可口、浓郁醇厚、余味绵长之特点,长期饮用可促进血液循环,消除疲劳,增强体质[16]。目前,国内外对欧亚葡萄果皮及酒非花色苷酚的种类、质量分数等研究较多[17-21],但是对山葡萄的研究较少,特别是对山葡萄果皮和酒中非花色苷酚种类和质量分数的研究未见报道。
本研究以7个山葡萄品种为材料,利用HPLCMS/MS技术对山葡萄果皮和酒中非花色苷酚种类及质量分数进行分析,探讨不同品种山葡萄果皮和酒中非花色苷酚的组成及质量分数的差异及特点,研究结果将为山葡萄酒的加工以及品种选育提供理论依据。
1 材料与方法
以山葡萄左山一、左山二、左红一、左优红、双丰、双红、双优7个品种为试验材料,于2008年9月份采自中国农业科学院特产研究所国家山葡萄种质资源圃。果实为商品成熟期,左山一、左山二、双丰采摘时期为9月8日;左红一、左优红、双红、双优采摘时期为9月10日。
流动相甲醇(HPLC)、乙腈(HPLC)、冰醋酸(HPLC)均购于 Fisher公司(Fairlawn,NJ,USA),采用 Milli-Q(Milipore,Bedford,MA)系统制备的超纯水。标准样品没食子酸、儿茶素、咖啡酸、白藜芦醇、槲皮素均由 Sigma(Chemical Co.,St.Louis,USA)公司购买。
KG2200B型超声波清洗器;RE-52AA型旋转蒸发器;SHZ-III型循环水真空泵。Agilent 1200系列LC/MSD离子阱液相色谱—质谱联用仪、G1379A真空溶剂脱气机、G1311A四元高压梯度泵、G1313A自动进样器、G1316A柱温箱、G1315A二极管阵列检测器(DAD),所有仪器均由Agilent 5.3版本的化学工作站控制。
山葡萄果皮中非花色苷酚的提取:山葡萄剥皮,液氮研磨成粉末,冷冻干燥。称取5.000 g粉末加入50 mL 90%的丙酮水溶液,在室温条件下,水浴摇床浸提 30 min,离心(4000 r·min-1,5 min),重复提取5次,合并提取液,30℃旋转蒸发至干,残留物用甲醇定容到5 mL,-20℃保存待测。
山葡萄酒的酿造及酒中非花色苷酚类物质的萃取:葡萄浆果→精选→破碎→主发酵→皮渣分离(第4 d)→加相应葡萄品种浓缩汁→后发酵→倒罐→原酒→澄清过滤→陈酿→ -40℃冷冻保存(第30 d),待测。此时,7个山葡萄酒的酒精度为10.7% ~11.8%,总酸度为8~10.5,符合国家山葡萄酒质量标准。葡萄酒样的萃取条件根据Garcia-Viguera et al.[22]并有所改动。用 100 mL容量瓶分别取 100 mL的葡萄酒样和100 mL水,混合后,用80 mL的乙酸乙酯连续萃取3次,均用分液漏斗提取分离,酯相部分30℃进行真空旋转蒸发,残留物溶解定容到5 mL的甲醇色谱纯中,并置-30℃避光保存备用,在HPLC分析前用0.45 μm膜过滤。
高效液相色谱—质谱(HPLC-DAD-MS)分析:试验采用Agilent 1100系列LC/MSD离子阱液相色谱—质谱联用仪进行标准物质以及实际酒样的LCUV-MS分析,包括在线G1379A真空溶剂脱气机、G1311A四元高压梯度泵、G1313A自动进样器、G1316A柱温箱、G1315A二极管阵列检测器(DAD)。色谱柱采用反相 250×4.6 mm,5 μm 的Zorbax SB C-18柱(Agilent Technologies)。流动相A:1.0%的醋酸水溶液;流动相B:1.0%醋酸甲醇溶液。洗脱程序:0~15 min,10% ~26%B;15~30 min,26% ~40%B;30~50 min,40% ~65%B;50~60 min,65% ~95%B;60 ~63 min,95% ~10%B;63 ~66 min,10%B。流速 1.0 mL·min-1;柱温 25℃;检测波长280 nm;进样量10 μL。MSD参数:离子源为ESI,采用负离子模式;雾化气压力为30 psi;干燥气流速为10 mL·min-1;干燥气温度为325℃;离子扫描范围为100~1500 m·z-1。CID的MS/MS诱导碰撞能量为1.0 V。
非花色苷酚类物质标准曲线的绘制:配制8个质量浓度水平的5种混标,每个水平重复3次,以各组分的平均峰面积(y)对质量浓度(ρ,mg·L-1)在工作站中建立标准曲线[23-25],非花色苷酚标准品、线性方程及相关系数见表1。结果表明,5种标准酚类化合物在相应的线性范围内相关系数均在0.998以上,说明线性良好,可以满足定量的需要。

表1 5种非花色苷酚的线性方程及相关系数
2 结果与分析
2.1 不同品种山葡萄果皮中非花色苷酚成分及其质量分数
应用HPLC-MS/MS技术,从7个品种山葡萄果皮中共检测出非花色苷酚18种(表2和图1),其中苯甲酸类3种,肉桂酸类4种,黄烷-3-醇类3种,黄酮醇类5种,白藜芦醇类3种。
由表2和图1可以看出,不同品种山葡萄果皮检测出的非花色苷酚成分种类和质量分数略有差别。左山一检测出非花色苷酚12种,其中苯甲酸类2种,肉桂酸类3种,黄烷-3-醇类1种,黄酮醇类5种,白藜芦醇类1种。所有非花色苷酚成分中,槲皮素3-O-葡萄糖苷质量分数最高,为365.302 μg·g-1。
左山二检测出非花色苷酚12种,其中苯甲酸类3种,肉桂酸类3种,黄烷-3-醇类2种,黄酮醇类4种,白藜芦醇类未检测到。所有非花色苷酚成分中,反式—杨梅酮3-O-葡萄糖苷质量分数最高,为138.762 μg·g-1。
左红一检测出非花色苷酚15种,其中苯甲酸类2种,肉桂酸类4种,黄烷-3-醇类1种,黄酮醇类5种,白藜芦醇类3种。槲皮素3-O-葡萄糖苷酸质量分数最高,为 446.467 μg·g-1。
左优红检测出非花色苷酚15种,其中苯甲酸类3种,肉桂酸类4种,黄烷-3-醇类1种,黄酮醇类5种,白藜芦醇类2种。其中反式—杨梅酮3-O-葡萄糖苷为质量分数最高物质,为 136.653 μg·g-1。
双红检测出非花色苷酚13种,其中苯甲酸类1种,肉桂酸类3种,黄烷-3-醇类3种,黄酮醇类4种,白藜芦醇类2种。其中反式—单咖啡酰酒石酸质量分数最高,为 1020.612 μg·g-1。
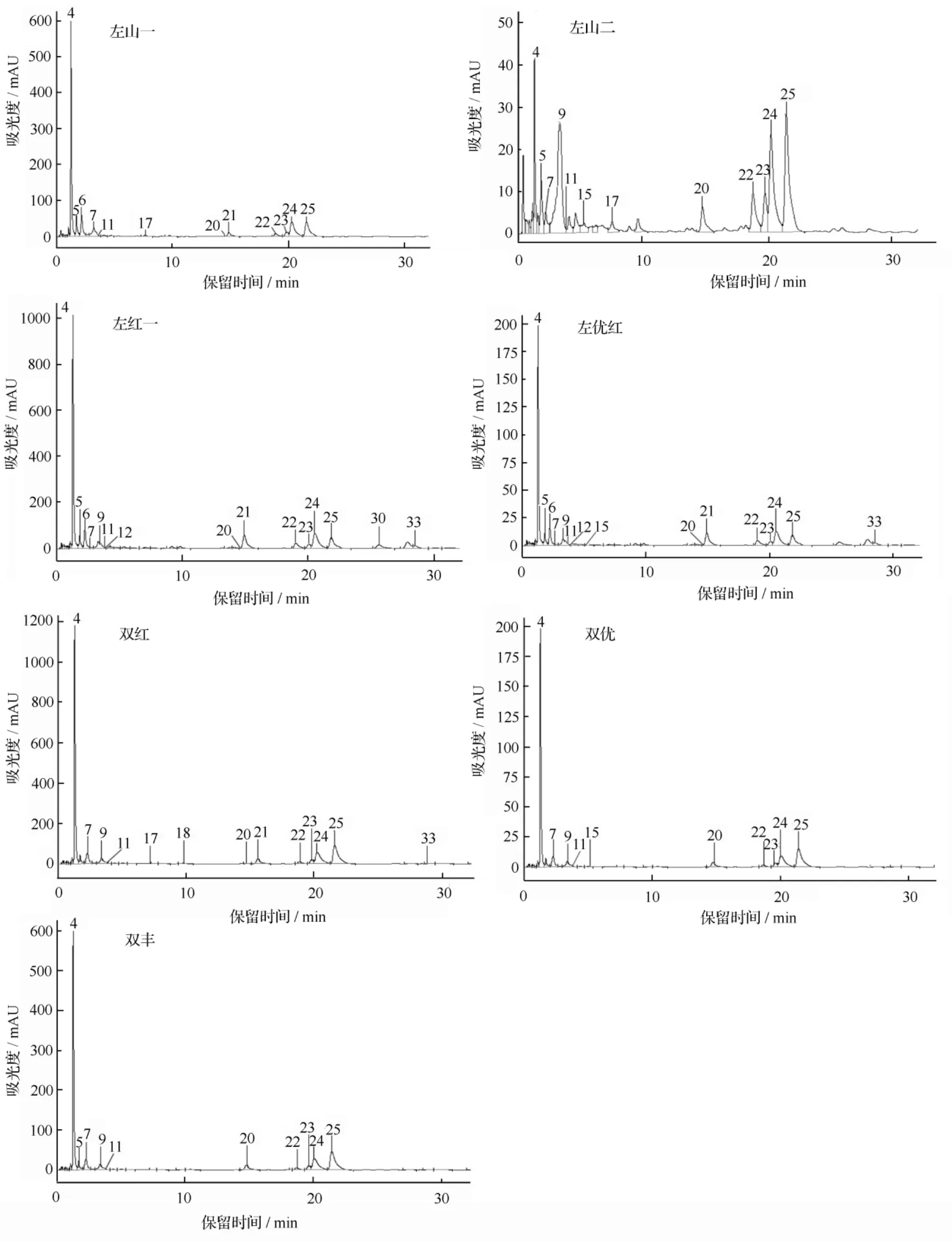
图1 不同品种山葡萄果皮中非花色苷酚HPLC色谱图
双优检测出非花色苷酚10种,其中苯甲酸类2种,肉桂酸类3种,黄烷-3-醇类1种,黄酮醇类4种,白藜芦醇类未检测到。其中槲皮素3-O-葡萄糖苷酸为质量分数最高物质,为 427.122 μg·g-1。
双丰检测出非花色苷酚10种,其中苯甲酸类2种,肉桂酸类3种,黄烷-3-醇类1种,黄酮醇类4种,白藜芦醇类未检测到。其中槲皮素3-O-葡萄糖苷为质量分数最高物质,为 452.82 μg·g-1。
7个品种比较显示,双红非花色苷酚质量分数最高,为 3172.907 μg·g-1,之后依次为左红一、双优、双丰、左山一、左山二、左优红。
对7个品种山葡萄果皮中的苯甲酸类、肉桂酸类、黄烷-3-醇类、黄酮醇类、白藜芦醇类5类化合物的质量分数进行了分析。结果表明,肉桂酸类和黄酮醇类是山葡萄果皮非花色苷酚的主要化合物,这2类化合物的质量分数显著高于其他3类化合物质量分数。其中左山一黄酮醇类质量分数占总非花色苷酚的61.31%,肉桂酸类占23.74%,苯甲酸类、黄烷-3-醇类、白藜芦醇类3类仅占14.95%。左山二黄酮醇类质量分数占总非花色苷酚的57.51%,苯甲酸类和肉桂酸类分别占16.29%和11.55%,黄烷-3-醇类占14.65%,在7个品种中所含的比例最高。左红一黄酮醇类占总非花色苷酚的55.42%,其次为肉桂酸类23.39%,白藜芦醇类占11.91%。左优红黄酮醇类占47.25%,其次为肉桂酸类,占24.86%,白藜芦醇类占15.45%,在7个品种中所含的比例最高。双红黄酮醇类占58.56%,其次为肉桂酸类,占36.12%,苯甲酸类、黄烷-3-醇类、白藜芦醇类3类仅占5.32%。双优黄酮醇类占74.78%,其次为肉桂酸类,占16.04%。双丰黄酮醇类占72.41%,其次为肉桂酸类,占20.75%。
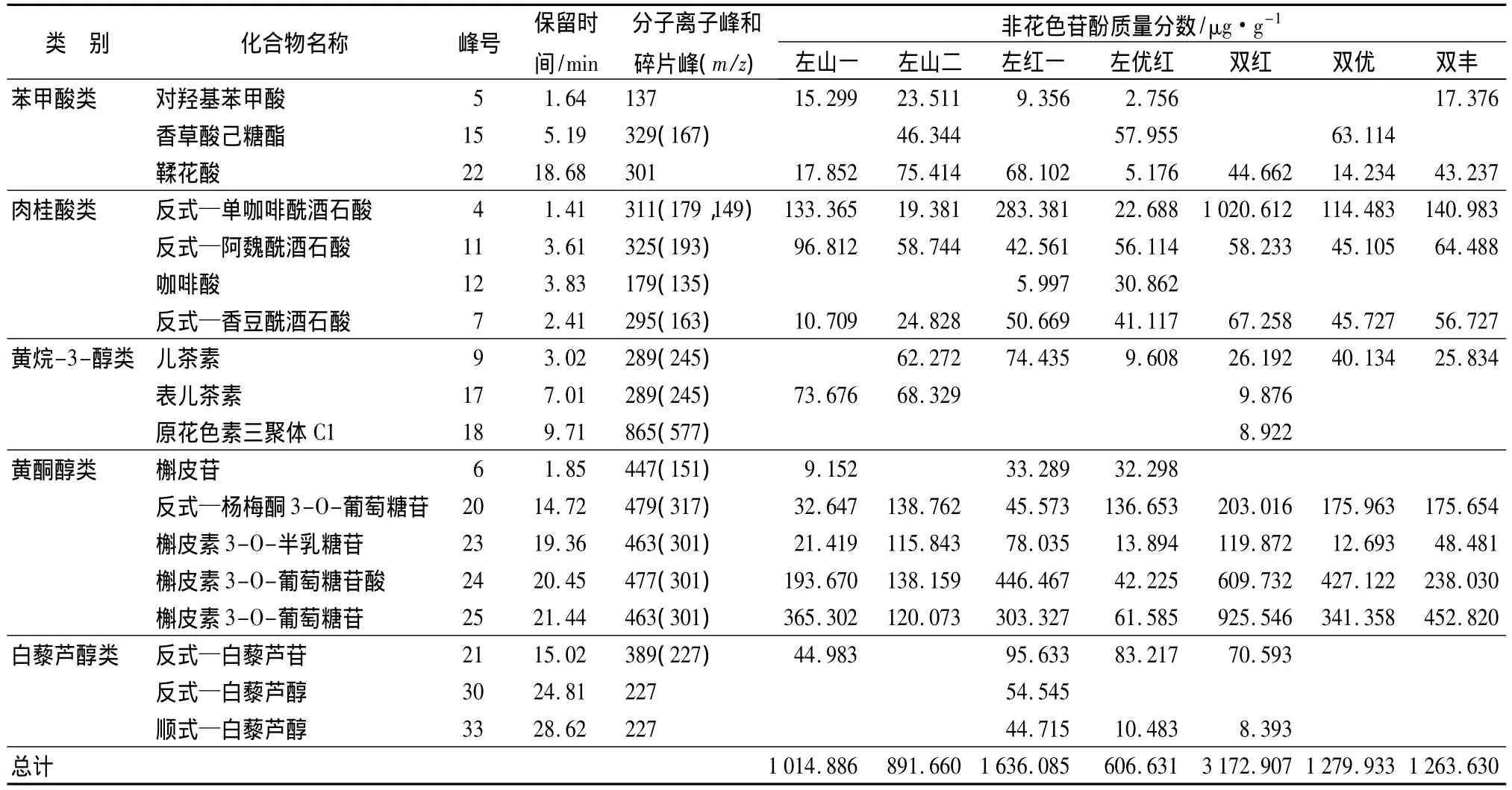
表2 不同品种山葡萄果皮中非花色苷酚的HPLC-MS/MS鉴定成分及质量分数
2.2 不同品种山葡萄酒中非花色苷酚成分及其质量浓度
应用HPLC-MS/MS技术,从7个品种山葡萄酒中共检测出非花色苷酚30种(表3和图2),其中苯甲酸类5种,肉桂酸类7种,黄烷-3-醇类5种,黄酮醇类9种,白藜芦醇类4种。

表3 不同品种山葡萄酒中非花色苷酚的HPLC-MS/MS鉴定成分及质量浓度
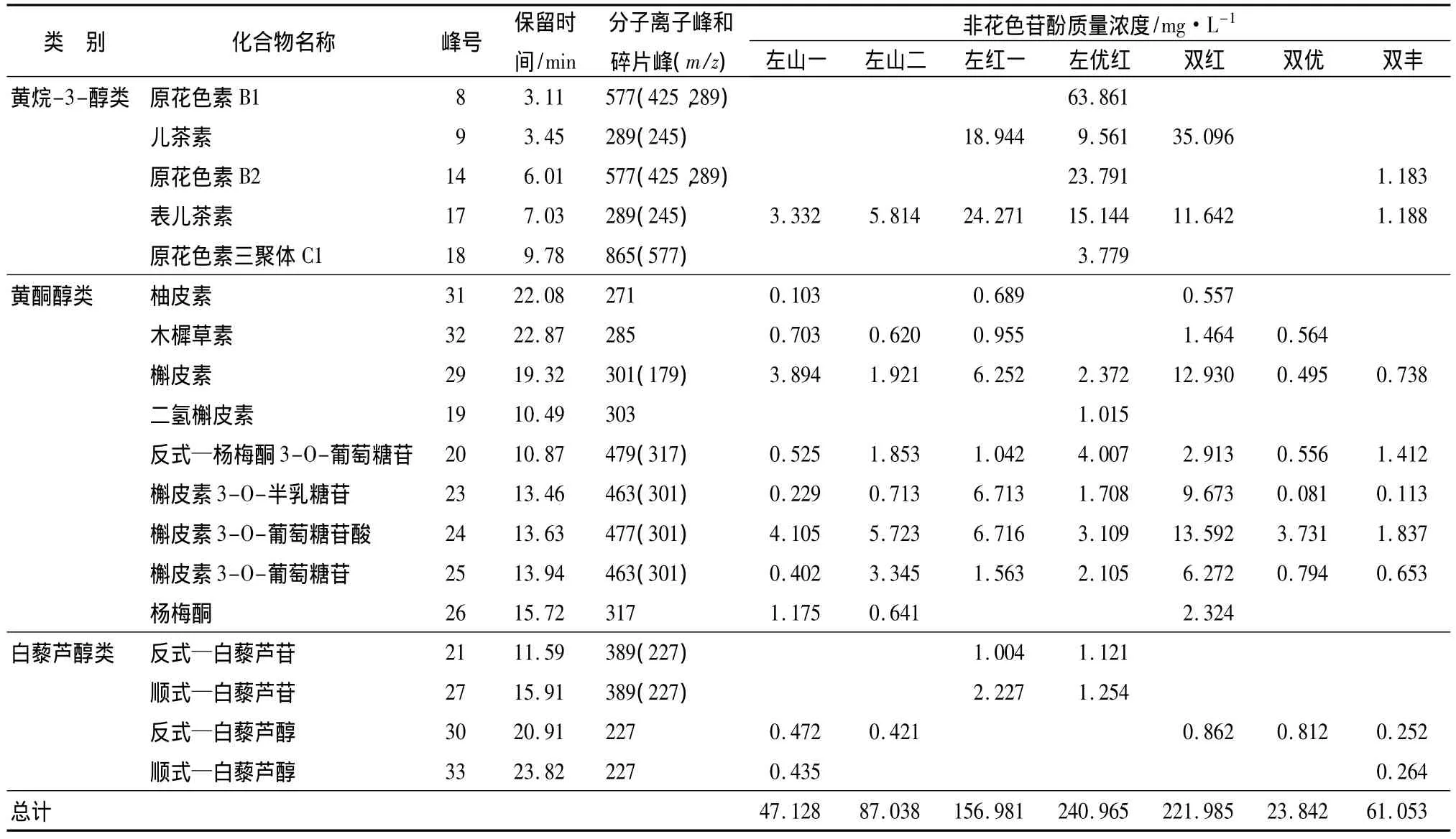
表3 (续)
由表3和图2可以看出,不同品种山葡萄酒非花色苷酚成分种类和质量浓度差别较大。左山一酒中检测出非花色苷酚21种,其中苯甲酸类5种,肉桂酸类5种,黄酮醇类8种,白藜芦醇类2种,黄烷-3-醇类1种。所有非花色苷酚成分中,反式—香豆酰酒石酸质量浓度最高,为 8.063 mg·L-1。
左山二检测出非花色苷酚19种,其中苯甲酸类5种,肉桂酸类5种,黄烷-3-醇类1种,黄酮醇类7种,白藜芦醇类1种。所有非花色苷酚成分中,反式—单咖啡酰酒石酸质量浓度最高,为43.427 mg·L-1。
左红一检测出非花色苷酚20种,其中苯甲酸类5种,肉桂酸类4种,黄烷-3-醇类2种,黄酮醇类7种,白藜芦醇类2种。反式—单咖啡酰酒石酸质量浓度最高,为 66.872 mg·L-1。
左优红检测出非花色苷酚25种,其中苯甲酸类5种,肉桂酸类7种,黄烷-3-醇类5种,黄酮醇类6种,白藜芦醇类2种。其中原花色素B1质量浓度最高,为 63.861 mg·L-1。
双红检测出非花色苷酚21种,其中苯甲酸类5种,肉桂酸类5种,黄烷-3-醇类2种,黄酮醇类8种,白藜芦醇类1种。其中反式—单咖啡酰酒石酸质量浓度最高,为 94.324 mg·L-1。
双优检测出非花色苷酚17种,其中苯甲酸类5种,肉桂酸类5种,黄烷-3-醇类未检测到,黄酮醇类6种,白藜芦醇类1种。其中丁香酸为质量浓度最高物质,为 8.897 mg·L-1。
双丰检测出非花色苷酚20种,其中苯甲酸类5种,肉桂酸类6种,黄烷-3-醇类2种,黄酮醇类5种,白藜芦醇类2种。反式—单咖啡酰酒石酸质量浓度最高,为 32.652 mg·L-1。
7个品种比较显示,左优红酒中非花色苷酚质量浓度最高,为 240.965 mg·L-1,之后依次为双红、左红一、左山二、双丰、左山一、双优。
对7个品种山葡萄酒中的苯甲酸类、肉桂酸类、黄烷-3-醇类、黄酮醇类、白藜芦醇类5类化合物的质量浓度进行了分析。结果显示,苯甲酸类、肉桂酸类和黄酮醇类是左山一酒中主要的非花色苷酚物质,分别占总质量浓度的37.75%、30.26%和23.85%,白藜芦醇类仅占1.01%。左山二肉桂酸类质量浓度最高占62.87%,其次是黄酮醇类和苯甲酸类分别占17.02%、12.94%。左红一肉桂酸类质量浓度最高,占48.26%,其次是黄烷-3-醇类占 27.53%。白藜芦醇类占2.06%。左优红中质量浓度最高的是黄烷-3-醇类,占48.20%,其次是肉桂酸类占39.12%。双红中肉桂酸类质量浓度最高,占48.08%,黄烷-3-醇类和黄酮醇类质量浓度基本相同,分别占21.05%和22.40%。双优酒中没有检测到黄烷-3-醇类化合物。其酒中苯甲酸类质量浓度最高,占41.60%,肉桂酸类和黄酮醇类质量浓度基本相同,分别占28.90%和26.09%,白藜芦醇类占3.41%,是7个品种中所占比例最高的。双丰酒中肉桂酸类质量浓度最高,占69.50%,其次是苯甲酸类,占 17.99%。
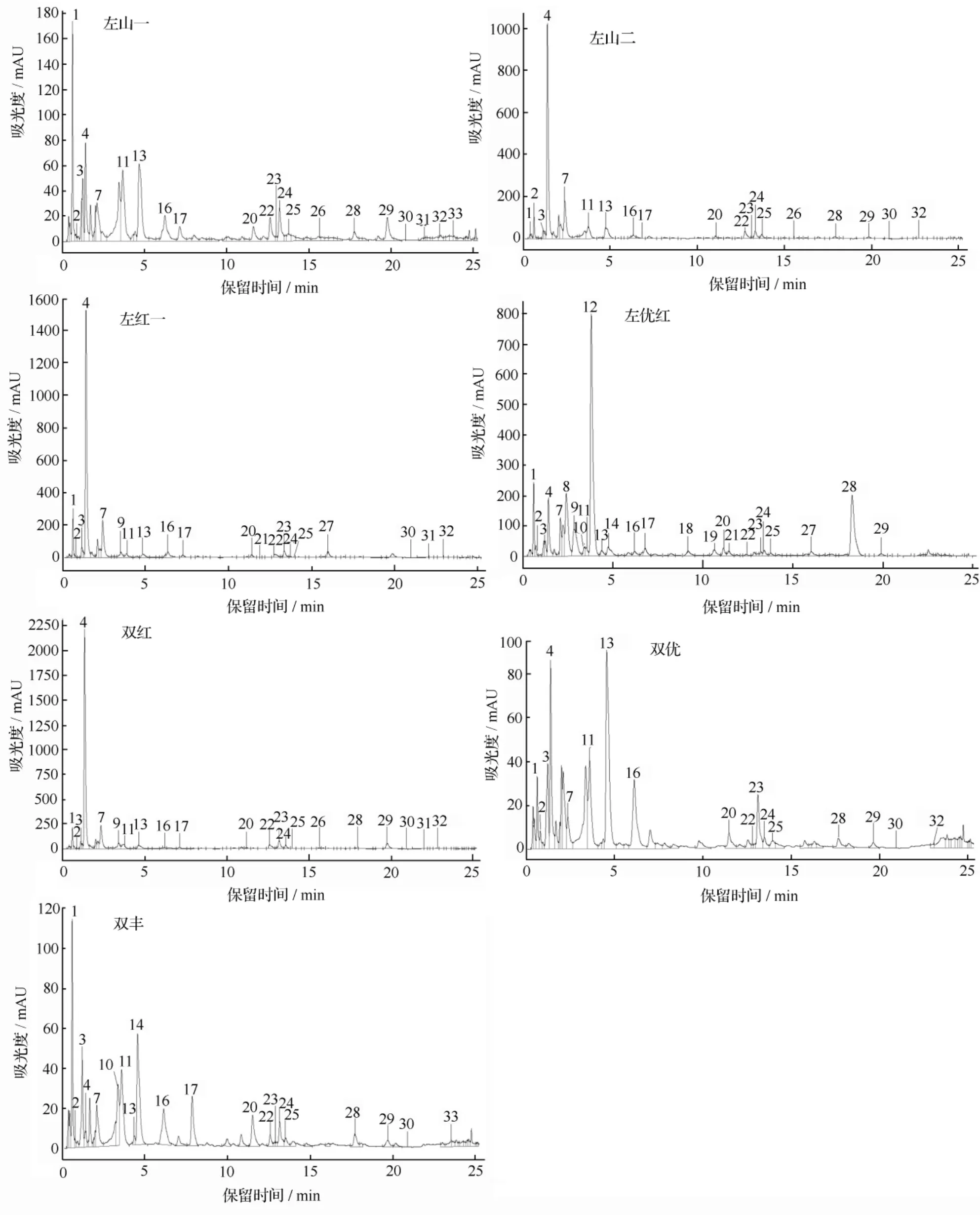
图2 不同品种山葡萄酒中非花色苷酚HPLC色谱图
3 结论与讨论
近年来,我国葡萄酒企业为了保持国内市场优势和不断开拓国外市场,都不同程度地注重了葡萄酒的质量稳定和提高。酚类物质是葡萄浆果中重要的次生代谢产物,在葡萄酒酿造过程中通过浸渍溶到酒中,对葡萄酒的色泽、风味和口感上的收敛性有重要影响,构成葡萄酒的“骨架成分”,被作为评判干型葡萄酒质量的关键组分,多年来,这一直为国内外葡萄与葡萄酒研究领域中的热点。但是目前山葡萄酒市场混杂,标签混乱,单品种酒少,勾兑酒居多,真假难辨已成为制约我国山葡萄酒产)业发展的因素。稳定和提高山葡萄酒质量,并与国际先进葡萄酒技术尽快接轨,从而有力地推动了我国特色山葡萄酒产业的发展壮大。现代发展起来的高效液相色谱—质谱(HPLC-MS/MS)技术,已成为酚类物质分析最有效的工具之一,本试验利用HPLC-MS/MS联用技术,分析不同品种山葡萄果皮和酒中非花色苷酚成分的差异,结果表明,不同品种山葡萄果皮非花色苷酚质量分数和酒中非花色苷酚质量浓度及组成比例不同,其组成具有品种特征,肉桂酸类和黄酮醇类是山葡萄果皮及酒非花色苷酚的主要化合物,左优红酒与之不同,以黄烷-3-醇类和肉桂酸类为主。研究山葡萄果皮及酒中的酚类物质种类及组成比例特征,将为山葡萄品种、山葡萄酒原料品种以及山葡萄酒营养保健等方面的鉴定提供科学的依据。
[1]Picinelli A,Suárez B,García L,et al.Changes in phenolic contents during sparkling apple winemaking[J].American Journal of Enology and Viticulture,2000,51(2):144-149.
[2]Gawel R.Red wine astringency:a review[J].Australia Journal Grape,1998,4:74-95.
[3]Hardie W,Considing J.Response of grapes to water-deficit stress in particular stages of development[J].American Journal of Enology and Viticulture,1976,27:55-61.
[4]Yamagishi M,Natsume M,Osakabe N,et al.Effects of cacao liquor proanthocyanidins on PhIP-induced mutagenesis in vitro,and in vivo mammary and pancreatic tumorigenesis in female Sprague-Dawley rates[J].Cancer Letter,2002,185(2):123-130.
[5]Marimiroli N,Restivo F M,Donnini C,et al.Analaysis of rhomutability in saccharomyces cerevisiae.Ⅱ.Role of the mitochondrial protein synthsis[J].Molecular and General Genetics,1980,177(4):589-595.
[6]赵万州,陆茵,闫新琦,等.葡萄籽原花青素抗促癌作用的实验研究[J].中草药,2003,1(12):917-920.
[7]郑健仙.功能性食品[M].北京:中国轻工业出版社,1999:26.
[8]凌智群,谢笔均.莲房原花青素抗氧化损伤作用的研究[J].食品科学,2002,23(7):98-100.
[9]张小郁,李文广,高明堂,等.葡萄籽中原花青素对心肌细胞的保护作用[J].中国药理与临床,2001,17(6):14-16.
[10]刘协,李小宁,包六行,等.葡萄籽提取物原花青素的抗疲劳作用的研究[J].实用预防医学,2004(1):36-37.
[11]赵超英,姚小曼.葡萄籽提取物原花青素的营养保健功能[J].中国食品卫生杂志,2000(6):38-41.
[12]Kong Jinming,Chia L S,Goh N K,et al.Analysis and biological activities of anthocyanins[J].Phytochemistry,2003,64:923-933.
[13]Hunter J,De Villier O,Watts J.The effect of partial defoliation on quality characteristics of Vitis vinifera L.cv.Cabernet Sauvignon grapes.II.Skin color,skin sugar,and wine quality[J].American Journal of Enology and Viticulture,1991,42:13-18.
[14]Silvia P,Luisa M.Effect of ripening stage of grapes on the low molecular weight phenolic compounds of red wines[J].European Food Research Technology,2005,220:579-607.
[15]Maria M,Pedro J M,Begona B,et al.Statistical interpretation of the color parameters of red wines in function of their phenolic composition during aging in bottle[J].European Food Research Technology,2006,222:702-709.
[16]张金柱,戴永平,王万民.山葡萄资源开发及利用[J].中国林副特产,2002(2):58.
[17]温鹏飞.葡萄与葡萄酒中黄烷醇类多酚和果实原花色素合成相关酶表达规律的研究[D].北京:中国农业大学,2005.
[18]王美丽.葡萄成熟过程与葡萄酒陈酿过程单体酚变化的研究[D].杨陵:西北农林科技大学,2006.
[19]孙建平.葡萄与葡萄酒中酚类物质LC-UV-MS/MS谱库构建及应用[D].北京:中国农业大学,2006.
[20]姜寿梅.西拉葡萄果实成熟过程中果皮内非花色苷酚类物质的变化[J].中外葡萄与葡萄酒,2008,6:20-24.
[21]Jin Zanmin,He Jianjun,Bi Heqiong,et al.Phenolic compound profiles in berry skins from nine red wine grape cultivars in northwest China[J].Molecules,2009,14:4922-4935.
[22]Garcia-Viguera C,Bridle P.Analysis of non-coloured phenolic compounds in red wines,a comparison of hige-performance liquid chromatography and capillary zone electrophresis[J].Food Chemistry,1995,54:349-352.
[23]赵权,王军,段长青.山葡萄果实发育过程中花色苷和非花色苷酚成分及其含量的变化[J].植物生理学通讯,2010,46(1):80-86.
[24]Pérez-Magari~no S,Revilla I,González-Sanjosé M L,et al.Various applications of liquid chromatography-mass spectrometry to the analysis of phenolic compounds[J].Journal of Chromatography A,1999,847:75-81.
[25]La Torre G L,Saitta M,Vilasi F,et al.Direct determination of phenolic compounds in Sicilian wines by liquid chromatography with PDA and MS detection[J].Food Chemistry,2006,94(4):640-650.

