激流式生物反应器培养MDCK细胞条件优化
余彬辉,王斌卿,胡志航,朱炳林,李肖梁,方维焕
(1.浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,浙江杭州310058;2.杭州荐量兽用生物制品有限公司,浙江杭州310018)
当今病毒性疫苗多利用转瓶培养,生产工艺不仅费时费力,而且占用空间大,更重要的是病毒滴度不稳定,批次之间病毒效价差异大。随着疫苗市场的迅速发展,其生产技术将经历一场深刻的技术革新,从转瓶培养向生物反应器培养转变。这种转变符合世界生物制药发展趋势,也表明我国疫苗生产技术将逐步与国际疫苗生产技术接轨。动物细胞大规模培养在疫苗生产领域发挥着越来越重要的作用[1]。动物细胞大规模培养和表达对生产疫苗有明显的优势,一方面活性高、稳定性好,是最重要的表达系统,但动物细胞大规模培养生产疫苗还存在一定问题[2-3],培养密度和产物浓度较低,在技术和设备上远没有原核细胞培养成熟。
目前用于动物细胞培养的生物反应器有很多种,但各具优缺点[4-5]。如常见的搅拌式生物反应器,虽然混合传气效果较好、细胞培养密度高,但高的剪切力产生大量的细胞碎片影响产物质量,而且给分离带来一定困难[6];激流灌注式生物反应器是一种新型简便的生物反应器[7],可用于贴壁和悬浮两种模式的细胞培养。该反应器采用一次性塑料耗材,灌注培养系统采用外循环式细胞载体灌注培养工艺,将装有纸片载体的培养袋(即灌注系统)固定于反应器外,动物细胞贴壁生长于纸片载体上,通过蠕动泵及重力作用打入培养基,实现激流系统和灌注系统的循环,培养液供给细胞正常生长代谢所需的养分,带走代谢产物;利用激流式生物反应器拖带式传气技术在线监控溶氧、p H、温度等培养条件,为细胞生长创造有利的环境,同时此部分也可单独进行悬浮细胞的培养。
本试验应用激流式生物反应器培养MDCK细胞,通过对培养基、细胞接种密度、耗糖量、溶氧量、p H和温度等参数的优化,建立MDCK细胞生物反应器规模化扩繁技术,为获得高密度细胞及在病毒疫苗生产中应用的奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞和试剂 MDCK细胞,中国科学院细胞库上海生命科学院产品;MEM、DMEM、DMEM/F12培养基,Gibco公司产品;胎牛血清,杭州四季青公司产品;胰酶,上海泽衡生物公司产品;葡萄糖测定试剂盒,为上海史瑞克生物公司产品;其他试剂为国产分析纯。
1.1.2 仪器设备 分光光度计、高效液相色谱仪、倒置显微镜、AP10 4L生物反应器、溶氧电极、p H计、细胞转瓶等。
1.2 方法
1.2.1 细胞培养
1.2.1.1 细胞复苏 从液氮罐中取出1管MDCK细胞于37℃快速解冻后,加到含100 mL/L胎牛血清的DMEM培养基,在75 cm2细胞培养瓶中培养,4 h换液。待长成单层后PBS清洗1次,胰酶消化后以1∶4~1∶5的比率传代扩繁。
1.2.1.2 转管培养 加适量MDCK细胞和纸片载体于转管中(40 mL培养体系),采用间歇换液法培养,48 h后每12 h半数换液。
1.2.1.3 激流生物反应器培养
1.2.1.3.1 准备工作 将激流袋和灌注袋充气后检漏,气密性完好的情况下将PBS注入灌注袋浸泡纸片载体。将p H、温度和溶氧电极分别校准后装入盛有PBS缓冲液的不锈钢桶中121℃高压灭菌30 min。
1.2.1.3.2 细胞培养 安装好反应器和电极后,在AP10反应器中加4 L DMEM-HG。设定条件:纸片载体100 g,p H 7.2、溶氧量(DO)50%~60%,37℃、循环速度400 mL/min、振荡频率60 r/min,接入1.5×106个/mL MDCK细胞进行培养。
1.2.2 细胞培养条件处理 按培养基种类、p H、接种密度、DO值等参数对细胞生长的影响进行以下不同处理。
1.2.2.1 培养基 在纸片载体0.6 g、细胞接种密度2.5×105个/mL培养体系为40 mL等固定条件下,分析不同培养基(MEM、DMEM/F12、DMEMHG或DMEM-LG)对细胞生长的影响。
1.2.2.2 p H 在纸片载体0.6 g、37℃,细胞接种密度2.5×105个/mL固定条件下,分析不同p H(6.8、7.0、7.2、7.4、7.6)对细胞生长的影响。
1.2.2.3 细胞接种密度 在纸片载体 0.6 g、DMEM-HG培养基、p H 为7.2、37℃,40 mL培养体系的条件下,细胞接种密度分别为1.25×105、2.50×105、3.75×105、5.0×105、7.5×105个/mL时的生长状况。
1.2.2.4 溶氧量 纸片载体100 g、细胞接种密度1.5×106个/mL、摇床速度60 r/min、流量400 mL/min、p H7.2、37℃等固定条件下,DO分别设为20%~40%、50%~60%、70%~80%对细胞生长的影响。
1.2.2.5 液体流量和震荡频率 载纸片体100 g、细胞接种密度(1.5×106个/mL)、DO(50%~60%)、p H7.2和温度(37℃)等固定条件下,不同液体流量(200、300、400、500 mL/min)和不同振荡频率(40、60、80 r/min)培养对细胞增殖的影响。
1.2.3 细胞生长分析 将培养的细胞用PBS清洗2遍后,加入含1 g/L结晶紫的柠檬酸溶液1 L于37℃温室放置40 min揉搓摇匀后取样计数,用细胞计数板计数,计算细胞密度。
1.2.4 细胞代谢分析
1.2.4.1 葡萄糖测定 按照葡萄糖测定试剂盒说明书进行。
1.2.4.2 氨基酸测定 按照氨基酸测定试剂盒说明书进行。
1.2.4.3 纸片贴壁率计算
贴壁率(%)=X1/X0×100%
X0代表接种时的细胞量,X1代表3h后纸片载体上的细胞贴壁数。
2 结果
2.1 不同培养基对MDCK细胞生长和代谢的影响
DMEM-HG培养MDCK细胞5 d,细胞密度达到最高(3.2×106个/mL,图1A);采用DMEM-HG培养基,利用间歇换液法培养第6天细胞密度达到最高(3.46×106个/mL,图1B)。

图1 不同培养基对MDCK细胞生长和比生长速率的影响Fig.1 Effects of different media on cell density and specific growth rates in MDCK cells
2.2 细胞接种密度对MDCK细胞生长和代谢的影响
在载体量0.6 g、间歇换液法培养5 d的条件培养MDCK细胞,结果表明接种密度越大糖耗越高;同时糖耗高峰期也随细胞量的增大而提前,但细胞产量却不和接种密度成正比(表1)。

表1 接种密度对MDCK细胞生长的影响Table1 Effect of cell density on MDCK cell growth
2.3 p H对MDCK细胞生长的影响
图2表明,MDCK细胞在p H7.2时细胞密度最高(1.04×107个/mL),因此7.2为最适p H。

图2 p H对MDCK细胞生长的影响Fig.2 Effect of p H on MDCK cell growth
2.4 DO值、循环流量及振荡频率对MDCK细胞生长和代谢的影响
在相同条件(接种密度1.5×106个/mL、p H 7.2、37℃、培养6 d,分别固定DO值、循环流量和振荡频率进行反应器培养细胞优化试验。从图3看出,DO值50%~60%,循环流量400 mL/min和振荡频率60 r/min条件下可收获最大量细胞(17.8×106、16.4×106、18.6×106个/mL)。
2.5 激流生物反应器培养MDCK细胞
图4表明细胞在第5天达到最高耗糖量(3.1 g/L)和最高细胞密度(1.02×107个/mL);第2天达到最大比生长速率。整个培养过程中利用气体流通开放式进行培养,因此氨浓度为零。从图4B看出,乳酸的最大浓度为28.1 mmo L/L,而氨基酸从第4天以后为零,因此在生产中根据需要补充氨基酸。
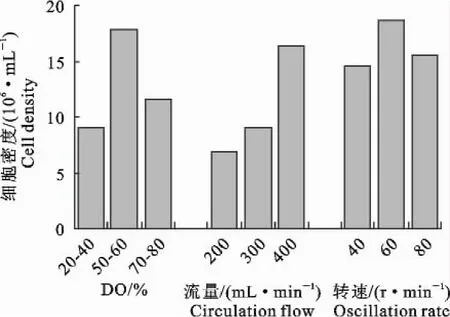
图3 DO、循环流量和振荡频率对细胞生长的影响Fig.3 Effects of DO,circulation flow and oscillation rate on cell growth
3 讨论
传统转瓶生产工艺是目前成熟的疫苗培养方法,但由于操作繁琐,传代环节多,易污染及产品质量难于控制是其大规模应用的主要障碍。激流式生物反应器采用纸片载体培养模式,纸片载体呈三维立体结构,可增加细胞黏附生长面积。该模式易于细胞生长及营养供给,培养过程可采用连续灌注培养,不断加入新鲜培养液的同时排出旧液,能有效供给营养除去代谢产物,使细胞始终处于良好的营养状态,适用于高密度细胞培养,同时延长细胞维持时间,有利于病毒的持续繁殖,提高疫苗产量[8-10]。
MDCK细胞在培养过程中需要消耗大量的糖,在糖耗完后就利用氨基酸作为碳源[11]。D/F12、MEM和DMEM-LG培养基中葡萄糖在第3天便耗完,而 DMEM-HG 在第5天 才 耗 完,因 此DMEM-HG最适于 MDCK细胞生长。代谢过程中,氨离子浓度很低,但乳酸的产量较高,因此培养到48 h进行全换液。每24 h取样检测耗糖量,根据检测情况及时补充葡萄糖和氨基酸。
本试验采用48 h后每12 h半数换液的方式,消除代谢产物给细胞带来的不利影响[11-12]。单纯从细胞培养密度出发,换液培养要比不换液高2倍,同时细胞生长对数周期短、倍增时间快,利于细胞保持良好状态,便于提前接种病毒。激流式生物反应器培养MDCK细胞,在细胞密度、扩增倍数、比生长速率等方面都明显优于转瓶培养,此外它能减少污染、节约空间和人力[13]。激流式生物反应器是靠激流供氧,因此是机械剪切力小、混合性能好的新型供氧培养系统[14]。另外,激流式反应器附有呼吸袋,因此细胞培养过程中产生的氨等不利气体通过呼吸袋排出培养系统。

图4 激流生物反应器培养MDCK细胞Fig.4 Cultivating MDCK cells in AP10 4L bioreactor
[1]Jesus M D,Wurm F M.Manufacturing recombinant proteins in kg-ton quantities using animal cells in bioreactors[J].Eur J Pharm Biopharm,2011,78(2):184-188.
[2]Garcia-Ochoa F,Gomez E.Bioreactor scale-up and oxygen transfer rate in microbial processes:An overview [J].Biotechnol Adv,2009,27(2):153-176.
[3]Huang T K,McDonald K A.Bioreaetor engineering for recombinant protein production in plant cell suspension cultures[J].Biochem Eng J,2009,45(3):168-184.
[4]Wang D,Liu W,Han B,et al.The bioreactor:a powerful tool for large-scale culture of animal cells[J].Curr Pharm Biotechnol,2005,6(5):397-403.
[5]Kehoe D E,Jing D,Lock L T,et al.Scalable stirred-suspension bioreactor culture of human pluripotent stem cells[J].Tissue Eng Part A,2010,16(2):405-421.
[6]唐江伟,吴振强.新型生物反应器结构研究进展 [J].中国生物工程杂志,2007,27(5):146-152.
[7]Li L,Shi M,Song Y,et a1.A Single-use,sealable perfusion bioreactor system[J].Bio Process Int,2009,7(6):46-54.
[8]Genzel Y,Dietzsch C,Rapp E,et al.MDCK and Vero cells for influenza virus vaccine production:a one-to-one comparison up to lab-scale bioreactor cultivation[J].Appl Microbiol Biotechnol,2010,88(2):461-475.
[9]Trabelsi K,Majoul S,Rourou S,et al.Development of a measles vaccine production process in MRC-5 cells grown on Cytodex1 microcarriers and in a stirred bioreactor[J].Appl Microbiol Biotechnol,2012,93(3):1031-1040.
[10]Liu C C,Guo M S,Lin F H,et al.Purification and characterization of enterovirus 71 viral particles produced from vero cells grown in a serum-free microcarrier bioreactor system[J].PLoS One,2011,6(5):e20005.
[11]Linz M,Zeng A P,Wagner R,et al.Stoichiometry,kinetics,and regulation of glucose and amino acid metubolism of a recombinant BHK cell line in batch and continous cultures[J].Biotechnol Prog,1997,13(4):453-463.
[12]Zielke H R,Zielke C L,Ozand P T.Glutamine:a major energy source for cultured mammalian cell [J].Fed Proc,1984,43(1):121-125.
[13]韩德胜,李振平.微载体规模化培养细胞的研究 [J].微生物学免疫学进展,2005,33(3):34-36.
[14]刘 轶,朱国强.动物细胞培养及微载体技术研究进展 [J].吉林农业大学学报,2007,29(2):203-206.

