PKH 26标记的骨髓间质干细胞在阿尔茨海默病大鼠中的迁移
李文玉,金日龙,胡兴越
PKH 26标记的骨髓间质干细胞在阿尔茨海默病大鼠中的迁移
李文玉1,金日龙2,胡兴越1
(1.浙江大学医学院邵逸夫医院神经内科,浙江杭州310016;2.浙江大学医学院附属第一医院骨科,浙江杭州310003)
目的:研究荧光染料PKH26标记的骨髓间质干细胞(bone-marrow derived mesenchymal stem cells,BM-MSC)在阿尔茨海默病(Alzheimer's disease,以下简称AD)大鼠中的迁移。方法:抽取正常人骨髓,体外分离培养BM-MSC;以PKH26标记第5代BM-MSC,采用流式细胞仪检测BM-MSC表面标记物,并在荧光显微镜下观察PKH26标记率;将PKH26标记的BM-MSC尾静脉注射到正常对照组和AD动物模型组,14天后在大鼠海马区,用荧光显微镜观察PKH26标记的BM-MSC细胞。利用Morris水迷宫实验比较AD模型组和BM-MSC移植组空间学习记忆能力。结果:流式细胞仪检测BM-MSC表面标记物CD73和CD105呈阳性,在体外BM-MSC的PKH26标记率达100%。Morris水迷宫实验比较BM-MSC移植组和AD动物组,BM-MSC移植组在第13、14天时空间学习记忆能力比AD动物组有显著改善。在移植BM-MSC的大鼠海马区可发现PKH26标记的BM-MSC阳性细胞,与DAPI吻合。PKH26阳性细胞在AD动物模型组明显多于正常对照组。结论:BM-MSC不仅能通过AD大鼠的血脑屏障,而且存活在AD大鼠的海马区,并有能够改善AD模型大鼠的学习障碍。
骨髓间质干细胞;骨髓细胞;阿尔茨海默病;PKH26
[JZhejiang Univ(Medical Sci),2012,41(6):659-664.]
阿尔茨海默病痴呆(Alzheimer's disease,AD)是一组病因未明的原发性、退行性脑变性疾病。AD发病多数起病隐匿,神经元逐渐消失死亡,难于预防和阻止其恶化。目前,对于AD患者的治疗尚无特殊方法。有研究表明,人类脐带血干细胞治疗AD动物模型中发现干细胞能改善认知功能[1],但是脐带血干细胞的临床应用存在一定的伦理上和安全性的问题,临床上很难自体移植,移植时需要用免疫抑制剂。而骨髓间质干细胞(bone-marrow derived mesenchymal stem cells,BM-MSCs)来源广泛,取材容易,体外迅速扩增,不存在伦理学问题,可运用自体移植,解除宿主可能的免疫排斥反应[1]。已研究证明,在脑血管病及神经系统退行性疾病中起到神经保护及抗炎作用[2-5]。尽管BM-MSC的移植取得了一些进展,但对BMMSC移植到AD的研究甚少,其BM-MSC能否通过血脑屏障到达AD颅内,并存活在颅内等尚有争议。本实验利用PKH26标志BM-MSC的方法,追踪BM-MSC能否到达AD大鼠颅内,探讨BM-MSC在AD大鼠颅内的分布形式及存活时间,为BM-MSC治疗AD的可能性奠定良好的研究基础。
1 材料与方法
1.1 BM-MSC培养 抽取正常人骨髓,用淋巴细胞分离液(ficoll-hypaue)密度梯度离心分离法分离单核细胞。分离的单核细胞用10%FBS(fetal bovine serum)和 含 有 1%的penicillin/streptomycin的 DMEM(Dulbecco's Modified Eagle`s medium)培养,4 h后弃去未贴壁细胞,经过3~4天的休眠后迅速增殖。细胞使用0.05%胰蛋白酶和0.53 mmol/L EDTA,在37℃放置5 min从培养皿壁中分离,之后重新放入培养皿中进行传代培养,然后再分离。培养5~6代后形态趋于一致,MSCs形态呈纤维样,呈纺锤状,可形成均匀的集落。用流式细胞仪鉴定MSCs表面标志物,细胞表面蛋白如CD105和CD73呈阳性,而CD34和CD45标记则呈阴性。
1.2 PKH26标记BM-MSC 取生长状态良好的第5代BM-MSC,以0.25% 胰蛋白酶消化制成单细胞悬液。离心、洗涤细胞,加0.5 ml稀释剂C重悬细胞,制备浓度为2×107个/ml的细胞悬液。按PKH26染色说明书操作。立即在离心管内配制4×10-6mol/L的PKH26染料应用液0.5 ml,将上述MSCs悬液快速加至染料中,立即用吸管混匀。25℃无菌条件下孵化5 min,期间轻柔翻转离心管以确保混匀;加1 ml FBS终止染色,混匀后25℃孵化1 min,再加2 ml含10%FBS的L-DMEM培养基稀释终止后的样品,同上法离心10 min;弃上清,转移细胞至另一离心管,用含10%FBS的L-DMEM培养基洗涤3次;重悬细胞密度为1×106个/ml,分别放入1 ml注射器,一部分放置盖玻片的培养板内培养数天。
1.3 建立AD动物模型及BM-MSC移植 30只健康SD雄性大鼠(3月龄,300 g左右)随机分为3组:正常对照组、AD模型组和BM-MSC移植组。每组各10只,标准环境下(浙江大学医学院动物试验中心)饲养1周,随机分为正常对照组和AD模型组,经1%戊巴比妥钠(40 mg/kg)将实验大鼠麻醉后,立体定向仪固定头部,备皮消毒,沿颅顶中线作2 cm切口,分离骨膜暴露头骨,与前囟向后3.0 mm,中线左右各旁开2.2 mm处,用牙科钻打开颅骨,利用微量注射器垂直进针2.8 mm,将1μl溶液缓慢注入,注射时间为5 min,留针5 min。AD模型组注射聚合的 Aβ1-40(sigma,美国)1 μl,Aβ1-40使用前用无菌生理盐水稀释成10μg/μl,37℃孵育1周,使其变为聚集状态。正常对照组注入(同上)生理盐水1μl。造模后第5天开始,连续3天用水迷宫实验筛选学习记忆能力下降的大鼠,BM-MSC移植组和正常对照组尾静脉注射PKH26标记的1×106BM-MSC 1 ml,AD模型组尾静脉注射生理盐水1 ml。
1.4 Morris水迷宫实验 AD动物模型利用水迷宫实验测试空间学习记忆能力[6],测试前1天进行进行水中适应训练。模型制备后第5天(连续3天)和BM-MSC移植后第10天(连续5天)所有组动物均进行Morris水迷宫定位航行试验,放入不锈钢圆形水池中,使其自由游泳,自动摄像系统记录大鼠寻找平台的时间(逃避潜伏期),设定60 s为最长逃避潜伏期,60 s后自动停止记录。每只动物每天进行2次,取平均值。所有数据运用SPSS 13.0软件进行处理,两组间比较用ANOVA检验,以P<0.05为差异有统计学意义。
1.5 免疫组化观察 进行BM-MSC移植的大鼠,14天后均予以处死。首先经大鼠心脏,用生理盐水灌注冲洗循环血液,然后用4%的多聚甲醛(paraformaldehyde)溶液进行灌注和固定。快速取出大脑,放入4%的多聚甲醛(paraformaldehyde)固定液,在4℃环境中放置12 h,然后放入30%蔗糖溶液中。使用冰冻切片方法制作冠状切片(厚度为30μm),进行免疫组化染色。使用PBS洗涤3次切片,细胞核染色用DAPI(用PBS 1∶100稀释)放置5 min,再用PBS洗涤3次,封片后用激光共聚焦扫描显微镜下观察DAPI阳性细胞和PHK26标记的BM-MSC。
2 结果
2.1 BM-MSC培养及鉴定结果 在体外培养BM-MSC呈梭状、漩涡样生长,排列紧密。传代5~6代的BM-MSC利用流式检测均表达高水平的干细胞标记物。其CD73(平均98%,波动在97.4% ~98.8%之间)和 CD105(平均90.3%,波动在83.1% ~96.4%)表达阳性,CD34和 CD45阴性,符合其干细胞的特征性抗原表达(图1)。
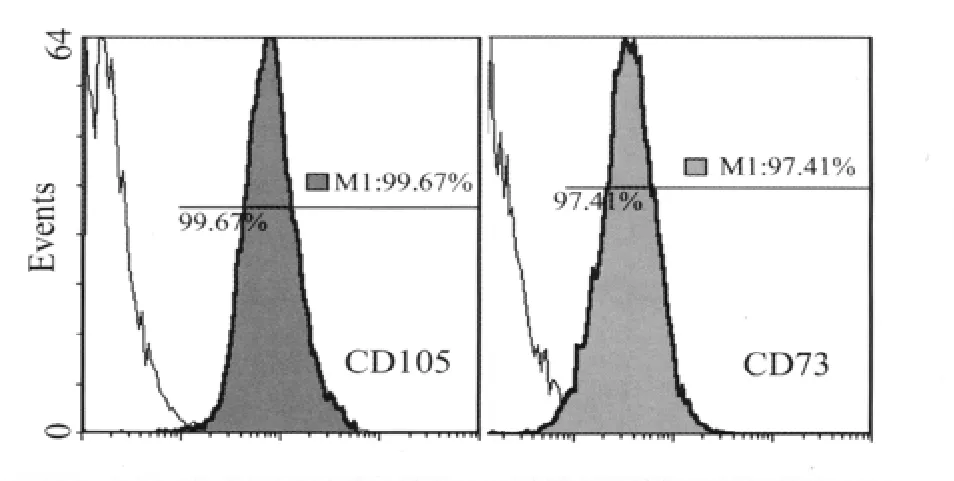
图1 流式细胞仪检测BM-MSC的标记物Fig.1 Flow cytometric analysis of BM-MSC markers
2.2 Morris水迷宫实验 造模后第5天,AD模型组逃避潜伏期比对照组延长,造模后第7天的实验中,AD模型组逃避潜伏期比对照组明显延长(P<0.05,图2a),说明AD模型组空间学习记忆能力下降。BM-MSC移植组和AD模型组在第10天开始行水迷宫试验中,随着训练次数的增加,各组大鼠的逃避潜伏期均逐渐缩短,但模型组大鼠逃避潜伏期在第2、3、4、5日明显长于正常对照组,BM-MSC移植组逃避潜伏期在第4、5日比AD模型组明显缩短(图2b)。这表明AD模型大鼠学习获取能力受损,而BM-MSC移植能够改善AD模型大鼠的学习记忆能力。
2.3 体外标记BM-MSC细胞结果 荧光镜下,PKH26标记1天的MSCs,可见细胞膜周围均匀分布的明亮红色荧光。标记率达100%(图3)。随着时间延长,荧光逐渐进行性减弱,标记率不断下降,2周时,少数MSCs观察不到荧光。
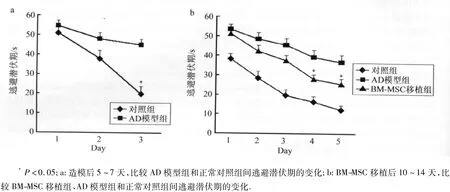
图2 Morris水迷宫实验观察AD大鼠逃避潜伏期的变化Fig.2 The escape latency of AD rats in the Morris water maze task
2.4 PKH26标记的BM-MSC在AD大鼠中的迁移 在AD大脑海马区切面上可见PKH26标记的BM-MSC的迁移,与细胞核染色的DAPI细胞双标吻合(图4a~c)。在AD大鼠脑组织(如大脑皮质、海马、基底节区、室管膜区等)均能观察到许多被PKH26标记的BM-MSC移植细胞。在正常对照组,在海马区也能观察到PKH26标记的BM-MSC阳性细胞(图4d~f)其阳性细胞极少,与AD模型组比较有显著的差异。这表明通过尾静脉注射的MSC能在AD大鼠脑组织存活、迁移和分化。与正常对照组比较,BM-MSC不仅能通过AD大鼠的血脑屏障且主要分布在受损的海马区。
3 讨论
本研究中培养的BM-MSC经过5~6代传代,其细胞形态及性质物无明显改变,用流式细胞仪表面标志鉴定显示,干细胞的表面标志CD73和 CD105呈90%以上阳性。CD34和CD45呈阴性。本实验利用Morris水迷宫实验结果显示,AD模型组的逃避潜伏期比正常对照组明显延长,说明AD模型组大鼠学习空间能力显著下降,从而证明造模成功。AD动物移植BM-MSC 13、14天后,BM-MSC移植组逃避潜伏期比AD模型组显著缩短,这可能与BM-MSC神经保护作用有关。
移植细胞的活体示踪在干细胞的研究中起到重要的作用,PKH26是一种红色荧光染料,可通过脂肪链与细胞膜不可逆结合,可用于长期标记,不改变细胞膜重要功能表面蛋白区,在适当的标记浓度下基本不影响细胞生长,标记强度稳定,具有良好的可重复性[7-10]。应用PKH26标记BMSCs研究表明,PKH26在一定浓度范围内不影响BMSCs的生长特性及分化能力[11-12]。本研究中,体外实验结果表明,PKH26标记 BM-MSC在第1天标记率很高(100%),随着时间的延长,荧光逐渐进行性减弱,标记率不断下降,3周时,绝大多数MSCs观察不到荧光。这可能与PKH26本身的荧光持续时间有关。
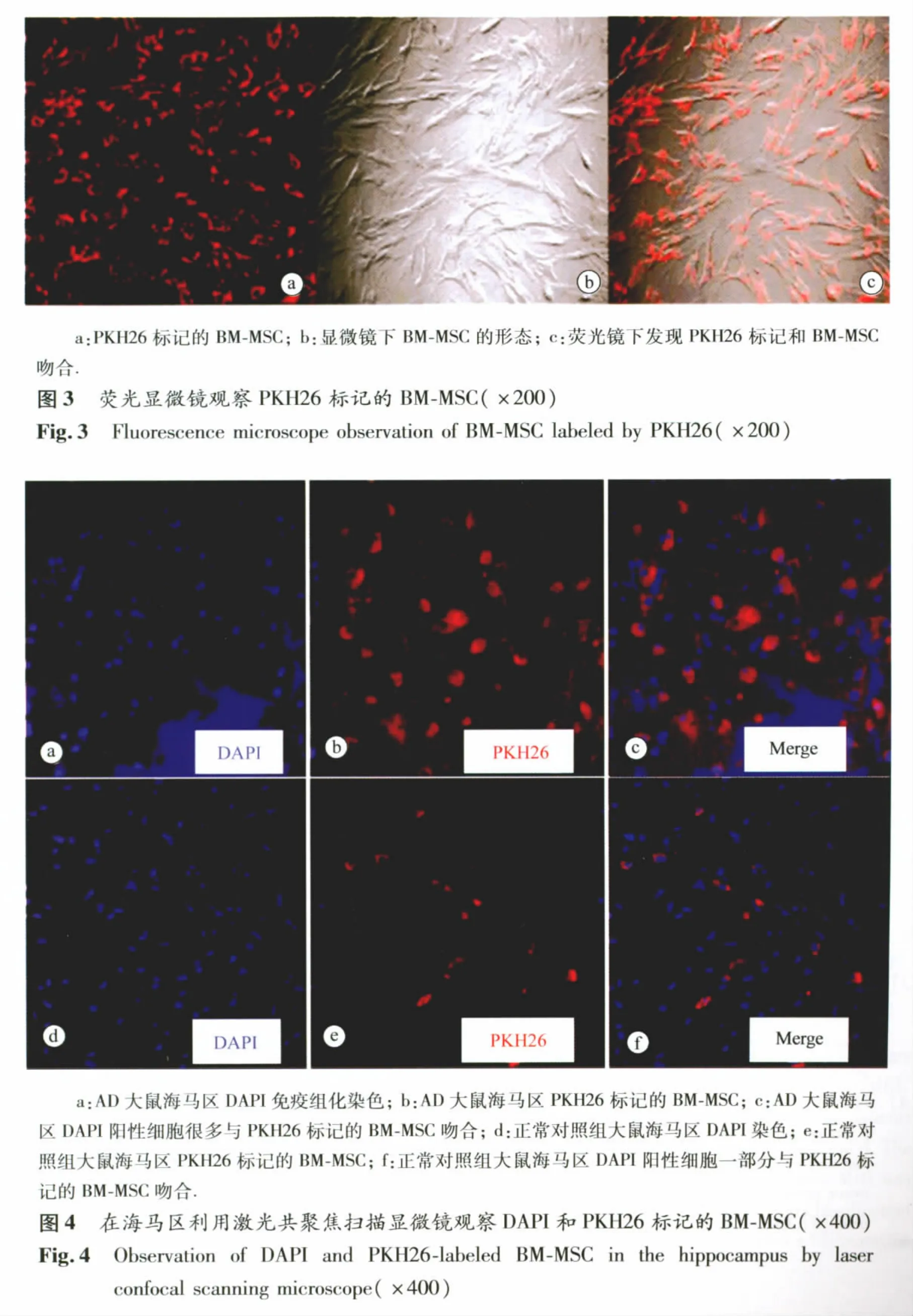
BMSCs在AD中的应用甚少,MSC是否能通过血脑屏障到达AD大鼠颅内还存在一些争议。本研究用PKH26标记BM-MSC的示踪方法,观察到在AD大鼠的海马区有大量PKH26阳性细胞,且与DAPI阳性细胞吻合,说明尾静脉注射的BM-MSC不仅能通过血脑屏障,还能存活在颅内。在正常对照组大鼠颅内虽能观察到PKH26阳性细胞,但其数量甚少,这说明AD疾病会影响海马神经元消失,损伤的神经元可能会起到趋化MSC的作用。这已在脑梗死及多系统萎缩等神经系统疾病中证明过[2-3]。移植后21天,在AD大鼠海马区仍然能观察到PKH26标记的 BM-MSC,表明 BM-MSC能在AD大鼠颅内存活到21天以上,更长时间的观察发现PKH26标记的荧光很难判断其细胞形态。这与体外观察PKH26标记的BM-MSC的荧光显示时间吻合,说明PKH26标记观察BM-MSC在颅内存活时间及分化为其他神经元细胞有一定的限制。
综上所述,应用PKH26标记BM-MSC简便易行,示踪观察发现PKH26标记细胞在AD动物颅内存活并主要分别在海马区,与正常对照组有明显差别。并且够改善AD模型大鼠的学习障碍。但其机制尚不清楚。移植的BM-MSC在AD大鼠颅内分化为神经元?还是有抗炎、神经保护作用等有待进一步研究。
[1] LEE H J,LEE J K,LEE H,et al.Human umbilical cord blood-derived mesenchymal stem cells improve neuropathology and cognitive impairment inan Alzheimer's disease mouse model through modulation of neuroin flammation [J].Neurobiol Aging,2012,33(3):588-602.
[2] LI W Y,CHOI Y J,LEE P H,et al.Mesenchymal stem cells for ischemic stroke:changes in effects after ex vivo culturing[J].Cell Transp,2008,17(9):1045-1059.
[3] KIM Y J,PARK H J,LEE G,et al.Neuroprotective effects of human mesenchymal stem cells on dopaminergic neurons through anti-inflammatory action [J].Glia,2008,57(1):13-23.
[4] LOPEZ-GONZALEZ R,KUNCKLES P,VELASCO I.Transient Recovery in a rat model of familial amyotrophic lateral sclerosis after transplantation of motor neurons derived from mouseembryonic stem cells[J].Cell Transp,2009,18(10):1171-1781.
[5] LEE P H,KIM J W,BANG O Y,et al.Autologous Mesenchymal Stem Cell Therapy Delays the progression of neurological deficits in patients with multiple system atrophy [J]. Clinical Phamacology & Therapeutics,2008,83(5):723-730.
[6] MORRIS R G,GARRUD P,RAWLINS N,et al.Place navigation impaired in rats with hippocampus lesions[J].Nature,1982,297(5868):681-683.
[7] XU Jian,XU Ge-lin,LIU Xin-feng(许 剑,徐格林,刘新峰).Labeling Techniques of Mesenchymal Stem Cells[J].Chinese Journal of Clinical Neurosciences(中国临床神经科学),2006,14(2):197-201.(in Chinese)
[8] JABBSA,MONCADA G A,NICHOLS C E,et al.Peri pheral blood mononuclear cells acquire myofibroblast characteristics in granulation tissue[J].J Vasc Res,2005,42(2):174-180.
[9] PARISH C R.Fluorescent dyes for lymphocyte migration and proliferation studies[J].Immunol Cell Biol,1999,77(6):499-508.
[10] BOUTONNAT J,BARBIER M,ROUSSELLE C,et al.Usefulness of PKHs for studying cell proliferation[J].C R Acad SciⅢ,1998,321(11):901-907.
[11] YANG Huan,XU Wen-rong,ZHU Wei,et al(杨欢,许文荣,朱 伟,等).Rat Bone Marrow Mesenchymal Stem Cells Labelled with PKH26 in vitro [J].Chinese Journal of Biomedical Engineering(中国生物医学工程学报),2006,25(6):745-749.(in chiness)
[12] JIN Shi-zhu,HAN Ming-zi,QU Bo,et al(金世柱,韩明子,曲 波,等).Study on the utilization of PKH26 in the transplantation of bone marrow mononuclear cells to liver in mice[J].Chinese Journal of Gastroenterology and Hepatology(胃肠病学和肝病学杂志),2008,17(1):33-35.
Migration of PKH26-labeled mesenchymal stem cells in rats with Alzheimer's disease
LI Wen-yu1,JIN Ri-long,HU Xing-yue1
(1.Department of Neurology,Sir Run Run Show Hospital,Zhejiang University,Hangzhou 310016,China;2.Department of Orthopedic Surgery,The First Affiliated Hospital,Zhejiang University School of Medicine,Hangzhou 310016,China)
Objective:To investigate the migration of fluorescent dye PKH26-labeled BM-MSC in the Alzheimer's model rats.Methods:Normal human bone marrow extracted for isolation of BM-MSC was cultured in vitro.The 5th passaged BM-MSC was labeled with PKH26,and observed under a fluorescence microscope for PKH26 labeling efficiency,and using flow cytometry BM-MSC surface markers was checked.The PKH26 labeled BM-MSC injected into the tail vein of the normal control group and ADanimal model group,14 days after finding the PKH26-labeled BM-MSC cells in the rat hippocampus using fluorescence microscopy.Using the Morris water maze experiment comparison of AD model and BM-MSC transplantation group of spatial learning and memory ability.Results:Flow cytometry showed BM-MSC surface markers CD73 and CD105 were positive.In vitro,PKH26-labeled rate of BM-MSC was100%.The Morris water maze experiment comparison of BM-MSC transplantation group and AD group of animals,BM-MSC transplantation group at 13,14 days of spatial learning and memory ability than AD animal group had significantly improved.14 days after BM-MSCs in rat hippocampus could be found which were PKH26-positive,consistent with DAPI staining.PKH26-positive cells in animal models of AD were significantly more than those in the normal control group.Conclusion:BM-MSC in AD rats not only migrates through the blood-brain barrier,but also mainly survives in the hippocampus of AD rats,and it can improve AD rat model of learning disabilities.
Mesenchymal stem cells;Bone marrow calls;Alzheimer's Disease;PKH26
R 749.16
A
1008-9292(2012)06-0659-06
http:∥www.journals.zju.edu.cn/med
10.3785/j.issn.1008-9292.2012.06.009
2011-12-09
2012-02-03
浙江省自然科学基金项目(Y2090184);浙江省中医药局青年基金(2006Y005).
李文玉(1978-),女,博士,主治医师,从事神经内科工作.
胡兴越(1962-),男,博士,主任医师,硕导,从事神经内科工作;E-mail:huxingyue2003@126.com
[责任编辑 张荣连]

