微波消解-ICP-AES法测定茶叶中钾、钠、磷、硫、铁、锰、铜、锌、钙、镁方法研究
谭和平,张玉兰,高 杨,吕 昊,孙羽婕,王顾希
(中国测试技术研究院,四川 成都 610021)
0 引 言
茶叶中钾(K)、钠(Na)、磷(P)、铁(Fe)、锰(Mn)、铜(Cu)、锌(Zn)、钙(Ca)、镁(Mg)的检测方法目前主要为原子吸收光谱法(AAS)和比色法,参考依据为GB/T 5009-2003系列国家标准;植株全硫(S)的测定采用离子色谱法[1]、比色法[2]等。AAS法仅单元素分析,其检出限较高,《GB/T 5009.××》系列国家标准中,Fe、Mn、Cu、Zn、Ca 的检出限分别为 0.2,0.1,1,0.4,0.1 μg·g-1,且不能测定 P、S 等紫外区域元素;比色法测定 P、S 的检出限较高,分别为 0.2[3],0.3μg·g-1[2],且比色法存在前处理程序繁琐、稳定性差等不足之处。
电感耦合等离子体原子发射光谱法(ICP-AES)可同时进行多元素定量分析,具有检出限低、稳定性好等优点。前人对运用ICP-AES法测定茶叶中Fe、Mn、Cu、Zn、Ca、Mg 等金属元素开展了大量研究[4-6],但由于K、Na属易离解的碱金属元素,P、S为熔点低、易挥发的非金属元素,其最佳光谱吸收位于紫外区域[7],采用统一的预处理方法并同时测定茶叶中K、Na、P、S等10种化学性质差异较大的营养元素含量,是当前茶叶营养元素检测领域的难点和重点。本文优化微波消解条件,并根据不同元素性质,调谐ICP-AES工作条件至最佳,以期将该方法更好运用于茶叶中10种营养元素的测定。
1 试验与方法
1.1 仪器与试剂
仪器:美国热电电感耦合等离子体原子发射光谱仪(ICP-AES,IRIS Intrepid II);微波消解仪(Mars X,CEM,USA);超纯水发生器(Milli-Q Synthesis MILLIPORE,USA),试剂纯化系统(Analab,France)。
试剂:浓硝酸(GR级,经纯化),双氧水(GR级,经纯化)。实验用水均为超纯水(电阻率>18MΩ·cm)。Fe、Mn、Cu、Zn、Ca、Mg、K、Na、P、S 元素持证标准物质,浓度均为 1 000 μg·mL-1,购自国家标准物质研究中心,使用时按一定比例稀释成所需浓度的标准溶液。
1.2 标准溶液配制及标准曲线
(1)标准系列 1:准确吸取 5.00 mL Fe、Mn、Cu、Zn、Ca、Mg 单标溶液(1000 μg·mL-1),置于 50mL 容量瓶中,用2%硝酸溶液稀释至刻度,摇匀,配制成混合标准使用液,4℃保存,备用。此溶液每毫升相当于0.1mg Fe、Mn、Cu、Zn、Ca、Mg。再将上述混合标准使用液逐级稀释成不同浓度系列的标准溶液,待测。
(2)标准系列 2:配制 K、Na、P、S 混合标准溶液,应使用超纯水定容至50mL聚氯乙烯(PVC)容量瓶中,其余操作步骤同1.2(1)。10种元素标准溶液浓度如表1所示。
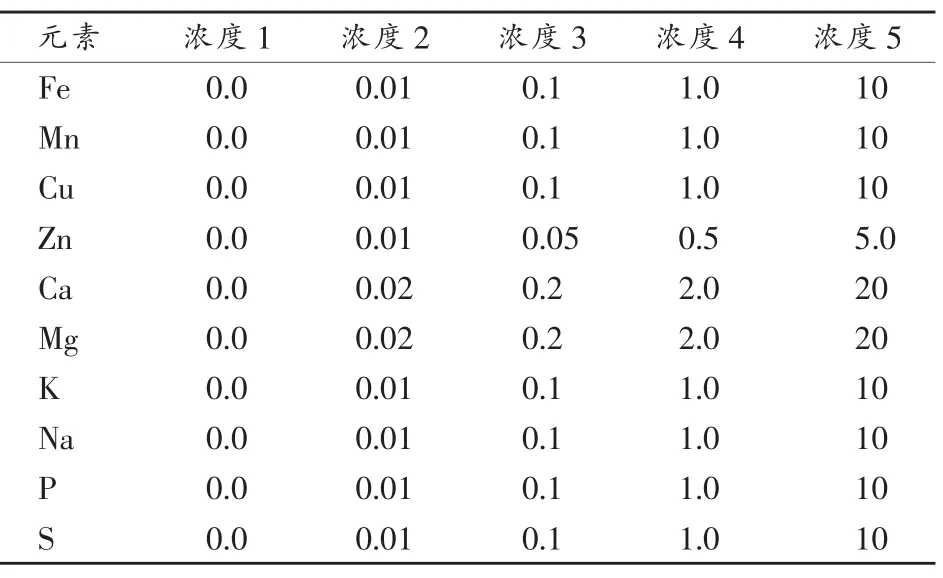
表1 10种元素标准溶液浓度 单位:μg·mL-1
1.3 样品处理
称取茶叶样品0.25 g(精确至0.000 1 g)于聚四氟乙烯消解罐中,加入一定量的硝酸,放置过夜,再加入1mL过氧化氢,盖好内盖,放入微波消解仪中。通过实验确定微波消解酸配比条件、消解温度等最佳参数。消解完成待自然冷却,将试样消化液转移到25 mL容量瓶中,用超纯水少量多次洗涤消解罐,定容至刻度,待测,同时作试剂空白。Na易受实验器皿污染,为保证检测结果准确度和精密度,样品预处理中应尽量避免使用玻璃或陶瓷器皿。
2 结果与讨论
2.1 仪器谱线选择
Fe、Mn、Cu、Zn等受谱线干扰较少的元素,可直接选择ICP-AES仪器使用说明书推荐的谱线;Ca常用谱线为Ca 317.933和Ca 393.366,Mg常用谱线为Mg 280.271和Mg 279.553,由于茶叶中Ca、Mg含量较高,分别为 3600,2000μg·g-1,应选择次灵敏谱线 Ca 317.933、Mg 280.271;Na可选择 Na 589.592、Na 588.995,由于Na 588.995受C 588.978严重干扰,故选择Na 589.592;K较灵敏的谱线为K 766.491、K 404.414,但Cu 404.375对K 404.414有严重干扰,应选择K 766.491;P和S分析线的选择依据在文献[7]已详细阐述,此处不再赘述。10种元素分析谱线如表2。
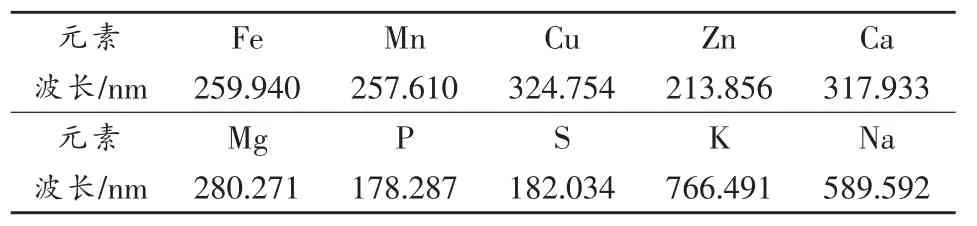
表2 10种元素分析谱线
2.2 仪器工作条件选择
Fe、Mn、Cu、Zn、Ca、Mg 等元素的测定参照仪器推荐工作条件进行,如表3;P、S等紫外光区元素,为减少光室中氧气对紫外光谱吸收,用氩气吹扫光路6~8h,等离子体稳定2 h以上方可进行测试[7],其余参数设置同表3;K测定工作条件如表4;Na属易离解元素,其射频功率定为950W,其余参数设置同表4。

表3 ICP-AES工作参数

表4 ICP-AES测定K的工作参数
2.3 微波消解条件的优化
2.3.1 酸体系选择
硝酸不仅是分解基体的反应物,也是良好的微波吸收体,过氧化氢可充分去除样品中的有机物。同时参照EPA6010C方法[8],选择硝酸-过氧化氢体系。
2.3.2 酸配比条件优化
分别采用5 mL HNO3+2 mL H2O2、6 mL HNO3+2mL H2O2、7mL HNO3+2mL H2O2、8mL HNO3+2mL H2O24种酸体系,考察不同酸配比条件的消解效果。
2.3.3 微波消解温度优化
根据CEM公司推荐的消解程序,并对消解程序进行优化,分别设置 130,150,160,170℃ 4个消解温度,考察不同消解程序的消解效果。不同微波消解条件和酸配比条件的茶叶标准物质(GBW 10016)检测结果见表5。

表5 不同微波消解条件和酸配比条件茶叶标准物质(GBW 10016)检测结果 1)
由表5可知,微波不同酸配比条件和消解条件下各元素的检测结果基本在标称值范围内,表明本实验设定的不同样品预处理条件均能满足分析要求。但处理14即6 mL HNO3+2 mL H2O2在170℃消解温度下,各元素检测结果与标称值吻合度均优于其他处理,且消解液较处理1~处理12澄清,故选择6mL HNO3+2mL H2O2作为最佳酸配比条件,消解温度设定为170℃。优化后的微波消解程序如表6。
2.4 方法学考察
以下以天岗玉叶为茶叶样品,从方法检出限、重复性、再现性、回收率等方面进行方法学考察。
2.4.1 方法检出限
重复测定空白溶液11次,取3倍标准偏差值为相应方法的检出限。该方法10种元素检出限如表7,满足实验要求。

表6 优化后的微波消解程序
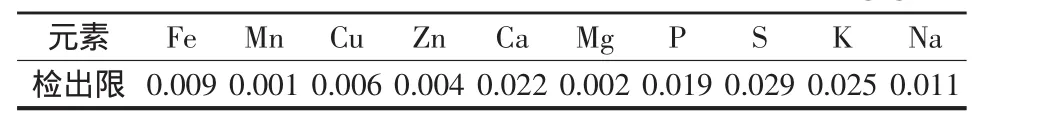
表7 10种元素方法检出限 单位:μg·g-1
2.4.2 方法重复性
每批次用同一个含量未知的茶叶样品(天岗玉叶)进行平行6次测定,以6次测定值的RSD%检验测定结果之间的一致性,即方法重复性(表8)。由表 8 看出,每批次 6 次平行的 K、P、S、Fe、Mn、Cu、Zn、Ca、Mg 9种元素测定值的 RSD%为 0.31~4.13。Na易受实验器皿污染,其检测结果RSD%略高于其他9种元素,为3.66~8.83。各元素检测结果RSD%表明每批次样品测定结果精密度较好,该方法具可重复性,能够满足实验要求。
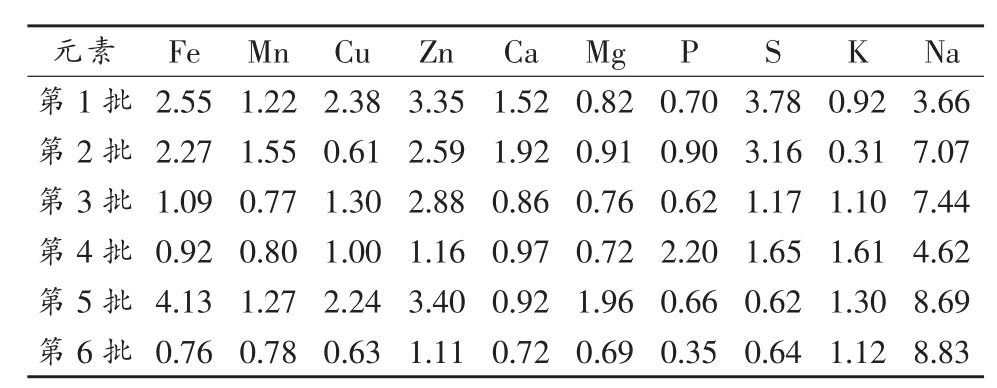
表8 微波消解天岗玉叶茶叶样品6批次检测结果重复性(n=6,RSD%)
2.4.3 方法再现性
为进一步考察方法再现性,在相同分析条件下,不同时间间隔内,连续处理6批次样品,分别计算每批次测定结果平均值,求算RSD%,如表9。结果表明,10种元素测定值RSD%为0.67(Cu)~5.57(Na),该方法稳定可靠,能够满足茶叶中K、Na、P、S、Fe、Mn、Cu、Zn、Ca、Mg的分析要求,方法具可再现性。
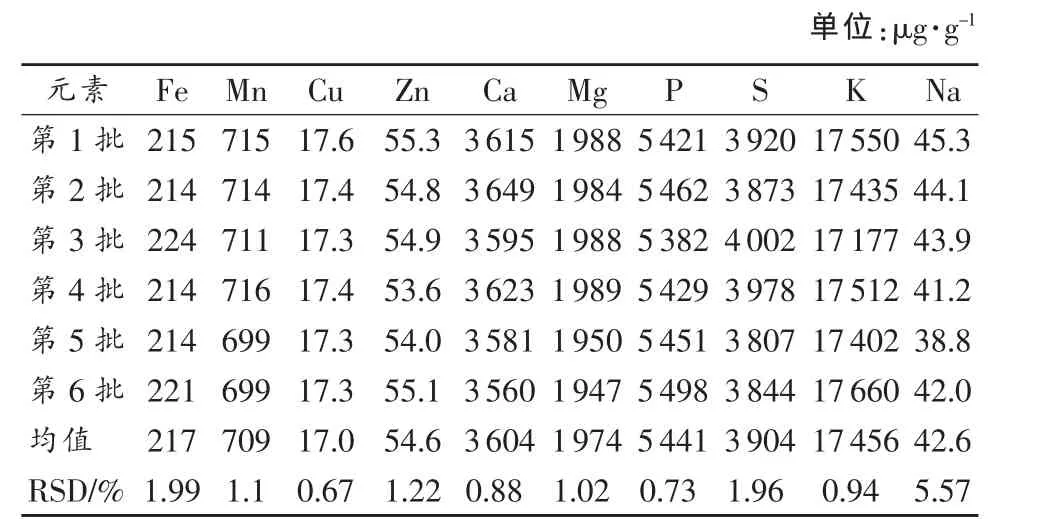
表9 微波消解天岗玉叶茶叶样品6批次检测结果再现性(n=6)
2.4.4 回收率
称取12份平行茶叶样品,其中6份分别加入约0.5倍待测元素实际含量的标准溶液,进行回收率实验,结果如表 10。除个别处理外,K、P、S、Fe、Mn、Cu、Zn、Ca、Mg 9种元素的回收率均大于90%,Na的回收率为84.0%~89.4%,表明经优化后的微波消解条件及ICP-AES仪器测定条件适用于茶叶中K、Na、P、S等10种元素的测定。
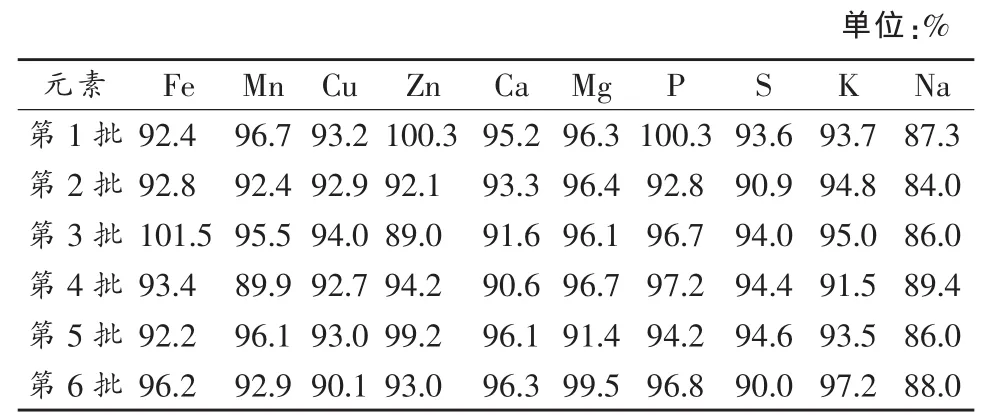
表10 茶叶样品10种元素含量加标回收实验结果
3 结束语
K、Na、P、S 与 Fe、Mn、Cu、Zn、Ca、Mg 6 种元素化学性质差异较大,本研究通过优化微波消解温度和酸配比条件,并调谐ICP-AES工作条件,实现了微波消解-ICP-AES 法同时测定茶叶中 K、Na、P、S、Fe、Mn、Cu、Zn、Ca、Mg 10 种营养元素含量。
方法学考察结果表明,该方法稳定可靠,检出限为 0.001(Mn)~0.029(S)μg·g-1,远低于 AAS 法、比色法等方法,能够满足茶叶中 K、Na、P、S、Fe、Mn、Cu、Zn、Ca、Mg分析要求,本方法同样适用于其他植物样品中上述10种营养元素含量分析。
[1]孙翠香,黄赛花,毕鸿亮.碱熔-离子色谱法同时测定植株中氯和硫的含量[J].光谱实验室,2007,24(4):583-586.
[2]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2004.
[3]GB/T 5009.87—2003 食品中磷的测定[S].北京:中国标准出版社,2003.
[4]魏新军,南海娟,颜振敏,等.微波消解ICP-AES测定普洱茶中的 17 种元素[J].光谱实验室,2011,28(6):3059-3061.
[5]Anderson K A.Micro-digestion and ICP-AES analysis for the determination of macro and micro elements in plant tissues[J].Atomic spectroscopy,1996,17(1):30-33.
[6]Matsuura H,Hokura A,Katsuki F,et al.Multi-element determination and speciation of major-to-trace elements in black tea leaves by ICP-AES and ICP-MS with the aid of size exclusion chromatography[J].Analytical Sciences,2001(17):391-398.
[7]谭和平,张玉兰,高杨,等.ICP-AES法在磷和硫分析中的应用[J].中国测试,2011,37(5):50-52.
[8]EPA Method 6010C Inductively coupled plasma-atomic emission spectrometry[S].

