基于Gluconobacter oxydans膜结合脱氢酶的静息细胞催化合成2-酮基-D- 葡萄糖酸
陈鸿胜,李克非,舒行宙,刘 浏,林金萍,魏东芝
(华东理工大学,生物反应器国家重点实验室,鲁华生物技术研究所,上海 200237)
基于Gluconobacter oxydans膜结合脱氢酶的静息细胞催化合成2-酮基-D- 葡萄糖酸
陈鸿胜,李克非,舒行宙,刘 浏,林金萍*,魏东芝
(华东理工大学,生物反应器国家重点实验室,鲁华生物技术研究所,上海 200237)
基于G.oxydans DSM2003膜结合葡萄糖酸-2-脱氢酶(GA-2-DH)的催化特性,利用静息细胞催化技术合成D-异抗坏血酸(EA)的主要前体2-酮基-D-葡萄糖酸(2-KGA)。利用高浓度底物自适应筛选技术,筛选到高产2-KGA菌株并对其摇瓶催化进行优化,优化后最适条件为:温度30℃,pH6.0,细胞浓度20g/L,底物浓度1100mmol/L,摇床转速250r/min,此时时空产率为24.68mmol/L/h;摇瓶优化工艺基础上在7L发酵罐中对重点影响参数(转速与底物浓度)进行了进一步优化,优化后2-KGA的时空产率提高到74mmol/L/h,并且催化细胞可有效重复利用3次。
2-KGA,氧化葡萄糖酸杆菌,静息细胞催化,工艺优化
氧化葡萄糖酸杆菌具有丰富的膜结合与胞内氧化系统、不完整的TCA循环以及缺失的糖酵解途径,使其能够将多种糖、醇以及醛类物质不完全氧化合成相应的产物[1]。而其基于结合酶的反应更是具有反应快分离容易等特点而被广泛应用于食品以及化工品合成等行业,如(R)-β-羟基异丁酸[2]合成等。2-酮基-D-葡萄糖酸(2-KGA)是目前大规模生产的一种有机酸,被广泛应用于合成D-异抗坏血酸(钠) (EA/EN);EA作为肉类、水果、饮料等食品中可代谢抗氧化剂可以有效地减少食品的氧化,防止其色、香、味褪变,抑制食品中致癌物质亚硝酸盐的生成,其防腐效果大大超过维生素C,而价格不到维生素C的二分之一,有很好的应用前景[3-4]。另外,2-KGA还可以用来合成有机糖(酸)及其衍生物,如树胶醛醣、核酮糖、羟基丙二酸[5]、醛基糖酸[6]以及氨基糖[7]等;可以作为显影剂、动物饲料添加剂、除草添加剂[8]以及建筑水泥行业增塑剂[9]。目前,2-KGA的合成方法主要有 3种:化学合成法[10]、酶法[11]和发酵法[12],其中以荧光假单胞杆菌发酵法为实际生产中最主要的合成工艺[3],过程中时空产率高达6.22g/L/h(32mmol/L/h),平均发酵转化率为89%[13]。本文根据G.oxydans具有的膜结合葡萄糖酸-2-脱氢酶(GA-2-DH)可氧化葡萄糖酸(GA)生成2-KGA的特性,建立了静息细胞催化法合成2-KGA的工艺。主要考察了影响催化效率的关键因素,并进行了重复利用静息细胞多批次转化合成2-KGA的研究,为2-KGA的生物合成开拓了一条新的潜在生产途径。
1 材料与方法
1.1 材料与仪器
2-KGA、5-KGA Sigma-A ldrich;葡萄糖酸钠(GA) 上海卡博工贸有限公司;G.oxydans#3 (DSM2003)及其筛选菌株G.oxydans#3A 均由华东理工大学生物反应器国家重点实验室保藏。
恒温培养摇床 上海Shenergy Biocolor公司;恒温转化摇床 上海华利达实验仪器有限公司;7L发酵罐 上海保兴生物设备工程有限公司;高效液相色谱检测系统 美国安捷伦公司。
1.2 菌株培养与筛选
1.2.1 培养基成分 液体山梨醇培养基:8%山梨醇,2%酵母粉,0.1%KH2PO4,0.05%MgSO4·7H2O,0.01%L-Glutamine;液体 GA培养基:10%~30% GA,1%葡萄糖,2%酵母粉,0.1%KH2PO4,0.05% MgSO4·7H2O,0.01%L-Glutam ine;在液体培养基加入1.5%琼脂即得固体培养基。
1.2.2 细胞培养及自适应筛选 将菌从甘油管或者平板培养基上移接至液体培养基进行一级种子培养24h,接着以10%接种量接至下级培养基中,于30℃(发酵罐pH控制在5.8~6.0)条件下培养22h。高浓度GA液体(固体)培养基培养菌体,使其通过自适应的方式得到筛选。
1.3 摇瓶小型转化及发酵罐放大
菌体培养液离心得到静息细胞,称取一定量该菌体细胞加入至装有20m L GA底物溶液的150m L三角瓶中,pH调至实验值,置于30℃的恒温摇床中反应。放大实验在7L发酵罐中进行,反应基本条件为30℃,pH5.0。
1.4 检测方法
利用 ICE-COREGEL 87H3高效液相色谱柱(Transgenom ic,Inc.)进行检测,检测条件为:流动相为0.008N的硫酸溶液、流速0.6m L/m in、柱温35℃、进样量10μL,GA、2-KGA、5-KGA能够得到有效地分离,保留时间分别为8.6、7.8、8.2m in。
1.5 最终转化率的计算

2 结果与分析
醋酸杆菌科(特别是氧化葡萄糖酸杆菌属)微生物能通过膜结合脱氢酶GA-2-DH与GA-5-DH将GA分别氧化成2-KGA和5-KGA,但不同的菌株以及培养基条件,产生2-KGA与5-KGA的量有所不同[14]。本实验以实验室保藏的一株G.oxydans#3为出发菌株,以GA为底物,分别通过发酵法和静息细胞催化法合成2-KGA,结果发现发酵体系中同时产生了2-KGA和5-KGA,但以2-KGA为主;而在静息细胞催化GA的过程中,却只检测到2-KGA的产生,没有5-KGA产生,实现了产物的100%选择性合成,因此本研究确定了静息细胞催化法合成2-KGA的工艺。
2.1 高产2-KGA菌株的筛选
为了筛选耐高浓度GA并高产2-KGA的菌株,实验中首先将出发菌株G.oxydans#3在含有不同浓度梯度GA的培养基中培养,利用其对生长环境的自适应进化,提高菌株的底物耐受性,并诱导其目的酶的过表达,从而获得了一株2-KGA产率明显提高的进化菌株G.oxydans#3A。图1和图2分别显示了原始菌与进化菌的生长情况和催化合成2-KGA的比较。从图1可以看出,G.oxydans#3A的生长趋势与G.oxydans#3基本相似,在20h时取样检测发现前者的菌体得率(单位体积培养液菌体量)为10.7g/L略高于后者的10g/L。而从图2中可以发现,G.oxydans #3A在48h就能将440mmol/LGA完全消耗,而原始菌则需要60~72h,这表明在高浓度GA的自适应过程中,负责合成2-KGA的关键酶GA-2-DH的表达水平或者活性可能得到提高,从而在催化GA合成2-KGA的过程中表现出更高的转化效率。

图1 原始菌与进化菌的生长曲线比较Fig.1 Growth curves of initial strain and improved atrain

图2 原始菌与进化菌催化合成2-KGA活力比较Fig.2 Comparison of 2-KGA productivity of G.oxydans#3 and G.oxydans#3A
2.2 细胞菌体培养时间与细胞活性的关系
细胞中酶的表达通常受到菌体生长周期的影响,因此细胞的收集时间可能对其催化活性很关键。实验中在菌体生长的不同时间点取出20~50m L培养液,离心后获取静息细胞,测定其合成2-KGA的初速度(即前5h的平均速度)结果如图3所示。在菌体培养初期3h与6h(延迟期到对数期初期),细胞催化GA合成2-KGA的能力相对较弱,其催化初速度在9.0~10mmol/L/h;随着菌体的快速增殖,静息细胞的催化活性显著提高,生长到12h时细胞的催化活性达到最高值15.5mmol/L/h,之后获取得到的静息细胞的催化活性基本维持不变,而进入衰亡期的细胞的催化活性会有微弱的下降。关联图1可以发现,对数生长期的细胞表现最高的GA催化活性,因此为了能在具有最高细胞催化活性的同时获得尽可能多静息细胞,实验选择培养21~22h(细胞对数生长期末)获得的静息细胞作为催化剂来催化合成2-KGA。
2.3 摇瓶中催化合成2-KGA的条件优化
2.3.1 温度对静息细胞催化活性的影响 静息细胞催化过程中,体系的温度会通过酶活以及底物与溶氧的传质来影响合成2-KGA的效果。氧化葡萄糖酸杆菌中GA-2-DH最适温度与其他大多数的膜结合酶相似,在30℃左右[15],当然也有某些特殊的氧化葡萄糖酸杆菌菌株温度可达37℃,甚至更高[16]。所以实验中对不同温度进行了考察,结果如表1所示,可以发现静息细胞催化过程控温在30℃,细胞有较好的转化效果。

表1 不同温度对静息细胞催化合成2-KGA的影响Table 1 The effect of temperature on the 2-KGA production by resting cells

表2 不同pH对静息细胞催化合成2-KGA的影响Table 2 The effect of pH on the 2-KGA production by resting cells
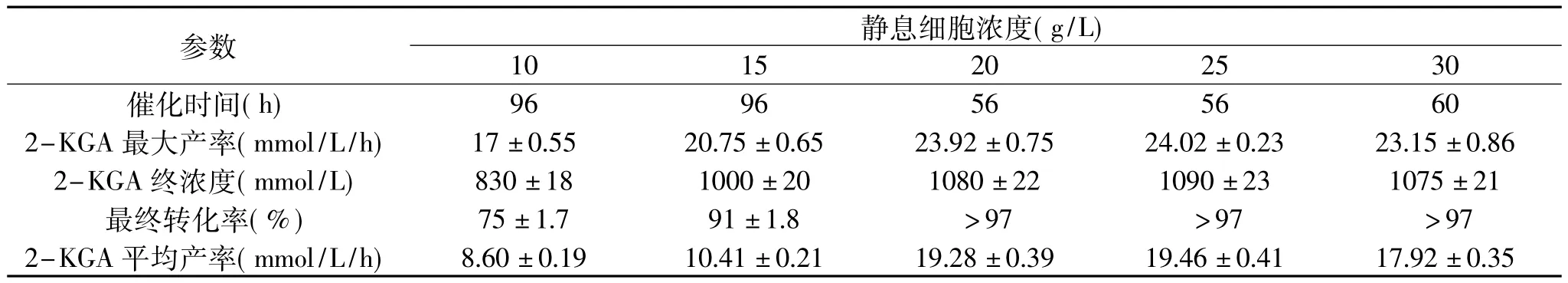
表3 不同静息细胞浓度对催化合成2-KGA的影响Table 3 The effect of concentration of resting cells on the 2-KGA production

图3 培养时间对静息细胞催化活性的影响Fig.3 The effect of incubation time on the activity of resting cells
2.3.2 pH对静息细胞催化活性的影响 文献报道,G.oxydans中的酶GA-2-DH通常在酸性环境下表现较好的活性;对于某些氧化葡萄糖酸杆菌在催化GA或葡萄糖时,生成2-KGA与5-KGA比例也受pH的影响[14]。因此实验考察了不同 pH的反应体系中2-KGA的生成情况,结果如表2所示。
不同pH条件下G.oxydans#3A催化GA合成2-KGA的效率差异较为明显,pH4.5~6.0之间,GA的转化效率和2-KGA的产量最高,而在pH5.0时产物的时空产率最高。反应体系的pH低于4.0或高于6.0,都不利于催化反应的进行。实验所得到最适pH与Ano以及Shinagawa等人所报道的GA-2-DH最适pH较为相似[17]。
2.3.3 细胞浓度对静息细胞催化活性的影响 实验在底物GA浓度1100mmol/L(242g/L)条件下对细胞浓度进行优化。从表3看出反应体系中菌体含量在10g/L增至15g/L时,反应的速度也随着增大,但是当细胞继续增加至30g/L时,细胞合成2-KGA的效果反而变差,这可能由于:细胞过多造成底物传质利用效率的变差;氧传质变差以及过多细胞需要大量的氧,造成局部缺氧甚至菌体自溶,这严重影响催化效率以及自溶引起的胞内物释放造成下游分离压力加大。因此,实验选择20g/L作为最优的菌体浓度。
2.3.4 底物浓度对静息细胞催化活性的影响 反应体系中底物浓度过高可能会引起底物抑制,减慢底物的利用速率,而且可能由于一定时间内底物不能被完全转化成产物,从而以“副产物”形式存在于催化终体系中,造成资源浪费和下游分离难度加大,特别是对GA与2-KGA这样分离较为困难的反应,因此一个较为理想的底物浓度对于催化的高效性与实效性有着一定的意义。表4可以看出摇瓶催化体系中底物浓度为1100mmol/L时,催化效果相对较优。另外,通过流式细胞检测技术(检测图谱未给出)对各个底物浓度条件下催化36h后的菌体形态进行检测,可以发现随着体系中底物浓度的增大,静息细胞受到的损伤越大,细胞形态维持越差。
2.3.5 摇床转速对于静息细胞催化活性的影响 氧化葡萄糖酸杆菌是一类严格好氧微生物,溶氧对催化反应非常关键,这主要是由于GA氧化合成2-KGA时脱下的[H]的受体是氧,反应体系中溶解氧浓度决定了反应的速率与底物的投料量。在摇瓶催化体系中,溶氧很大部分受到摇床转速的影响,因此实验中对摇床转速进行了考察,从表5可以看出,适当的提高摇床转速可增加2-KGA的时空产率。但当转速提高到300 r/m in时,由于转速太快体系中形成明显漩涡状,甚至反应液会被甩出反应瓶,反而不利于溶氧与传质,反应效果变差。

表4 不同底物GA浓度对催化合成2-KGA的影响Table 4 The effect of GA concentration on the 2-KGA production by resting cells

表5 不同摇床转速对催化合成2-KGA的影响Table 5 The effect of rotation speed on the 2-KGA production by resting cells
因此,通过上述摇瓶中的单因素考察,在30℃、pH5.0、细胞浓度20g/L、底物浓度1100mmol/L、摇床转速250r/min的优化条件下,催化过程最大时空产率达到31.63mmol/L/h,平均时空产率为24.68mmol/L/h,转化率在97%以上。
2.4 7L反应器上规模放大以及工艺优化
摇瓶实验存在传质以及溶氧供应方面的劣势,其转化效率相对较低,为了更好的研究以及提高G.oxydans#3A对于催化GA合成2-KGA的能力,实验在7L发酵罐中对影响催化效果的关键因素(溶氧、底物浓度)进行了进一步优化,结果如图4与图5所示。

图4 发酵罐搅拌速度对合成2-KGA的影响Fig.4 The effect of stirring speed on the prodution in the fermentor

图5 发酵罐中不同底物浓度对合成2-KGA的影响Fig.5 The effect of concentration of GA on 2-KGA the 2-KGA prodution in the fermentor
在转速考察过程中,由于合成2-KGA反应需氧量很大,实验中将通气开到最大值8L/min。从图4可以看出随着转速的提高,催化效果显著改善,在650 r/m in转速条件下,14±1h内G.oxydans#3A静息细胞基本将1100mmol/L的GA完全转化为2-KGA,时空转化率达73mmol/L/h,而相同细胞量摇瓶催化则需要44h;而当转速继续提高,溶氧并没有进一步上升,而催化效果也没有进一步提高,反而在搅拌体系中央容易形成真空圈,机械剪切对细胞的损伤也变大,不利于细胞的重复利用,因此在7L发酵罐中,初步确定较理想的搅拌速度为650 r/m in。
由于溶氧以及传质的改善,实验对底物也进行了进一步优化,根据化学反应过程的动力学原理可知r[P]=k×C[S1]×C[S2],底物浓度越大产物合成的速率越快。但由图5可以看出,本实验中葡萄糖浓度在1375~1835mmol/L时,合成2-KGA的速率随着底物浓度的提高反而减小,这主要是由于底物浓度不合适地增大造成溶氧情况与底物传质相对低浓度较差,而且在高密度、高渗透压与高粘度的溶液中,静息细胞菌体在高速搅拌下容易破碎失活,在1835mmol/L浓度条件下表现最为明显,经过48h催化后的细胞颜色变成褐红色,离心后的菌体变成絮团状,因此将较优浓度设为1375mmol/L。
2.5 G.oxydans#3A静息细胞在7L发酵罐上的重复利用
在 30℃、pH5.0、细胞浓度 20g/L、底物浓度1375mmol/L、搅拌速度 650 r/m in条件下进行G.oxydans转化实验,每次转化反应结束(当溶氧开始急速上升时),离心收集细胞进行下一轮催化反应。根据图6显示,反应在前3批中均显示很好的重复性,催化活性能保持在上一批95%以上,但是在进行到第4批时,由于静息细胞长时间暴露在高渗透环境以及较高机械剪切的情况下,导致细胞破裂加剧,离心得到的细胞仅为第三批的80%左右,反应体系气泡异常严重影响溶氧,细胞的催化活性开始显著下降,因此目前反应有效批次为3批,2-KGA时空产率达到67.5~74.0mmol/L/h。

图6 7L发酵罐上静息细胞催化GA合成2-KGA的批次研究Fig.6 The repeated utilization of resting cells to produce 2-KGA from GA in 7L fermentor
3 结论
本实验已筛选得到的一株高产2-KGA的菌株G.oxydans#3A,建立了静息细胞催化法合成2-KGA的工艺路线。在30℃,pH5.0,细胞浓度20g/L,底物浓度1365mmol/L条件下,底物转化率在97%以上,2-KGA时空产率高达74mmol/L/h,细胞能够有效重复利用3次。这一路线是2-KGA的生物合成中发酵法之外的另一条高浓度合成2-KGA的高效工艺路线,而且可以一定意义上解决目前发酵法中存在的主要问题:a.噬菌体污染问题没有从根本上得到解决;b.发酵体系中含有各种复杂的细胞分泌物,大大增加了下游产品分离、纯化与结晶的工艺。
[1]Sievers M,Swings J.The family acetobacteraceae.In:berger’s manual of systematic bacteriology 2nd edition[M].Springer,2005:41-95.
[2]魏国栋,魏东芝,林金萍.氧化葡萄糖酸杆菌立体选择催化2-甲基-1,3-丙二醇合成(R)-β-羟基异丁酸[J].食品与发酵工业,2010,36(8):12-16.
[3]郑大贵,叶红德,余泗莲,等.由2-酮基-D-葡萄糖酸直接合成异VC的研究[J].食品工业科技,2004,25(7):115-117.
[4]Asakura A,Hoshino T,Kiyasu T.Manufacture of L-ascorbic acid and D-erythorbic acid[P].United States Patent: 616860,2000.
[5]Hall A N,Kulka D,Walker T K.Formation of arabinose,ribulose and tartronic acid from 2-keto-D-gluconic acid[J]. Biochemical Journal,1995,60(2):271-274.
[6]Dyer J R,Mcgonigal W E,Rice K C.StreptomycinⅡⅠstreptose[J].Journal of the American Chemical Society,1965,87 (3):654-655.
[7]Wolfrom M L,Shafizadeh F,Wehrmuller J D.Synthesis of amino compouns in the sugar series by phenylhydrazone reduction[J].Journal of Organic Chemistry,1958,23(4):571-575.
[8]William S,Verona N J.2,3:4,5-Di-O-substututed gluconates[P].United States Patent:3981860,1976.
[9]Chia M,Van N T,ChoiW J.DO-stat fed-batch production of 2-keto-D-gluconic acid from cassava using immobilized Pseudomonas aeruginose[J].Applied Microbiology and Biotechnology,2008,78(5):759-765.
[10]Elseviers M,Coomans SM J,Lemmens H O J,et al.Process for the production of 2-keto-D-gluconic acid[P].European Patent:0867446,2004.
[11]Neidleman S L,Amon JW F,Geigert J,et al.Production of 2-ketogluconic acid and hydrogen peroxide[P].European Patent: 160112,1982.
[12]孙文敬,陈丽,任蓓蕾,等.荧光假单胞菌AR4在2-酮基-D-葡萄糖酸工业生产中的应用研究[J].食品科学,2006,27(11):105-108.
[13]余泗莲,孙文敬,周强,等.2-酮基-D-葡萄糖酸连续发酵工艺[P].中国专利:101363033,2009.
[14]Toyama H,Furuya N,Saichana I,et al.Membrane-Bound,2-Keto-D-gluconate-Yielding D-gluconate dehydrogenase from“gluconobacter dioxyacetonicus”IFO3271:molecular properties and gene disruption[J].Applied and Enviromental Microbiology,2007,73(20):6551-6556.
[15]Silberbach M,Maier B,Zimmermann M,et al.Glucose oxidation by Gluconobacter oxydans characterization in shakingflasks,scale-up and optimization of the profile[J].Applied Microbiology and Biotechnology,2003,62(1):92-98.
[16]Saeki A,Theeragool G,Matsushita K,et al.Development of thermotolerant acetic acid bacteria useful for vinegar fermentation at higher temperatures[J].Bioscience Biotechnology Biochemical,1997,61(1):138-145.
[17]Ano Y,Shinagawa E,Adachi O,et al.Selective,high conversion of D-glucose to 5-keto-D-gluoconate by Gluconobacter suboxydans[J] .Bioscience Biotechnology Biochemical,2011,75(3):586-589.
High-yield production of 2-keto-D-gluconate by resting cells of G luconobacter oxydans
CHEN Hong-sheng,LIKe-fei,SHU Xing-zhou,LIU Liu,LIN Jin-ping*,WEIDong-zhi
(New World Biotechnology Institute,State Key Laboratory of Bioreactor Engineering,East China University of Science&Technology,Shanghai200237,China)
Resting cells of G.oxydans DSM2003 is used to p roduce the 2-keto-g luco-nate,which is a p rimary p recursor for the synthesis of D-erythoribic acid(EA).One bacterium with high-yield p roduction capacity was obtained by self-adap ting to the high concentration of substrate,and the conversion rate had reached 24.68mmol/L/h in flask(tem perature at 30℃,pH at 6.0,cell concentration at 20g/L,substrate concentration at 1100mmol/L,shaking rate at 250r/m in).While catalysis was carried in the 7L fermentor under the op timum cond ition,the conversion rate of 2-KGA could reach 74mm ol/L/h and the cell could be reused effec tively for three tim es.
2-KGA;Gluconobacter oxydans;resting cell catalysis;p rocess op tim ization
TS201.3
A
1002-0306(2012)19-0177-05
2012-03-19 *通讯联系人
陈鸿胜(1987-),男,硕士,研究方向:生物催化合成工艺。
国家863重点项目(2011AA02A213)。

