煮制条件对绿豆清汤颜色及抗氧化性的影响
陈 然,赵建京,范志红*
(中国农业大学食品科学与营养工程学院,北京 100083)
煮制条件对绿豆清汤颜色及抗氧化性的影响
陈 然,赵建京,范志红*
(中国农业大学食品科学与营养工程学院,北京 100083)
目的:研究绿豆清汤煮制过程中颜色与抗氧化能力变化的关系,考察煮制用水及添加白砂糖、食盐、小苏打等辅料的影响。方法:对煮制过程豆汤中酚类物质(总酚、总黄酮、缩合单宁)含量、pH值、颜色(L*值、a*值、b*值)及DPPH自由基清除率和FRAP(ferric reducing ability of plasma)值等抗氧化指标进行测定,并进行相关分析。结果:随着酚类物质溶出的增加,绿豆清汤颜色加深,抗氧化能力上升。与自来水煮制相比,去离子水煮制所得豆汤中酚类物质含量及抗氧化活性较高;加入白砂糖或小苏打降低豆汤抗氧化能力,而加入食盐增加其抗氧化能力。绿豆清汤的b*值与其抗氧化活性存在较强相关性。结论:酚类物质是绿豆清汤颜色及抗氧化能力的主要来源,并对豆汤pH值产生影响。使用弱酸性水煮制有利于得到颜色偏绿、抗氧化活性更强的绿豆清汤。
绿豆清汤;变色;多酚;抗氧化能力
绿豆汤是我国传统的清热消暑饮品,具有清热解毒、消暑、利水之功效。据古代药书记载,绿豆汤的功效与煎煮时间有关[1]。绿豆中含有大量类黄酮(主要为黄酮醇)化合物[2-3],此类物质主要存在于绿豆皮中[4-5]。类黄酮化合物具有解毒、扩张冠状动脉血管和降低血脂甾醇的作用,并具有一定的抗癌活性[6]。所以,绿豆的种皮是其生物活性的主要来源。
胡梁斌等[7]对绿豆汤中水溶性色素抗氧化性进行了探讨,但有关绿豆汤煮制条件及辅料对其颜色及抗氧化性影响的研究未见报道。本实验研究绿豆清汤煮制过程中酚类物质溶出规律、抗氧化活性及颜色变化,并考察煮制用水、辅料对绿豆清汤抗氧化性的影响,从而确定其中抗氧化活性的主要来源,分析其颜色与抗氧化活性的关系,并为绿豆清汤的合理煮制方法提供参考数据。
1 材料与方法
1.1 材料与仪器
真空包装绿豆 吉林省洮南市;三吡啶三吖嗪(TPTZ)、N,N-二苯基三硝基苯肼(diphenylpicrylhydrazyl,DPPH) 美国Sigma公司;儿茶素 中国药品生物制品检定所;没食子酸、香草醛、抗坏血酸、丙酮、浓盐酸、碳酸钠、亚硝酸钠、结晶三氯化铝、氢氧化钠、三水合乙酸钠、乙酸、六水合三氯化铁、硫酸亚铁、乙醇等试剂均为分析纯。
电子天平(d=0.001g) 北京赛多利斯仪器系统有限公司;UV-5200型紫-外可见分光光度计 上海元析仪器有限公司;TP2型全自动色差计 北京奥克依光电仪器有限公司;pH计 梅特勒-托利多仪器(上海)有限公司。
1.2 方法
1.2.1 样品处理
采用冷凝回流装置隔绝氧气,水煮开后再放绿豆灭活多酚氧化酶,同时为了避免绿豆皮破裂内容物溶出,煮制时间控制为10min。具体步骤如下:清洗绿豆:称取10.00g绿豆,用去离子水清洗,每次50mL,清洗3次;烧水:量取100mL煮制用水,倒入250mL圆底烧瓶中,烧瓶上接球形冷凝管冷凝回流,将电热套的功率调为最大(220V),加热至沸腾;煮绿豆清汤:将清洗好的绿豆放入烧瓶中,煮沸一定时间,绿豆清汤煮好后,抽滤,冷却至室温,定容到100 mL,立即进行酚类物质、抗氧化活性、颜色等项目测定;根据日常经验及预实验确定辅料添加量:白砂糖5g/100mL,10g/100mL,食盐0.05g/100mL,小苏打0.005g/100mL;以去离子水(pH6.04)、自来水(pH7.72,总硬度381mg/L)分别煮制绿豆清汤,得到去离子水绿豆清汤(DWMS)和自来水绿豆清汤(TWMS),进行对比分析。
1.2.2 色差值的测定
采用色差计测定颜色的3个分量L*、a*、b*。其中L*值代表明度;a*值代表红绿色度;b*值代表黄蓝色度。
1.2.3 总酚含量(total phenolic contents,TPC)测定
采用福林-酚法[8]进行测定。取150μL样品溶液,加入3mL去离子水、250 μ L福林酚试剂和750 μ L 7g/100mL Na2CO3溶液,混匀,室温静置8min。加入850μL去离子水,混匀。在室温下反应120min。以提取试剂为空白对照,在765nm处测定其吸光度。总酚含量以没食子酸当量(gallic acid equivalent)表示(mg GAE/100mL豆汤)。
1.2.4 总黄酮含量(total flavonoids content,TFC)测定
采用三氯化铝显色法[9]进行测定。取700μL样品,加入2.5mL去离子水和150μL 5g/100mL NaNO2溶液,混匀,静置6min。加入300μL新制备的10% AlCl3·6H2O溶液,混匀,静置5min。加入1mL 1mol/L NaOH溶液和350μL去离子水,混匀。以提取试剂为空白,测定510nm处吸光度。总黄酮含量以儿茶素当量[(+)-catechin equivalent]表示(mg CAE/100mL 豆汤)。
1.2.5 缩合单宁含量(condensed tannin content,CTC)测定
参照William等[10]的方法,并略改动。取500μL样品溶液,加入3mL 4%香草醛甲醇溶液和1.5mL浓盐酸,充分混匀。室温下避光放置15min。以提取试剂为空白对照,测定波长500nm处吸光度。缩合单宁的含量以儿茶素当量表示(mg CAE/100mL豆汤)。
1.2.6 铁还原抗氧化能力(ferric reducing ability of plasma,FRAP 值)测定[11]
将300mmol/L醋酸钠缓冲溶液(pH3.6)、10mmol/L TPTZ盐酸溶液(盐酸浓度40mmol/L)、20mmol/L FeCl3溶液按照10:1:1(V/V)混合制得FRAP工作液。此工作液现用现配,并于37℃水浴中保温。取3.6mL FRAP工作液,加入120μL样品和360μL去离子水。旋涡混匀后置于37℃水浴中反应10min,于波长593nm处测定其吸光度。空白以实验用水代替样品。结果以Fe2+当量表示(mmol Fe2+/100mL 豆汤)。
1.2.7 DPPH自由基清除率测定[12]
取200μL样品溶液,加入3.8mL DPPH乙醇溶液(0.1mmol/L),混匀。室温下避光反应30min,以乙醇为空白,于517nm处测定溶液吸光度A样品。以实验用水代替样品重复上述步骤得到A对照。以抗坏血酸作为对照,结果以抗坏血酸当量表示(μg AAE/100mL豆汤)。

1.2.8 数据统计分析
每个处理组做3次平行,每次实验重复测定3次,结果以平均值±标准差表示。利用SAS(V8)软件对试验数据进行统计分析。采用t检验分析两独立样本均数的差异性(P<0.05),采用邓肯氏多重比较法对多个独立样本的两两均数进行差异性分析(P<0.05)。采用皮尔逊相关分析分析各指标间的相关性。
2 结果与分析
2.1 绿豆清汤煮制过程中的变化
采用煮制时间为2、4、6、8、10min作为观察点,对绿豆清汤煮制过程进行研究。
2.1.1 总酚含量随煮制时间的变化

图1 煮制时间对绿豆清汤总酚含量的影响Fig.1 Effect of boiling time on TPC of mung bean soup
由图1可知,在0~8min内,两种豆汤总酚含量基本相同;8min之后,自来水绿豆清汤(TWMS)总酚含量增加趋缓;煮制终点时,去离子水绿豆清汤(DWMS)总酚含量明显高于TWMS总酚含量。
2.1.2 总黄酮含量随煮制时间的变化

图2 煮制时间对绿豆清汤总黄酮含量的影响Fig.2 Effect of boiling time on TFC of mung bean soup
由图2可知,在0~4min内,DWMS和TWMS总黄酮含量相当;4min后,两种绿豆清汤总黄酮含量差别逐渐增大;最终DWMS总黄酮含量明显高于TWMS总黄酮含量。
2.1.3 缩合单宁含量随煮制时间的变化
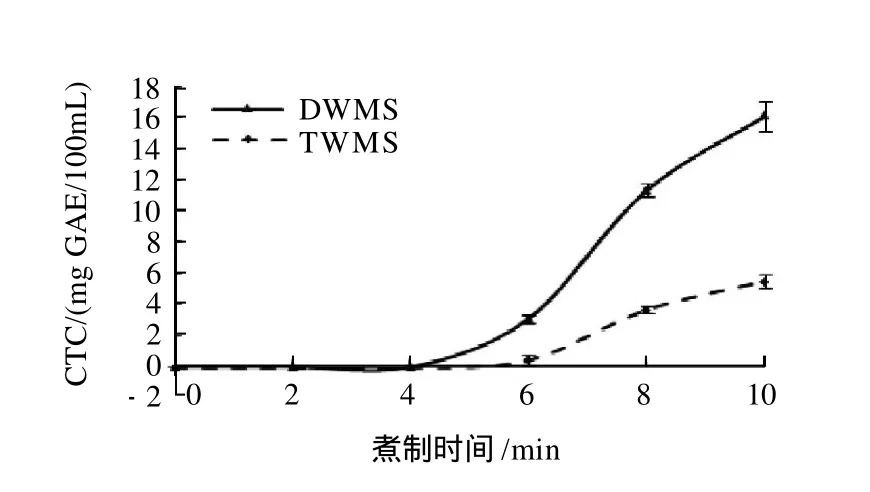
图3 煮制时间对绿豆清汤缩合单宁含量的影响Fig.3 Effect of boiling time on condensed tannin content of mung bean soup
由图3可知,煮制初始阶段两种豆汤中几乎无缩合单宁溶出;4min之后,DWMS缩合单宁含量迅速大幅增加;6min时TWMS逐渐有缩合单宁溶出;煮制10min时,DWMS缩合单宁含量远高于TWMS缩合单宁含量。
2.1.4 FRAP值随煮制时间的变化

图4 煮制时间对绿豆清汤FRAP值的影响Fig.4 Effect of boiling time on FRAP value of mung bean soup
由图4可知,在0~4min,两种豆汤FRAP值基本相同;4min之后,DWMS的FRAP值增加趋势明显高于TWMS;最终DWMS的FRAP值明显高于TWMS的FRAP值。
2.1.5 DPPH自由基清除率随煮制时间的变化

图5 煮制时间对绿豆清汤DPPH自由基清除率的影响Fig.5 Effect of boiling time on DPPH free radical scavenging ability of mung bean soup
由图5可知,0~6min时,TWMS的DPPH自由基清除率基本为0,随后才逐渐增加。DWMS的DPPH自由基清除率从煮制开始就随时间的延长逐渐增加,其中4~8min增加最快,8min后增加趋缓。10min时,DWMS的DPPH自由基清除率大幅高于TWMS的DPPH自由基清除率。
2.1.6 pH值随煮制时间的变化
由图6可知,两种豆汤pH值差别较大,TWMS偏碱性,而DWMS偏酸性。煮制过程中,DWMS的pH值几乎不变;TWMS在0~2min内,pH值快速上升,之后随煮制时间的延长,酚类物质溶出增加,pH值逐渐下降,这与多酚水溶液较强的缓冲能力有关[13]。两种豆汤在pH值及其变化趋势方面的差别,推测与煮制用水本身的pH值有关。

图6 煮制时间对绿豆清汤pH值的影响Fig.6 Effect of boiling time on pH value of mung bean soup
2.1.7 绿豆清汤颜色随煮制时间的变化
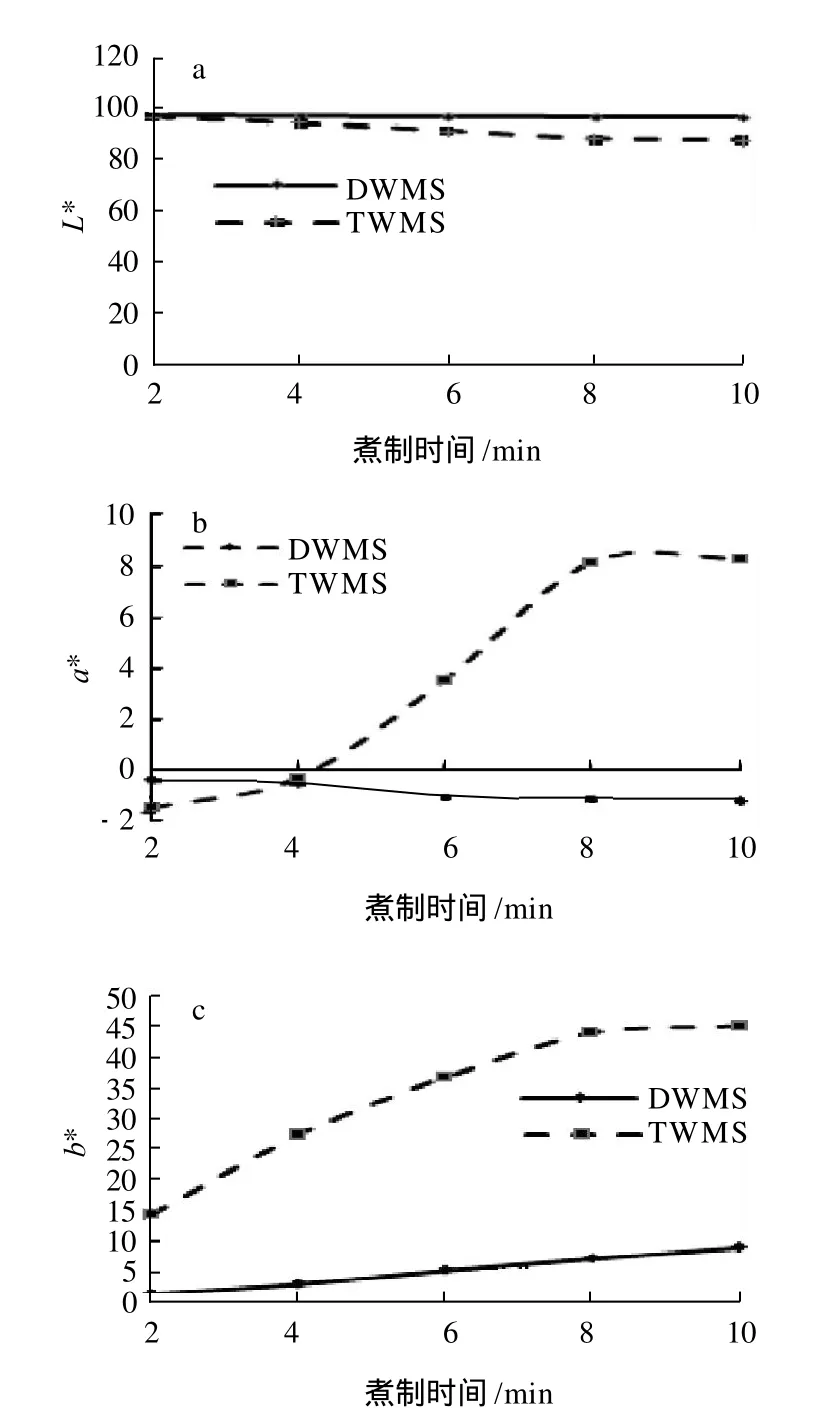
图7 煮制时间对绿豆清汤颜色的影响Fig.7 Effect of boiling time on color values of mung bean soup
由图7可知,TWMS的L*值随煮制时间的延长逐渐减小,说明随煮制时间的增加,TWMS透明度逐渐降低;DWMS的L*值基本保持不变。两种豆汤a*值差别较大;DWMS的a*值始终为负,随煮制时间增加,a*值逐渐降低,绿色加深;TWMS的a*值在0~4min为负且低于同时段DWMS的a*值,说明此阶段TWMS比DWMS偏绿;4~10min,TWMS的a*值由负变正并逐渐增大,颜色由绿变红且逐渐加深。两种豆汤b*值均为正,且逐渐升高; TWMS的b*值明显高于DWMS,说明TWMS更偏黄。
2.1.8 相关性分析
对两种绿豆清汤煮制过程中抗氧化活性、酚类物质含量、颜色、pH值进行相关性分析,结果如表1、2所示。

表1 DWMS煮制过程中酚类物质含量、抗氧化活性、pH值、颜色值之间的相关性Table 1 Correlations among phenolic contents, antioxidant activities,pH and color values of mung bean soup prepared with deionized water

表2 TWMS煮制过程中酚类物质含量、抗氧化活性、pH值、颜色值之间的相关性Table 2 Correlations among phenolic compounds, antioxidant activities,pH and color values of mung bean soup prepared with tap water
对于D W M S,总酚、总黄酮、缩合单宁含量、FRAP值、DPPH自由基清除率两两之间极显著正相关。pH值与总酚、总黄酮含量、FRAP值、DPPH自由基清除率显著正相关。L*值与总酚、总黄酮、缩合单宁含量、FRAP值、DPPH自由基清除率显著负相关,说明酚类物质的溶出使绿豆清汤浓度增大,澄清度下降。a*值与总酚、总黄酮含量、FRAP值、DPPH自由基清除率显著负相关;b*值与总酚、总黄酮、缩合单宁含量显著正相关,与FRAP值、DPPH自由基清除率极显著正相关,即绿豆清汤越偏黄、绿色,绿豆清汤的酚类物质含量越高,抗氧化活性也越强。
对于T W M S,总酚、总黄酮、缩合单宁含量、FRAP值两两之间显著正相关,DPPH自由基清除率与总黄酮、缩合单宁含量、FRAP值显著正相关。pH值仅与DPPH自由基清除率显著负相关,说明TWMS的pH值变化可能受自来水本身影响较大。L*值、b*值与总酚、总黄酮、缩合单宁含量及FR A P值的相关性与DWMS相似,但a*值的变化趋势相反。
由相关性分析结果可知,绿豆清汤抗氧化活性与其中酚类物质含量显著正相关,其抗氧化能力取决于酚类物质含量;酚类物质是豆汤颜色的主要来源,也会对豆汤的pH值产生较大影响。
2.1.9 两种绿豆清汤差异性分析
对煮制终点时DWMS和TWMS进行差异性分析,结果表明两种豆汤中总酚、总黄酮、缩合单宁含量、FRAP值、DPPH自由基清除率、pH值、L*值、a*值、b*值均存在显著性差异(P<0.05)。说明煮制用水的水质对绿豆清汤的各项指标均有显著影响。
Al3+、Fe3+等金属离子可与黄酮类化合物发生络合反应,使得共轭体系的能量发生变化,吸收峰红移而呈现黄色(即b*值为正)[14-15]。自来水中金属离子含量明显高于去离子水,推测自来水中的金属离子与绿豆清汤中的酚类成分发生络合反应使其黄色加深。
在碱性条件下黄酮类化合物开环,转变为查尔酮类化合物,显橙黄色(即a*、b*值为正)[15-16]。自来水煮制过程中绿豆清汤始终处于碱性条件下,故自来水绿豆清汤a*值为正,呈现红色。
2.2 食品添加辅料对绿豆清汤抗氧化活性的影响
2.2.1 白砂糖对绿豆清汤抗氧化活性的影响
白砂糖对DWMS和TWMS抗氧化活性的影响如图8所示。
对于DWMS,添加白砂糖后绿豆清汤的FRAP值、DPPH自由基清除率均显著下降,且糖浓度越高,绿豆清汤抗氧化活性越低。对于TWMS,添加5%白砂糖时,FRAP值显著升高,添加10%时,FRAP值最低;DPPH自由基清除率变化与DWMS相似。白砂糖的添加对两种绿豆清汤的抗氧化活性均有显著影响(P<0.05)。
白砂糖加入煮制用水中,成为相应的糖溶液,与煮制用水本身相比,渗透压升高,可能导致绿豆中酚类物质的溶出减少,此外,糖分子也可能与酚类物质发生相互作用[12],这可能是绿豆清汤抗氧化活性的降低、颜色改变的原因。
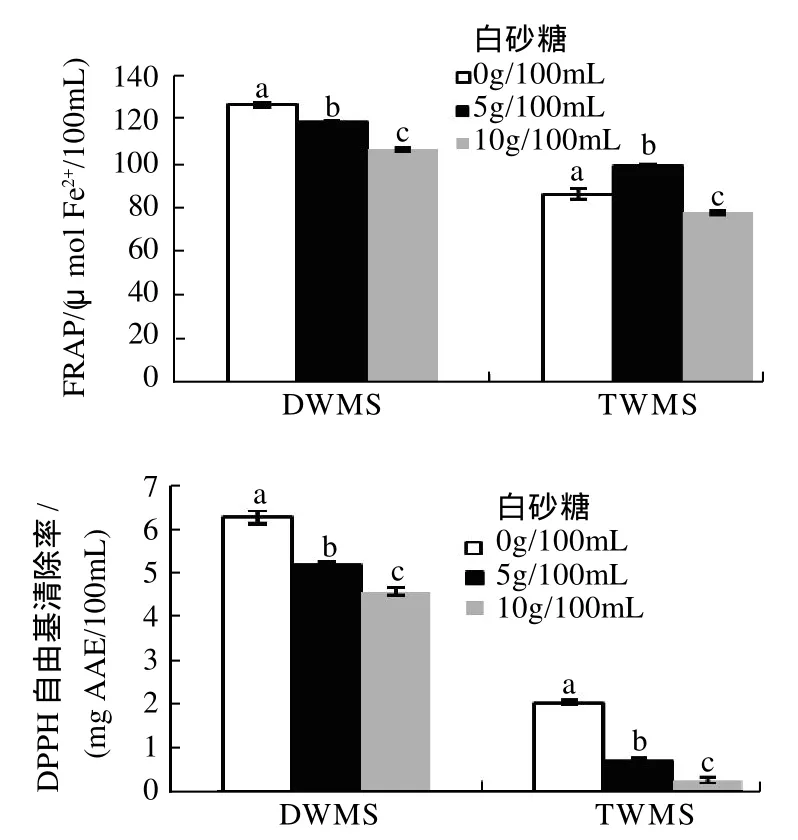
图8 白砂糖对绿豆清汤抗氧化活性的影响Fig.8 Effect of sugar on antioxidant activities of mung bean soup
2.2.2 食盐对绿豆清汤抗氧化活性的影响
添加0.05g/100mL食盐对DWMS和TWMS抗氧化活性的影响如图9所示。

图9 食盐对绿豆清汤抗氧化活性的影响Fig.9 Effect of salt on antioxidant activities of mung bean soup
添加食盐略微提高了两种豆汤的抗氧化活性。食盐显著提高了两种绿豆清汤的FRAP值和DPPH自由基清除率,推测食盐中的Na+与豆汤的酚类物质发生了相互作用[12],提高了酚类物质的抗氧化能力。
2.2.3 小苏打对绿豆清汤抗氧化活性的影响
添加小苏打对DWMS和TWMS抗氧化活性的影响如图10所示。

图10 小苏打对绿豆清汤抗氧化活性的影响Fig.10 Effect of dietary alkali on antioxidant activities of mung bean soup
小苏打对两种绿豆清汤FRAP值的影响甚微,但明显降低了两种豆汤的DPPH自由基清除率。加入小苏打后可能中和了豆汤中部分酚类物质,同时提高了体系的pH值,导致豆汤中的酚类物质发生自动氧化[17],这可能是小苏打显著降低两种绿豆清汤抗氧化活性的原因。
3 结 论
研究发现,在10min之内,随煮制时间增加,绿豆清汤中酚类物质含量逐渐增加,颜色加深,抗氧化能力上升。豆汤抗氧化活性取决于其中酚类物质的含量,酚类物质是绿豆清汤颜色的主要来源,也会对其pH值产生较大影响。煮制过程中绿豆清汤的颜色与其抗氧化活性存在较强的相关性,绿豆清汤L*值越小,b*值越大,抗氧化能力越强。
去离子水绿豆清汤酚类物质含量及抗氧化活性均显著高于自来水豆汤,去离子水豆汤颜色偏黄、绿色,自来水豆汤偏黄、红色,推测两者的差异由煮制用水pH值不同所导致。在煮制绿豆清汤时加入白砂糖和小苏打会降低其抗氧化能力,加入食盐可以增加其抗氧化活性,具体反应机理还需进一步探讨。煮制绿豆清汤时使用弱酸性水煮制并添加少量的食盐能够得到颜色偏绿,抗氧化活性更强的绿豆清汤。
[1] 傅翠真. 绿豆清汤的药用成分初步研究[J]. 食品工业科技, 1990, (3): 10-11.
[2] KIM D K, KIM J B, CHON S U, et al. Antioxidant potentials and quantification of flavonoids in mung bean (Vigna radiate L.) seeds[J].Plant Resources, 2005, 8(2): 81-176.
[3] PENG Xiaofang, ZHENG Zongping, CHENG Kawing, et al. Inhibitory effect of mung bean extract and its constituent vitenxin and isovitexin on the formation of advanced glycation endproducts[J]. Food Chem, 2008,106(2): 475-481.
[4] LEE K G, SHIBAMOTO T. Antioxidant properties of aroma compounds isolated from soybeans and mung bean[J]. J Agric Food Chem,2000, 48(9): 4290-4293.
[5] LIN C C, WU S J, WANG J S, et al. Evaluation of the antioxidant activity of legumes[J]. Pharmaceutical Biology, 2001, 39(4): 300-304.
[6] 卫莉, 钟秀珍, 张宝才. 绿豆皮中黄酮类化合物的提取及定量测定[J]. 郑州轻工业学院学报: 自然科学版, 2001, 16(1): 58-62.
[7] 胡梁斌, 赵旭娜, 王淼焱. 绿豆清汤中水溶性色素的抗氧化活性与抗癌活性研究[J]. 江西农业学报, 2010, 22(2): 104-106.
[8] SINGLETON V, LAMUELA-RAVENTOS R. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J]. Methods Enzymol, 1999, 299: 152-178.
[9] XU B J, YUAN S H, CHANG S K C. Comparative analyses of phenolic composition, antioxidant capacity, and color of cool season legumes and other selected food legumes[J]. Journal of Food Science, 2007, 72(2): 167-177.
[10] WILLIAM T J, RICHARD B B, JOHN W L. The condensed tannins of pasture legume species[J]. Phytochemistry, 1976, 15(9): 1407-1409.
[11] IRIS F, BENZIE F, STRAIN J J. The ferric reducing ability of plasma(FRAP) as a measure of antioxidative power: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76.
[12] XU B J, CHANG S K C. A comparative study on phenolic profiles and antioxidative activity of legumes as affected by extraction solvents[J].Journal of Food Science, 2007, 72(2): 159-166.
[13] 石碧. 植物多酚[M]. 北京: 科学出版社, 2000.
[14] 黄波, 张文鹏, 郭腾, 等. 自来水冲泡贡菊花茶变色机理及抗氧化活性差异研究[J]. 现代食品科技, 2009, 25(9): 1028-1031.
[15] 任引哲. 物质的颜色与结构[M]. 北京: 北京师范大学出版社, 1991.
[16] 陈继宗, 张喜梅, 李晓玺, 等. 联合优化提取甘草菊花复方中甘草酸和总黄酮的研究[J]. 现代食品科技, 2007, 23(2): 33-36.
[17] MIDORI K, TAMIYOSHI S, NAGAYAMA K. Effects of pH and metal ions on antioxidative activities of catechins[J]. Bioscience, Biotechnology Biochemistry, 2000, 65(1): 126-132.
Color and Antioxidant Activity of Mung Bean Clear Soup as Affected by Boiling Conditions
CHEN Ran,ZHAO Jian-jing,FAN Zhi-hong*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Objectives: To investigate the relationship between color values and antioxidant activity of mung bean clear soup(MBCS) and the effects of water type, granule sugar, table salt and sodium bicarbonate on them. Methods: Phenolic contents(total phenols, total flavonoids and condensed tannins), pH value, color values (L*, a* and b*) and antioxidant properties (DPPH free radical scavenging ability and FRAP value) of MBCS during cooking were tested and the correlations among these parameters were analyzed. Results: The color values and antioxidant activities of MBCS increased with increasing amount of dissolved phenols. Deionized water resulted in increased phenolic contents and antioxidant activity of MBCS compared to tap water. The antioxidant activities of MBCS were decreased by addition of sodium bicarbonate or granule sugar but increased by addition of salt. There was a strong correlation between the b* and antioxidant activities of MBCS. Conclusion: Phenols mainly contribute to the color and antioxidant activities of MBCS and influences the pH. Slightly acidic water is favorable for the preparation of green MBCS with strong antioxidant activity.
mung bean clear soup;color change;polyphenols;antioxidant capacity
TS201.2
A
1002-6630(2012)08-0115-06
2011-03-31
陈然(1989—),男,硕士研究生,研究方向为食物营养。E-mail:chenran71@126.com
*通信作者:范志红(1966—),女,副教授,博士,研究方向为食物营养。E-mail:daisyfan@vip.sina.com

