颌骨骨髓基质细胞与牙周膜细胞的生物学特性比较
王 欣,房 明,刘敏杰,董广英,王新文,刘玲侠,王勤涛
(第四军医大学口腔医学院,陕西西安 710032)
组织工程是牙周组织缺损较理想的再生性修复方法,合理选择种子细胞是其成功的关键[1]。牙周膜细胞是牙周组织的主要功能细胞,在牙周组织再生中起重要作用,是目前公认的牙周组织再生最佳来源细胞[2]。有动物实验表明,通过牙周膜干细胞可以构建功能性牙周膜[3-4],但其原代培养成活率低,来源有限。骨髓间充质干细胞也是一种很重要的种子细胞,目前研究较多的是来源于骨髓的间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)。但因其在骨髓中的含量非常低,所占比例为0.001% ~0.01%[5],而且取材又存在有创性,用其“自体回植”来治疗牙周病中的骨吸收,要承受二次创伤,病人接受率较低。Akintoye等[6](2006)研究提示骨髓来源的骨髓基质细胞存在部位差异性,颌骨来源的骨髓基质细胞具有更强的成骨能力,且取材简便、创伤小,便于自体回植,易被病人接受。本研究旨在对颌骨来源的骨髓基质细胞与牙周膜细胞的生物学特性进行了初步比较,为临床研究提供参考。
1 材料和方法
1.1 主要试剂和仪器
α-MEM培养液(Hyclone公司,美国);I型胶原酶(Gibco,美国);胰蛋白酶、胎牛血清(杭州四季青生物科技有限公司);β-甘油磷酸钠(Merck,德国);抗坏血酸、地塞米松、吲哚美辛、IBMX、胰岛素、油红O(Sigma,美国);茜素红(天津科密欧化学试剂有限公司);CO2孵箱(Shellab,美国);SW-CJ-2D型超净工作台(苏州净化设备公司);XDS-1 B型倒置相差显微镜(重庆光电设备厂);照相系统(SONY,日本);碱性磷酸酶试剂盒、细胞总蛋白试剂盒(中生北控生物科技股份有限公司);小鼠抗人 STRO-1抗体(Santa Cruz,美国);FITC标记的山羊抗小鼠IgG(北京中杉金桥生物技术有限公司)。
1.2 细胞原代培养
1.2.1 牙周膜细胞的分离、培养
选择12~25岁志愿者因正畸需要拔除的牙周健康、无龋的前磨牙,刮取根中1/3牙周膜组织,移入离心管内,加入3 mg/mL的I型胶原酶消化1 h(37℃,50mL/L CO2),加入培养液(含100 mL/L胎牛血清、200 U/mL庆大霉素、100 U/mL青霉素的α-MEM,简称1号培养液)中止消化、离心弃上清,加入培养液3 mL吹悬后接种25 cm2培养瓶,37℃ 、50 mL/L CO2孵箱中进行培养,3 d后更换培养液并弃去未贴壁的细胞,相同条件下继续培养,2~3 d换液1次,倒置显微镜观察细胞形态。
1.2.2 颌骨骨髓基质细胞的分离、培养
在牙周手术中钻取颌骨骨松质,PBS反复吹洗3~4次,加入3 mL 1号培养液,接种于25 cm2培养瓶,37℃ 、50 mL/L CO2孵箱中培养,3 d后更换培养液并弃去未贴壁的细胞,相同条件下继续培养,2~3 d换液1次,倒置显微镜观察细胞形态。
1.3 两种细胞克隆形成率
分别取对数期生长期的牙周膜细胞和骨髓基质细胞,以1×103/皿接种于直径60 mm培养皿,静置培养10 d,每3 d换液1次,镜下观察培养板中细胞集落形成情况。10 d终止培养,弃原液,PBS洗3遍,以40 g/L多聚甲醛固定15 min,PBS洗3遍,加适量甲苯胺蓝染色液染色15 min,PBS洗去染色液,空气干燥后,进行细胞克隆计数。以≥50个细胞的集落为1个克隆。并按下列公式计算克隆形成率。

1.4 两种细胞生长曲线
分别取牙周膜细胞及骨髓基质细胞,以2×103/孔接种于96孔板,加入1号培养液200 μL,37℃、50 mL/L CO2孵箱中培养。连续培养6 d,每天取两种细胞各3孔(单纯加有200 μL培养基为空白对照),每孔加20 μL CCK-8液,常规孵育4 h后用酶标仪检测各孔450 nm OD值,以时间为横轴、OD值为纵轴绘制生长曲线。
1.5 间充质干细胞标志STRO-1表达的鉴定
分别取骨髓基质细胞及牙周膜细胞,以1×104/孔接种于96孔板,加入1号培养液200 μL,37℃、50 mL/L CO2孵箱中培养,待细胞单层铺满底壁时弃去原液,0.01 mol/L PBS清洗5 min×3次;40 g/L多聚甲醛固定15 min,PBS清洗5 min×3次;3 g/L TritonX-100处理 15 min,PBS振洗5 min×3次。正常羊血清封闭。滴加1∶50稀释的小鼠抗人 STRO-1抗体(一抗),4℃湿盒过夜,37℃复温1 h,PBS振洗5 min×3次;滴加1∶200稀释的FITC标记的羊抗小鼠二抗,37℃孵育1 h,PBS振洗5 min×2次,蒸馏水振洗1次,DAPI复染5 min,阴性对照用PBS代替一抗,其余步骤不变。倒置荧光显微镜观察、照相。
1.6 成脂诱导及油红O染色
分别取骨髓基质细胞及牙周膜细胞以2×105/瓶,加入3 mL 1号培养液,接种于25 cm2培养瓶,37℃ 、50 mL/L CO2孵箱中培养,待细胞伸展至70%汇合后,换成成脂诱导液(含1 mmol/L地塞米松、0.5 mmol/L IBMX、100 mg/L 消炎痛、10 mg/L胰岛素、100 mL/L胎牛血清的α-MEM)继续培养,每3 d换液1次,诱导培养14 d后,油红O染色,倒置相差显微镜观察,照相。
1.7 成骨诱导
1.7.1 碱性磷酸酶活性检测
分别取牙周膜细胞和骨髓基质细胞,以2×104接种于24孔板,每孔加入1号培养液1 mL,37℃、50 mL/L CO2孵箱中培养。待细胞生长至60% ~70%汇合时,两种细胞各随机分为两组,实验组更换矿化诱导液(含0.01 mol/L β-甘油磷酸钠、50 μg/mL维生素 C、0.01 mmol/L 地塞米松、100 mL/L FBS的αMEM)对照组使用1号培养液继续培养。分别于成骨诱导7、9、11、14 d各时间点,实验组取5孔,对照组取3孔,弃去原培养液,PBS洗3~4次,加入 3 g/L TritonX-100处理15 min,加入蒸馏水,分别以-80℃和37℃反复冻融3次后,提取细胞裂解液,离心取上清加于96孔板,以蒸馏水调零,参考碱性磷酸酶试剂盒说明书用酶标仪检测405 nm OD值。然后,再取同一孔细胞裂解上清液加于96孔板,以蒸馏水调零,参考细胞总蛋白试剂盒说明书用酶标仪测546 nm OD值。碱性磷酸酶结果用细胞总蛋白标准化(碱性磷酸酶OD值/细胞总蛋白的OD值)。
1.7.2 RT-PCR检测成骨诱导7 d OCN基因表达
分别取矿化诱导7 d的骨髓基质细胞和牙周膜细胞,按RNAsimple Total RNA Kit说明书提取细胞中总RNA,用SuperScriptTM Kit从提取的 RNA反转录合成 cDNA第1链,设计合成下述引物(表1),3 -磷酸甘油醛脱氢酶(glycer-aldehyde-3 phosphate dehydrogenase,GAPDH)为内参进行RT-PCR检测,产物经15 g/L琼脂糖凝胶电泳鉴定,通过灰度值进行半定量分析成骨相关基因骨钙蛋白(osteocalcin,OCN)mRNA表达情况。

表1 OCN引物序列
1.8 统计学分析
用SPSS 13.0统计软件,对所有数据进行单因素方差分析,两两比较用t检验,检验水准α=0.05。
2 结果
2.1 细胞形态学观察
倒置相差显微镜观察,颌骨来源骨髓基质细胞与牙周膜细胞在体外分离培养条件下,均呈成纤维样贴壁生长(图1)。
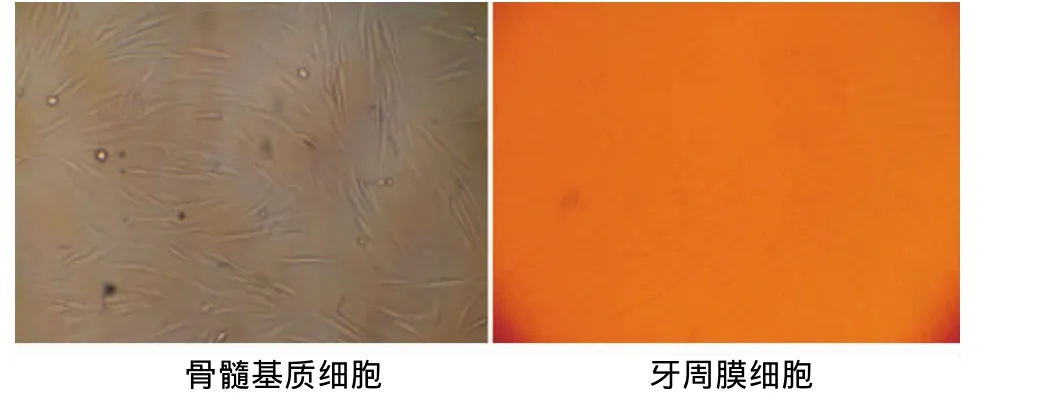
图1 两种细胞形态学比较(×50)
2.2 两种细胞克隆形成率比较
培养10 d有细胞克隆形成,镜下观细胞呈集落状生长,细胞形态呈梭形,体积较小,排列紧密。骨髓基质细胞获得克隆株65株,克隆形成率为6.5%;牙周膜细胞获得克隆集落38株,克隆形成率为 3.8%。
2.3 两种细胞生长曲线
骨髓基质细胞与牙周膜细胞的生长曲线均呈“S”型,在接种后的第1天细胞数量均稍有减少,此后开始上升。两种细胞在1~4 d生长状态相近,此后牙周膜细胞仍保持缓慢上升趋势,而骨髓基质细胞则进入平台期(图2)。
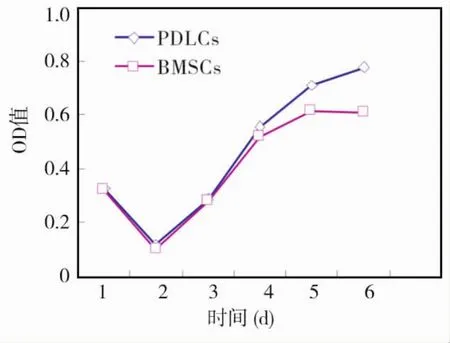
图2 骨髓基质细胞与牙周膜细胞生长曲线比较
2.4 STRO-1 表达情况
倒置荧光显微镜观察显示,颌骨骨髓基质细胞及牙周膜细胞STRO-1表达阳性(图3)。

图3 两种细胞STRO-1表达情况比较(×20)
2.5 两种细胞成脂诱导能力比较
成脂诱导14 d油红O染色,骨髓基质细胞及牙周膜细胞均可见脂滴形成(图4)。
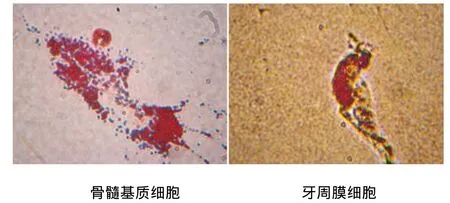
图4 两种细胞成脂诱导14 d油红O染色(×400)
2.6 两种细胞成骨能力比较
2.6.1 碱性磷酸酶活性
成骨诱导后经碱性磷酸酶活性的定量检测显示,两种细胞实验组在7 d时即有碱性磷酸酶的分泌,前者较高,之后快速上升9 d时达高峰,然后逐渐下降,而牙周膜细胞实验组在9 d开始一直保持缓慢上升趋势;相对比较来看,骨髓基质细胞对照组,7~9 d碱性磷酸酶活性较弱,此后开始出现上升,与牙周膜细胞实验组趋势相近,而牙周膜细胞对照组一直保持较低水平(图5)。
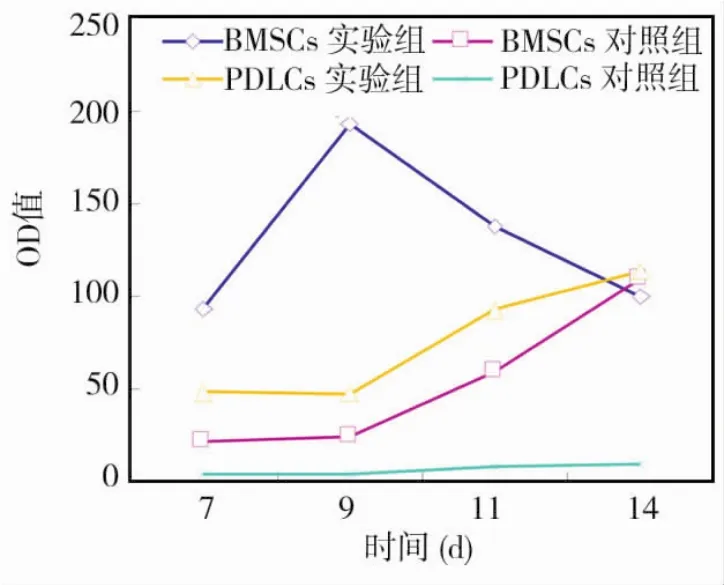
图5 成骨诱导不同时间点碱性磷酸酶的OD值
2.6.2 成骨相关基因OCN表达情况
成骨诱导7 d时,RT-PCR检测BMSCs细胞有OCN的明显表达,PDLCs未表达;14 d时,PDLCs略有表达,而BMSCs的0CN基因表达更强,各时间点相比,两者差异均具有显著性(P<0.05)(图6)。
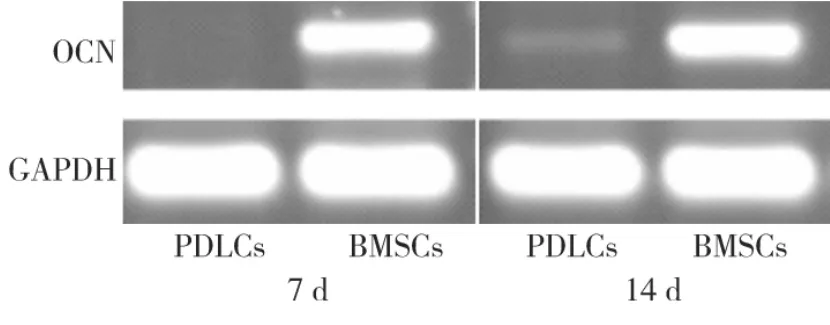
图6 成骨诱导7、14 d时,OCN基因的表达情况
3 讨论
本研究借鉴Akintoye等[6]的取材及原代培养方式,钻取颌骨骨松质,组织块培养法进行颌骨骨髓基质细胞的培养。与牙周膜细胞比较,其取材及原代培养方式比较简单、成活率高。
克隆化生长是干细胞的基本特性之一。本实验通过克隆平皿实验法,将一定数量的两种细胞的单细胞悬液均匀接种培养,一定时间后计数单细胞形成的克隆情况,所得结果与文献中报道的上、下颌骨、髂骨来源骨髓基质细胞(54、17、37/100000)[6]、牙周膜干细胞(40 ~ 45/5000)[7]等存在差异,这可能与培养环境、方法、条件及细胞自身的克隆形成能力有关,但至少能在一定程度上说明两种细胞具有克隆形成能力,可以自我更新。
STRO-1是间充质细胞的表面标志物,成体干细胞生存在特殊的微环境中,信号分子调控干细胞维持在正常功能状态,STRO-1阳性为来源于前血管微环境中干细胞的特征性标志[8-10],常被用来鉴定骨髓基质干细胞、牙周膜干细胞和牙髓干细胞。本实验中,培养的骨髓基质细胞及牙周膜细胞经免疫细胞荧光染色,细胞表面标志物STRO-1阳性表达,说明两种细胞均有一定的干细胞潜质。
碱性磷酸酶(ALP)是成骨分化早期的标志物,即使在骨细胞的形成期表达依然很强,因此ALP活性测定是成骨检测较为常用的方法。本实验中测定了成骨诱导后7、9、11、14 d等ALP活性变化趋势。骨髓基质细胞实验组与牙周膜细胞实验组比较,能在早期即显示较高的ALP活性,在9 d时达高峰,说明在诱导条件下,前者更容易向成骨方向分化;而骨髓基质细胞对照组虽然ALP活性不及实验组,但与牙周膜细胞对照组比较,其在9 d后仍表现出明显上升趋势,这可能与骨髓基质细胞在非诱导条件下即可向成骨方向自分化有关。
ALP基因是成骨细胞分化的早期标志物,OCN基因则是成骨细胞分化的成熟期或晚期标志物。通过检测ALP和骨钙素这两种成骨活性的典型标志可以用来基本判定成骨性能[11]。本实验中成骨诱导7 d时,骨髓基质细胞已经有ALP的分泌,基因水平有OCN的表达,9~14 d时ALP的活性逐渐呈下降趋势,OCN基因的表达升高,这可能与细胞逐渐进入矿化期有关;而牙周膜细胞的ALP分泌在观察期内,一直呈缓慢上升趋势,至成骨诱导14 d时,OCN基因仍无明显表达,一定程度上可以说明细胞还未进入矿化期。
本实验借鉴谈珺等[12]关于牙周炎性组织中干(祖)细胞的初步鉴定方法,从形态学、克隆形成率、间充质干细胞特异的STRO-1表达和横向诱导分化等方面对其进行了体外初步鉴定,进一步说明颌骨来源的骨髓基质细胞存在具有干细胞特性的细胞,如要证明其为干细胞,还需要进一步的研究。通过比较初步可以认为颌骨来源的骨髓基质细胞具有很强的增殖能力,在诱导及非诱导条件下,均能表现出成骨分化特性;但两种细胞作为种子细胞,运用于牙周组织再生中的差异,尚需要大量的体内实验进一步研究。
[1]Bartold PM,Shi S,Gronthos S.Stem cells and periodontal re-generation[J].Periodontol,2000,2006,40:164 -172.
[2]Lekic PC,Rajshankar D,Chen H,et al.Transplantation of labeled periodontal ligament cells promotes regeneration of alveolar bone[J].Anat Rec,2001,262(2):193 -202.
[3]Gronthos S,Mrozik K ,Sbi S,et al.Ovine periodontal ligaraentstem cells:isolation,characterization,and differentiation potential[J].Calcif Tissue Int,2006,79(5):310 -317.
[4]Sonoyarna W ,Liu Y ,Fang D,et al.Mesenchymal stem cell mediated functional tooth regeneration in swine[J].Plos One,2006,1:e79.
[5]Pittenger MF,Mackay AM,Beck SC,et al.Muhilineage potential of adult human mesenchymal stem cells[J].Science,1999.284(5411):143-147.
[6]Akintoye SO,Lam T,Shi S,et al.Skeletal site-specific characterization of orofacial and iliaccrest human bone marrow stromal cells in same individuals[J].Bone,2006,38(6):758 -768.
[7]Singhatanadgit W,Donos N,Olsen I.Isolation and characterization of stem cell clones from adult human ligament[J].Tissue Eng Part A,2009,15(9):2625 -2636.
[8]Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625 -13630.
[9]Shi S,Gronthos S.Perivascular niche of postnatal mesenchymal stem cells in human bone marrow and dental pulp[J].J Bone Miner Res,2003,18(4):696 -704.
[10]Gronthos S,Brahim J,LI KW,et al.Stem cell properties of human dental pulp stem cells[J].J Dent Res,2002,81(8):531 -535.
[11]Shimizu K.Ito A,Honda H.Mag-seeding of rat bone marrow stromal cells into porous hydroxyapatite scaffolds for bone tissue engineering[J].J Biosci Bioeng,2007,104(3):l71 - 177.
[12]谈珺,周丽华,周扬,等.人牙周炎症组织中干(祖)细胞的分离培养及初步鉴定[J].牙体牙髓牙周病学杂志,2011,21(3):130-133.

