pH值、温度和离子强度对色素与人类唾液相互作用的影响
林 锋,姚江武,2
(1.市口腔医院修复科,福建厦门 361003;2.福建医科大学口腔医学院修复科,福建福州 350002)
在日常生活中,茶、红酒和食用色素是天然牙最经常接触到的着色物。茶黄素(theaflavin,TF)、姜黄素(curcumin,Cur)和矢车菊素(cyanidin,Cy)等是分别来自于茶叶、姜黄和葡萄的提取物,广泛应用于食品添加剂中[1]。天然色素作为色源体与人唾液(human whole saliva,WS)作用,一方面沉积于牙面或义齿表面形成色渍,影响美观,另一方面色素与唾液蛋白结合,不但会抑制蛋白质的活性,同时色素-蛋白质复合物还会覆盖于口腔黏膜表面,使之产生干燥和皱缩感[2]。要了解色素沉着于牙齿表面和口腔黏膜的原因,就必须破解色素与唾液生物膜之间的作用机制。而且只有通过在体外构建牙着色的生理和生物学过程实验模型,才能更好地为研究预防和清除牙着色方法提供理论依据,因此,必须首先考察不同实验条件对口腔色素生物膜形成的影响。
表面等离子体共振(surface plasma resonance,SPR)技术可以将蛋白质分子自组装于SPR传感器芯片表面,具有生物样品无需标记、原位、实时和动态监测反应过程的特点,特别适合于研究聚合物高分子与蛋白质相互之间的作用机制,因此成为近年来生物学和材料学探索的新工具。本研究采用TF、Cur和Cy作为聚合物高分子色源体,利用SPR技术和表面吸附动力学原理,将WS自组装于芯片表面,考察不同温度、pH值和离子强度的条件下,对色素吸附于WS表面形成色素生物膜的影响,以期在未来对牙着色的研究中,能够建立更加符合牙着色的生理和生物学过程的体外实验模型。
1 材料和方法
1.1 实验仪器及试剂
表面等离子共振仪(Reichert SR7000DC,美国);低温离心机(Biofuge Fresco,Heraeus,德国);超纯水器(Millipore Direct-Q3,Millipore,法国)。纯度≥98% 的TF、Cur和Cy(Woko纯化学工业,日本);二甲基亚砜(DMSO,上海西宝生物);11-巯基十一烷酸(11-MUA);1、3-二甲基氨基丙基-3-乙基碳化二亚胺盐酸盐(EDC);N-羟基琥珀酰亚胺(NHS);牛血清白蛋白BSA和流动缓冲液 PBST(Sigma,美国)。
1.2 WS的收集及其蛋白质浓度测定
1.2.1 WS 的收集
选择10名口腔状况良好,无吸烟习惯的成人自愿者为对象,均在同一环境、上午8:00~10:00、空腹、禁止刷牙的情况下,经咀嚼棉球来收集刺激性全唾液,以避免环境及昼夜生理节律对唾液成分的影响。自愿者取坐位、低头、微张口,弃去第一口唾液后,让唾液自然流入置于冰上的离心管中。总共收集唾液1000 mL,4℃下,12000 r/min。离心10 min,取上清液存于-80℃冰箱中备用。步骤详见文献[3]。
1.2.2 WS 蛋白质浓度测定
采用Bradford法测定WS蛋白质浓度。首先绘制BSA液浓度与吸光度值(A595)的关系图,可得到一条标准曲线。然后,取唾液样本0.04 mL,加超纯水至0.1 mL,再加入考马斯亮蓝G-250试剂5 mL,混合5 min后测光吸收值A595。对照BSA液的标准曲线,即可求得WS的蛋白质浓度。步骤详见文献[4]。
1.3 自组装WS膜
芯片浸泡于60℃的10 mmol/L 11-巯基十一烷酸(11-MUA)/纯乙醇中24 h,取出后用纯乙醇冲洗,氮气吹干。通入的体积比为 1∶1的0.2 mol/L EDC 和0.1 mol/L NHS 混合液1 mL,活化SPR芯片10 min。注入1 mL的WS液至吸附达到稳态,再注入1 mol/L pH 8.5的乙醇胺盐酸1 mL,维持10 min,形成WS自组装单分子膜(self-assembled monolayer,SAM)。
1.4 SPR 动态监测
在不同的 pH 值(6、6.8、7.4,25 ℃,10 mmol/L PBST)、温度(25、30、35 ℃,10 mmol/L PBST,pH 值6.8)和离子强度(2.5、5、10、12.5、25、50 mmol/L PBST,25℃,pH 值6.8)条件下,形成不同的系统缓冲体系。以5 μL/min的流速分别将45 μmol/L的3种色素通入测量池,与固定于芯片上的全唾液相互作用,直至色素的吸附达到稳态,实时记录SPR芯片上发生反应的传感图谱。
1.5 统计学分析
用 SPSS 13.0 软件(SPSS Institute Inc,美国)对数据进行双因素方差分析,两两比较用SNK-q检验,检验水准 α =0.05。
2 结果
2.1 WS蛋白质的浓度
所采集的唾液经用Bradford法测定,其蛋白质浓度平均为1.043 mg/mL。
2.2 温度和pH值的作用
由响应强度(response unit,RU)计算得到的WS表面色素的吸附量与温度(图1a)和pH值(图1b)的函数关系图。3种色素在WS表面的响应强度均随着温度和pH值的升高而逐渐减少,表明吸附量亦随之逐渐减少。不同pH、不同温度组间差异均有统计学意义(P<0.05)。
2.3 离子强度的作用
色素吸附量与离子强度的函数关系(图1c)可见,离子强度对WS/色素之间相互作用的影响较为复杂。当离子强度低于5 mmol/L时,随着离子强度的增大,3种色素在WS表面的吸附量均减小,表现为负相关关系(P<0.05)。当离子强度由5.0 mmol/L提高到12.5 mmol/L时,随着离子强度的增大,3种色素在WS表面的吸附量也增大,呈正相关关系(P<0.05);当离子强度超过12.5 mmol/L时,3种色素在WS表面的吸附量随着离子强度的增大反而出现负增长(P<0.05)。
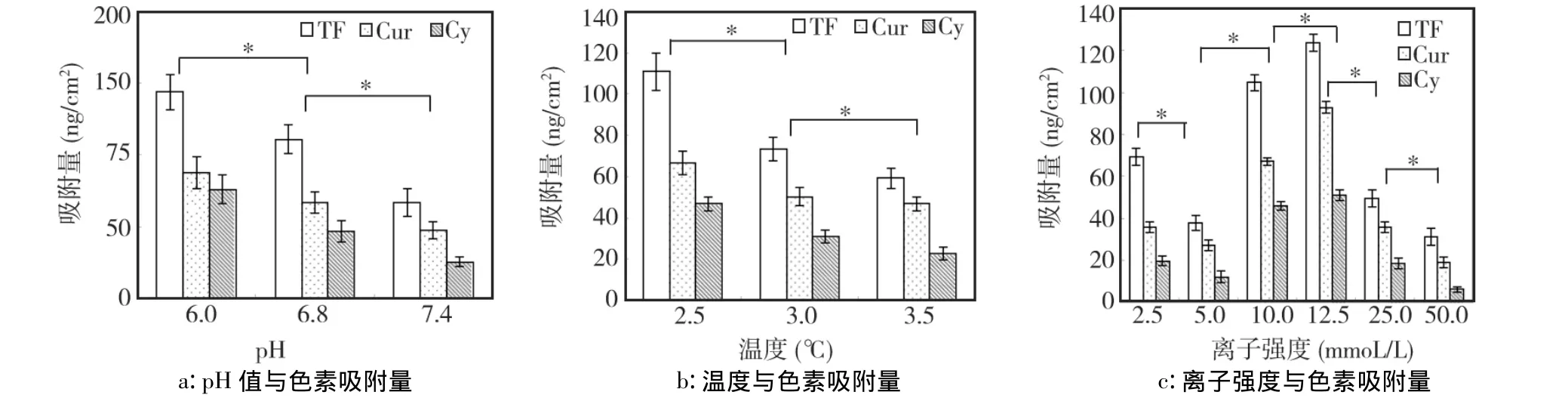
图1 不同温度、pH值和离子强度与WS表面色素吸附量的关系(*P<0.05)
3 讨论
SAM是分子通过化学键相互作用自发吸附在固/液或气/液界面,形成热力学稳定、能量最低的有序膜。在本研究中,11-MUA末端的羧基在以EDC为催化剂的条件下与NHS反应,转换为N-羟基琥珀酰亚胺酯,从而与唾液蛋白质分子中的氨基反应形成共价键结合,将蛋白质固定在固体表面。
在热动力学反应体系中,疏水性相互作用常常随着温度的增高而加大[5-6]。当反应温度升高时,蛋白质分子发生了构象改变,由折叠状态向伸展状态变化,从而暴露出较多的与聚合物发生疏水性反应的结合位点,使得蛋白质/聚合物之间的疏水性反应增强,故蛋白质与聚合物之间的结合增加。反之,当反应温度降低时,蛋白质分子的折叠状态更紧密,使蛋白质表面的疏水性结合位点减少,与聚合物之间的反应强度减弱,最终导致吸附量减少。在本研究中,当温度升高时,3种色素在唾液表面的吸附量降低。提示反应体系中疏水性反应不是唾液与色素相互作用的主要驱动力。该结果与Chitpan等的牛血清白蛋白与茶红素相互作用的研究结论一致[7]。
唾液是由多种蛋白质组成的两性分子混合物[8],已知蛋白质的等电点(isoelectric point,pI):黏液素5B(pI 6.2)、溶菌酶(pI 11.0)、乳铁蛋白(pI 8.6)、乳过氧化物酶(pI 8.3)、组蛋白 5(pI 10.3)、α - 淀粉酶(pI 6.3)[9]。本研究中,当溶液的pH=6.0时,唾液蛋白质表面带正电荷,色素分子带负电荷,二者之间具有较强的静电吸引作用,从而形成最大的吸附质量。当溶液的pH=7.4时,WS与色素分子均带负电荷,二者之间形成静电排斥作用而导致吸附量的大幅降低。当溶液的pH=6.8时,色素吸附于唾液蛋白质表面的质量介于pH 7.4和pH 6.0之间。随着pH值的升高,3种色素在唾液表面的吸附量逐渐减少趋势。因此,唾液蛋白质与色素分子表面电荷之间的静电反应在蛋白质–色素的相互作用中具有重要作用。
在本研究中离子强度对唾液–色素之间相互作用的影响较为复杂。相似的离子强度(I)效应在唾液与茶多酚高分子的相互作用,在我们从前的研究中也有发现[5-6],这些错综复杂的离子强度效应是由于唾液蛋白质分子复杂的带电特性所造成的。唾液蛋白质既带有正电荷,也带有负电荷,与色素分子之间同时存在静电吸引和静电排斥作用。而静电吸引和静电排斥作用与唾液蛋白质正电荷位点和色素负电荷位点(R+)及唾液蛋白质负电荷位点和色素之间负电荷位点(R–)的平均距离,以及德拜距离Rd(Rd≈0.3/I1/2)有关[5-6]。当色素吸附于唾液蛋白质表面在离子强度从5至12.5 mmol/L范围内时,则有R+<Rd<R–,离子强度增加的主要作用是屏蔽静电排斥作用,但不会影响色素与唾液蛋白质之间的静电吸引作用,最终导致了色素与唾液蛋白质之间的作用增强,色素吸附量增加。反之,当离子强度高于12.5,则有Rd< R+<R–,增加的离子强度同时屏蔽静电吸引与排斥作用,因此出现色素与唾液相互作用减弱,吸附量逐渐减少。然而当离子强度低于5.0 mmol/L时,随着离子强度的减小促进了蛋白质–色素间形成复合物,导致相应吸附量随离子强度的降低而增大。
本研究在不同的pH值、温度和离子强度的条件下,通过表面等离子体共振技术,考察了3种色素吸附于人唾液蛋白质表面的动力学特性。研究表明:伴随着pH值和温度的升高,3种色素与唾液的相互作用强度减弱,色素在唾液表面的吸附量降低。离子强度对于色素吸附于唾液表面的作用颇为复杂,与唾液蛋白质分子复杂的两性带电特性有密切关系,可能与色素和唾液蛋白质分子之间的屏蔽静电吸引与排斥作用有关。由此可见,唾液蛋白质与色素之间的作用驱动力源自静电反应。本实验为构建具有良好稳定性的体外色素着色模型提供了实验参数依据,将有助于进一步探索清除和预防牙表面形成色渍的机制,为预防牙着色的形成和了解口腔黏膜表面产生干燥和皱缩感的生理学机制奠定了实验依据。今后尚需利用光谱学进一步考察色素对唾液蛋白质构象和生化特性的影响。
[1]Papadopoulou A,Frazier RA.Characterization of protein-polyphenol interactions[J].Trends Food Sci Technol,2004,15(3):186-190.
[2]Tanizawa Y,Johna N,Yamamoto Y,et al.Salivary films on hydroxyapatite studied by in vitro system for investigating effect of metal ions and by quartz-crystal microbalance system for monitoring layer-by-layer film formation[J].J Cosmet Sci,2004,55(2):163-176.
[3]Navazesh M.Methods for collecting saliva[J].Ann NY Acad Sci,1993,694(1):72 -77.
[4]Kruger NJ.The Bradford method for protein quantitation [J].Methods Mol Biol,1994,32(2):9 -15.
[5]Yao JW,Lin CJ,Chen GY,et al.The interactions of epigallocatechin-3-gallate with human whole saliva and parotid saliva[J].Arch Oral Biol,2010,55(7):470 -478.
[6]Yao JW,Lin F,Tao T,et al.Affinity interactions between natural pigments and human whole saliva [J].Arch Oral Biol,2011,56(3):285-293.
[7]Chitpan M,Wang X,Ho C,et al.Monitoring the binding processes of black tea thearubigin to the bovine serum albumin surface using quartz crystal microbalance with dissipation monitoring[J].J Agric Food Chem,2007,55(25):10110-10116.
[8]罗宗莲,黄定明,杨继虞,等.不同龋敏感人群唾液蛋白的研究[J].牙体牙髓牙周病学杂志,1995,5(2):69-70.
[9]Lindh L,Svendsen IE,Svensson O,et al.The salivary mucin MUC5B and lactoperoxidase can be used for layer-by-layer film formation[J].J Colloid Interface Sci,2007,310(1):74-82.

