慢性牙周炎病人基础治疗前后Th17型细胞因子及RORC的表达变化
周 艳,徐 艳
(1.市口腔医院,江苏南通 226001;2.南京医科大学口腔医学研究所,江苏南京 210029;3.南京医科大学附属口腔医院牙周科,江苏南京 210029)
在牙周炎病变过程中,牙周支持组织的丧失一方面是由于致病菌产生的酶和毒素造成的直接损害,另一方面是过度的宿主免疫反应造成继发性损伤。病原微生物作用于牙周组织单核巨噬细胞,可分泌出多种细胞因子,这些细胞因子与牙槽骨破坏吸收有着密切关系,其中 IL-1、IL-4、IL-6、IL-8、IL-11、TNF-α、HGF等细胞因子在牙周炎病变中的作用已经被广泛研究与证实[1-2]。Th17型细胞因子是一类新近发现的前炎症因子功能家族,包括IL-17、IL-21、IL-22等,以往的研究已证实,这些细胞因子在类风湿性关节炎、系统性红斑狼疮、炎症性肠病等炎症和自身免疫性疾病中,起到关键和重要的致病作用[3-7],但在CP的炎性免疫反应中的研究尚未深入。本实验通过检测CP病人牙周基础治疗前后龈沟液中Th17型细胞因子(IL-17、IL-21)的浓度变化,以及外周血CD4+T细胞中Th17的特异性转录因子RORC的表达水平,以期探讨Th17型细胞因子在CP发生发展中的作用。
1 材料和方法
1.1 临床资料
2008-10—2009-03从南通市口腔医院牙周科诊断为牙周炎的病人中选择受试者30例,其中男性19例,女性11例,年龄30~61岁,每例病人均选择1个第一磨牙作为研究牙(个别第一磨牙不符合纳入标准者用相邻的第二磨牙代替)。所有受试者均知情同意。纳入标准:①身体健康,无全身性疾病;②无吸烟史;③口内余留牙不少于20个;④过去6个月内无牙周治疗史;⑤过去3个月内无抗生素、非甾体类抗炎药及免疫抑制剂应用史;⑥妇女未妊娠。研究牙纳入标准:①无牙髓及根尖周病变;②无咬合创伤;③无不良修复体;④无Ⅱ度以上根分叉病变;⑤3 mm≤牙周探诊深度(PD)≤8 mm。
1.2 临床指标检查和基础治疗
采用Löe和Silness法检查研究牙位的菌斑指数(PLI)、牙龈指数(GI)、探诊深度(PD)和临床附着水平(CAL)等牙周临床指标。然后根据牙周基础治疗计划接受详细的口腔卫生指导、全口龈上洁治、龈下刮治和根面平整。治疗结束后6周复查,再次并作牙周临床指标检查。
1.3 龈沟液中Th17型细胞因子浓度检测
分别于基础治疗前和治疗后6周,早餐后2~3 h,采集所有病人研究牙的龈沟液。研究牙以棉卷隔湿,轻吹牙龈 1 min后,将消毒的滤纸条(2 mm×20 mm)轻轻插入龈沟或牙周袋内,遇阻力即止,停留30 s取出(如被血污染则弃除),用Sartorius BS124S分析天平(误差d=0.0001 g)称重,按比重为1换算成体积。称重后样本立即放入200 μL磷酸盐缓冲液(PBS)中,采用酶联免疫吸附试验(ELISA)法检测龈沟液中的IL-17、IL-21,操作按R&D的Human ELISA Kit说明书进行。
1.4 外周血CD4+T细胞中转录因子RORC表达水平检测
分别于基础治疗前和治疗后6周采集所有病人外周血,以密度梯度离心法进行单核细胞分离;吸取单核细胞层,根据MACS CD4+T MicroBeads(Militenyi Biotec公司)操作说明,对外周血CD4+T细胞进行免疫磁珠分选;采用试剂盒(Rneasy Mini Kit,Qiagen公司)进行RNA的抽提及逆转录合成cDNA;采用荧光定量PCR法检测外周血CD4+T细胞中转录因子RORC表达水平。
1.5 统计学分析
采用SPSS 11.5统计软件进行统计分析,牙周基础治疗前后龈沟液中细胞因子水平及外周血转录因子水平比较用配对t检验,检验水准α=0.05。
2 结果
2.1 基础治疗前后牙周临床指标的变化
基础治疗后,所有牙周临床指标(PLI、GI、PD、AL)均较治疗前显著下降,差异有统计学意义(P<0.05),表明牙周临床症状明显改善(表1)。
表1 牙周基础治疗前后各临床指标比较()
*与治疗前相比P<0.05
PLI GI PD CAL组别 牙数治疗前30 2.66 ±0.37 1.98 ±0.08 4.73 ±0.84 5.73 ±1.47治疗后 30 0.43 ±0.24*0.51 ±0.27*3.25 ±0.67*4.52 ±1.17*
2.2 牙周基础治疗前后龈沟液中Th17型细胞因子(IL-17、IL-21)水平变化
牙周基础治疗后龈沟液中IL-17和IL-21水平均较治疗前显著下降(P<0.05),其中IL-17从治疗前的(63.4731±19.4746)ng/mL降至(40.0069±10.9361)ng/mL。IL-21 从治疗前的(80.4143 ± 39.4763)ng/mL 降 至 (31.6151 ±13.1908)ng/mL(图1)。
2.3 牙周基础治疗前后外周血CD4+T细胞中转录因子表达变化
利用MACS免疫磁珠分选技术将CD4+T细胞分选出后,抽提RNA逆转录合成cDNA,再行Realtime PCR,发现基础治疗后外周血CD4+T中Th17特异性转录因子RORC表达水平从治疗前的0.7099±0.1455下降至 0.3661 ± 0.1308,两者相比差异有统计学意义(P<0.05)(图2)。
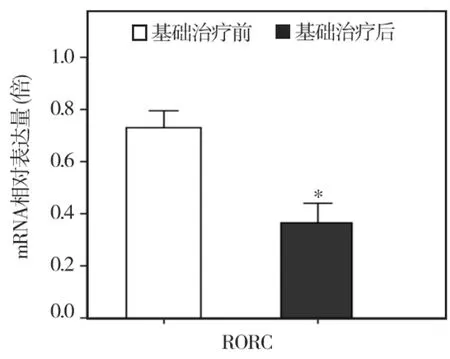
图2 牙周基础治疗前后外周血CD4+T细胞中转录因子RORC的表达的比较(*与治疗前相比P<0.05)
3 讨论
机体的免疫防御系统在牙周炎的发生发展中起着重要作用,在过去的二十年中,一直运用Th1/Th2理论体系来解释牙周炎的免疫学机制,然而Th1/Th2在慢性牙周炎发病机制中谁占主导地位一直存在争论[8-9],直到Th17型细胞因子的发现和确立,才补充了牙周炎发病机制中缺失的重要一环。Thl7型细胞因子包括 IL-17、IL-21、IL-22、IL-6、TNF-α等,是一类新近发现的前炎症因子功能家族,其中IL-17是Th17型细胞因子中的一个最关键的促炎症性细胞因子[10],具有强大的招募中性粒细胞的作用,调节并促进多种炎性介质的产生,参与机体多种炎性疾病,与感染、肿瘤、过敏、移植及自身免疫性疾病均有密切关系[11-12]。
IL-17受体(IL-17R)属于I型跨膜蛋白,分布广泛,几乎所有类型的细胞均有表达。IL-17具有强大的致炎性,作用十分广泛。大量实验证据表明,IL-17在局部组织炎症中的作用主要通过诱导细胞释放前炎症因子及动员中性粒细胞的细胞因子而发挥作用[13]。而且,它还可引起中性粒细胞蛋白酶和髓过氧化物酶等蛋白水解酶活性增高,提高CXC趋化因子等细胞因子的表达,进一步促进中性粒细胞的聚集。IL-21作为Th17细胞的一种自分泌调节因子,在诱导Th17细胞分化、抑制Th1、Treg功能方面发挥关键作用。
尽管以IL-17为代表的Th17型细胞因子在牙周疾病免疫机制中作用的研究刚刚开始,仍然不断有增加的证据支持Th17型细胞因子在慢性牙周炎发生发展中发挥着重要作用。如 Cardoso等[14]在慢性牙周炎牙周组织内发现有Th17细胞的浸润。Johnson等[15]研究发现,在治疗前,慢性牙周炎病人龈沟液中IL-17的水平较正常人明显上升。Oda等[16]实验证实,慢性牙周炎的主要致病菌牙龈卟啉单胞菌能够促进CD4+T细胞分泌IL-17,从而诱导CD4+T细胞向Th17细胞分化。本实验通过对CP病人牙周基础治疗前后龈沟液中Th17型细胞因子(IL-17、IL-21)浓度变化的研究发现,炎症牙位治疗后的龈沟液中Th17型细胞因子(IL-17、IL-21)浓度较治疗前明显下降,此结果与上述学者的研究结论一致。
Th17的分化前体细胞为初始CD4+T祖细胞——ThP细胞,ThP细胞在特定环境中向不同细胞亚群分化,转录因子在CD4+T辅助细胞的分化过程中发挥着关键的作用,RORC为Th17细胞分化的特异性转录因子。为了进一步阐明Th17型细胞因子在CP病人治疗前后的变化规律,我们利用Real-time PCR检测该实验中CP病人外周血CD4+T细胞中 RORC转录水平的变化,发现RORC在牙周基础治疗前后表达水平发生了显著下降,这与龈沟液中 Th17型细胞因子(IL-17、IL-21)在治疗前后的变化相一致。
牙周基础治疗是对每个牙周炎病人都适用的最基本的治疗方法[17],也是最有效的治疗方法。经基础治疗后6周复查,所有研究牙位的牙周临床指数(PLI、GI、PD、CAL)均较治疗前显著下降,表明牙周临床症状明显改善。本研究采用CP病人牙周基础治疗前后的牙位作为研究对象,排除了全身免疫因素的影响,同一牙位治疗前后龈沟液中IL-17浓度的显著下降有力的支持了IL-17在牙周组织炎症中的作用[15]。
本结果表明:慢性牙周炎病人龈沟液中Th17型细胞因子IL-17、IL-21在炎症期水平上调,在治疗后随着牙周临床指标显著好转,炎症明显消退,浓度水平显著下降;慢性牙周炎外周血CD4+T细胞中Th17转录因子RORC在基础治疗后呈现下降趋势,这与慢性牙周炎病人龈沟液中Th17型细胞因子(IL-17、IL-21)在牙周基础治疗前后的变化相一致。提示Th17型细胞因子具有重要的致炎作用,并参与了慢性牙周炎病变的发生发展。
[1]张小恒,张国英.龈沟液中与牙周病有关的细胞因子的研究进展[J].国际口腔医学杂志,2008,35(1):19-21.
[2]陈智滨,孙晓军,寇传哲,等.龈沟液微量样本中多种成分的检测[J].北京大学学报(医学版),2008,40(1):57-59.
[3]Hashimoto T,Akiyama L,Kobayashi N,et al.Comparison of IL-17 production by helper T cells among atopic and nonatopic asthmatics and control subjects.Int Arch Allergy Immunol,2005,137(Suppl.1):51-54.
[4]Maini RN,Taylor PC,Szechinski J,et al.Double-blind randomized controlled clinical trial of the interleukin-6 receptor antagonist,tocilizumab,in European patients with rheumatoid arthritis who had an incomplete response to methotrexate[J].Arthritis Rheum,2006,54(9):28l7-2829.
[5]Wong CK,Ho CY,Li EK,et al.Elevation of proinflammatory cytokine(IL-18,IL-I7,IL-12)and Th2 cytokine(IL-4)concentrations in patients with systemic lupus erythematosus[J].Lupus,2000,9(8):589-593.
[6]Matusevicius D,Kivisakk P,He B,et al.Interleukin-17 mRNA expression in blood and CSF mononuclear cells is augmented in multiple sclerosis[J].Mult Scler,1999,5(2):101-104.
[7]Linden A,Hoshino H,Laan M.Airway neutrophils and interleukin-17[J].Eur Respir J,2000,15(5):973-977.
[8]Bartova J,Kratka-Opatrna Z,Prochazkova J,et al.Th1 and Th2 cytokine profile in patients with early onset periodontitis and their healthy siblings[J].Mediators Inflamm,2000,9(2):115-120.
[9]Lappin DF,MacLeod CP,Kerr A,et al.Antiinflammatory cytokine IL-10 and T cell cytokine profile in periodontitis granulation tissue[J].Clin Exp Immunol,2001,123(2):294-300.
[10]Gaffen SL,Kramer JM,Yu JJ,et al.The IL-17 cytokine family[J].Vitam Horm,2006,74:255-282.
[11]Matsuzaki G,Umemura M.Interleukin-17 as an effector molecule of innate and acquired immunity against infections[J].Microbiol Immunol,2007,51(12):1139-1147.
[12]Yu JJ,Gaffen SL.Interleukin-17:a novel inflammatory cytokine that bridges innate and adaptive immunity[J].Front Biosci,2008,13:170-177.
[13]Christopher MJ,Link DC.Regulation of neutrophil homeostasis[J].Curr Opin Hematol,2007,14(1):3-8.
[14]Cardoso CR,Garlet GP,Crippa GE,et al.Evidence of the presence of T helper type 17 cells in chronic lesions of human periodontal disease[J].Oral Microbiol Immunol,2009,24(1):1-6.
[15]Johnson RB,Wood N,Serio FG.Interleukin-11 and IL-17 and the pathogenesis of periodontal disease[J].J Periodontol,2004,75(1):37-43.
[16]Oda T,Yoshie H,Yamazaki K.Porphyromonas gingivalis antigen preferentially stimulates T cells to express IL-17 but not receptor activator of NF-kappaB ligand in vitro[J].Oral Microbiol Immunol,2003,18(1):30-36.
[17]曹采方.牙周病学[M].2版.北京:人民卫生出版社,2003:165.

