Ras基因蛋白的表达及基因突变与皮肤病理性瘢痕和瘢痕癌的相关性
郭瑞珍,王海青,胡成久,边 可
(遵义医学院珠海校区 病理学教研室,广东 珠海 519041)
·临床医学研究·
Ras基因蛋白的表达及基因突变与皮肤病理性瘢痕和瘢痕癌的相关性
郭瑞珍,王海青,胡成久,边 可
(遵义医学院珠海校区 病理学教研室,广东 珠海 519041)
目的探讨Ras基因家族(K-ras、H-ras、N-ras)蛋白的表达和基因突变与病理性瘢痕上皮癌变和瘢痕癌发生的相关性。方法用激光扫描共聚焦显微技术检测皮肤病理性瘢痕和瘢痕癌组织中K-ras、H-ras、N-ras免疫荧光蛋白表达;免疫组织化学技术(SP)法检测正常皮肤、病理性瘢痕和瘢痕癌组织中K-ras、H-ras、N-ras蛋白的表达;从病理性瘢痕和瘢痕癌组织中提取DNA,分析K-ras、H-ras、N-ras基因第12、13 位密码子突变情况。所有数据运用SPSS16.0软件包进行统计学分析。结果①K-ras、H-ras、N-ras3种蛋白在病理性瘢痕上皮中呈现较弱荧光,为弱阳性表达,在瘢痕癌组织中呈现较强荧光,为强阳性表达。②3种蛋白在正常皮肤表皮、病理性瘢痕上皮和瘢痕癌组织中分别呈阴性或弱阳性、弱阳性或阳性和强阳性表达。瘢痕癌组表达水平(阳性面积)、表达强度(平均光密度)与正常皮肤、病理性瘢痕组比较,差异均有统计学意义(P﹤0.01;P﹤0.05);但正常皮肤组与病理性瘢痕组比较,差异无统计学意义(P﹥0.05)。③病理性瘢痕和瘢痕癌中均未发现K-ras、H-ras、N-ras基因12、13位密码子突变。结论①瘢痕癌的发生与K-ras、H-ras、N-ras蛋白的高表达有相关性;②病理性瘢痕上皮和瘢痕癌组织中不存在K-ras、H-ras、N-ras基因12、13位密码子突变。③病理性瘢痕上皮中没有发现癌变早期信号。
病理性瘢痕;瘢痕癌;Ras基因;突变;癌变
皮肤病理性瘢痕是一种癌前病变,病理性瘢痕被覆上皮癌变而形成的癌称之为瘢痕癌。由于至今未能成功复制病理性瘢痕和瘢痕癌的动物模型提供研究,致使目前与瘢痕癌的发生和瘢痕上皮癌变的相关性研究极少有报道。Ras基因是较早被鉴定的人类癌基因之一,其基因家族包含H-ras、N-ras、K-ras 3种功能性基因,研究认为,Ras基因的异常高表达和基因突变与多种人类恶性肿瘤的发生、发展密切相关【1,2】,而且,Ras基因的异常高表达和基因突变,可出现在许多癌前病变中,认为可用检测Ras癌基因的方法对癌变倾向提供较早信息【3】。本组从蛋白水平、基因突变的水平,对比分析Ras基因与瘢痕癌的发生和病理性瘢痕癌变的相关性,其研究结果及意义如下。
1 材料与方法
1.1 材料 检测组织均为10%中性福尔马林固定,石蜡包埋,HE染色,光镜观察确诊。标本源于遵义医学院第一附属医院和第五附属医院病理科。正常皮肤取自临床手术切除的带有正常皮肤组织的病变标本;病理性瘢痕病例临床有皮肤烧伤、烫伤或机械性创伤等损伤史,有瘢痕形成时间记载的13例,分别为5个月、3年、58年和60年各1例,10年3例,20年4例,30年2例。病变部位有胸部、大腿、小腿等处;瘢痕癌病例临床有瘢痕形成史,有癌变时间记载的5个病例,分别于瘢痕形成后21年、18年、18年、12年和10年发生癌变。病变部位有头面部、上肢、下肢等处。组织学类型均为鳞状细胞癌。
1.2 主要实验试剂
1.2.1 荧光免疫试剂 鼠抗人H-ras多克隆抗体,购自美国SANTA公司;兔抗人N-ras、K-ras多克隆抗体购自武汉博士德公司;羊抗兔FITC抗体、羊抗鼠Cy3抗体购自北京中衫金桥公司。
1.2.2 免疫组织化学试剂 兔抗人K-Ras 、H-Ras 、N-Ras多克隆抗体,购自武汉博士德公司。
1.2.3 基因突变检测主要试剂 AxyPrep基因组DNA提取试剂盒由上海百赛公司提供; PCR反应试剂盒由北京天根公司提供;引物设计和引物序列参照文献进行【4】,由上海生物工程公司合成。
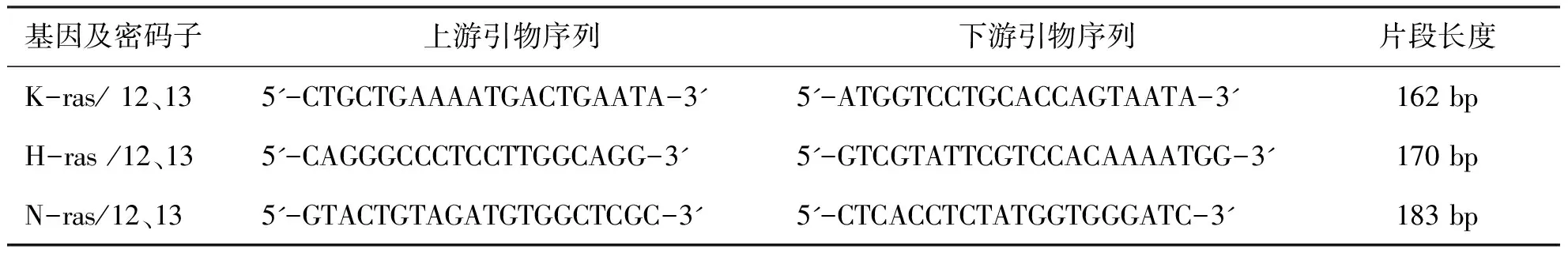
表1 H-ras、 N-ras 和K-ras基因第12、13位密码子引物序列及扩增片段
1.3 实验方法及步骤
1.3.1 组织切片 福尔马林固定,石蜡包埋标本,连续切片4张(4μm厚),捞片于防脱片上,60℃烤干,4℃保存备用。
1.3.2 激光扫描共聚焦显微技术 抗体搭配及要求:免疫荧光双标染色,所用一抗有K-Ras(兔抗人)、H-Ras(鼠抗人)、N-Ras(兔抗人);二抗有Cy3(羊抗兔、波长570nm)、FITC(羊抗鼠)、波长468nm)。双标抗体搭配 :K-Ras(二抗:Cy3)/ H-Ras(二抗:FITC)、N-Ras(二抗:Cy3)/ H-Ras(二抗:FITC),实验步骤:石蜡切片常规脱腊至水,微波抗原修复;操作步骤按试剂盒说明书进行,用抗淬灭的荧光封片剂封片,激光共聚焦显微镜扫描并合成图片。
1.3.3 免疫组织化学技术(SP法) 用结肠癌组织切片作阳性对照,用PBS代替一抗作空白对照。切片经脱腊、流水冲洗,微波修复抗原,按试剂盒说明书进行操作,DAB显色后,经复染、透明、封片,光镜观察。
1.3.4 基因突变检测技术 对28个病例(病理性瘢痕和瘢痕癌各14例)按AxyPrep基因组DNA提取试剂盒说明书进行DNA提取;PCR扩增序列片段长度:K-ras序列为162 bp,H-ras序列为170 bp,N-ras序列为183 bp。测序:扩增产物送上海生工公司 双向测序。
1.4 实验结果的判断
1.4.1 激光共聚焦显微技术结果判定标准 免疫荧光双标的石蜡切片,在倒置Leica荧光显微镜通过绿色、红色通道可以观察到阳性的荧光信号判断为实验成功,阳性荧光信号定位于细胞质或细胞膜。其中绿色荧光信号代表FITC标记的阳性信号;红色荧光信号代表Cy3标记的阳性信号;两种阳性荧光信号叠加呈现黄色。经激光共聚焦显微镜扫描并拍照,合成后获得三维立体结构图像。
1.4.2 免疫组织化学实验结果判定标准 3种蛋白均以细胞质出现棕黄色颗粒为阳性细胞。采用半定量积分法,根据阳性细胞百分数和染色强度计分的乘积分为4个等级,<2分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),>6分为强阳性(+++),≥6分为高表达,<6分为低表达,<2分为阴性。运用CCD成像系统,每张切片随机选取5个高倍视野,应用显微图像分析系统分别检测阳性染色的表达水平(即阳性面积代数和与分析区域面积的比值,值越大,阳性表达水平越高)和表达强度(即平均光密度值,值越大,阳性表达强度越高),各取平均值,最后进行统计学分析。
1.4.3 PCR扩增结果判断与检测 PCR扩增观察到162bp的K-ras、170bp的H-ras和183bp的N-ras的单一条带表明扩增成功。 扩增产物送上海生工公司测序,用Chromas软件分析DNA测序图谱,并运用Geneious软件与其正常基因序列进行比对,查找突变位点。
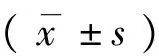
2 结果
2.1 激光扫描共聚焦显微技术双标记结果 在倒置Leica荧光显微镜下,通过绿色、红色通道可见,FITC标记的H-Ras蛋白的阳性信号为绿色荧光; Cy3标记的K-Ras、N-Ras蛋白的阳性信号为红色荧光;两种荧光信号重叠部位呈黄色,阳性信号定位于细胞质和细胞膜。其中病理性瘢痕上皮中阳性荧光信号较弱,呈弱表达,瘢痕癌组织中阳性荧光信号较强,呈强表达(见图1,图2)。

注:A 病理性瘢痕上皮中H-ras呈现较弱绿色荧光;K-ras呈现较弱红色荧光;共同表达的部位呈黄色荧光。B 瘢痕癌组织中H-ras 呈现较强绿色荧光;K-ras呈现较强红色荧光;共同表达的部位呈黄色荧光。图1 病理性瘢痕上皮和瘢痕癌组织中H-ras /K-ras双标记免疫荧光(×400)
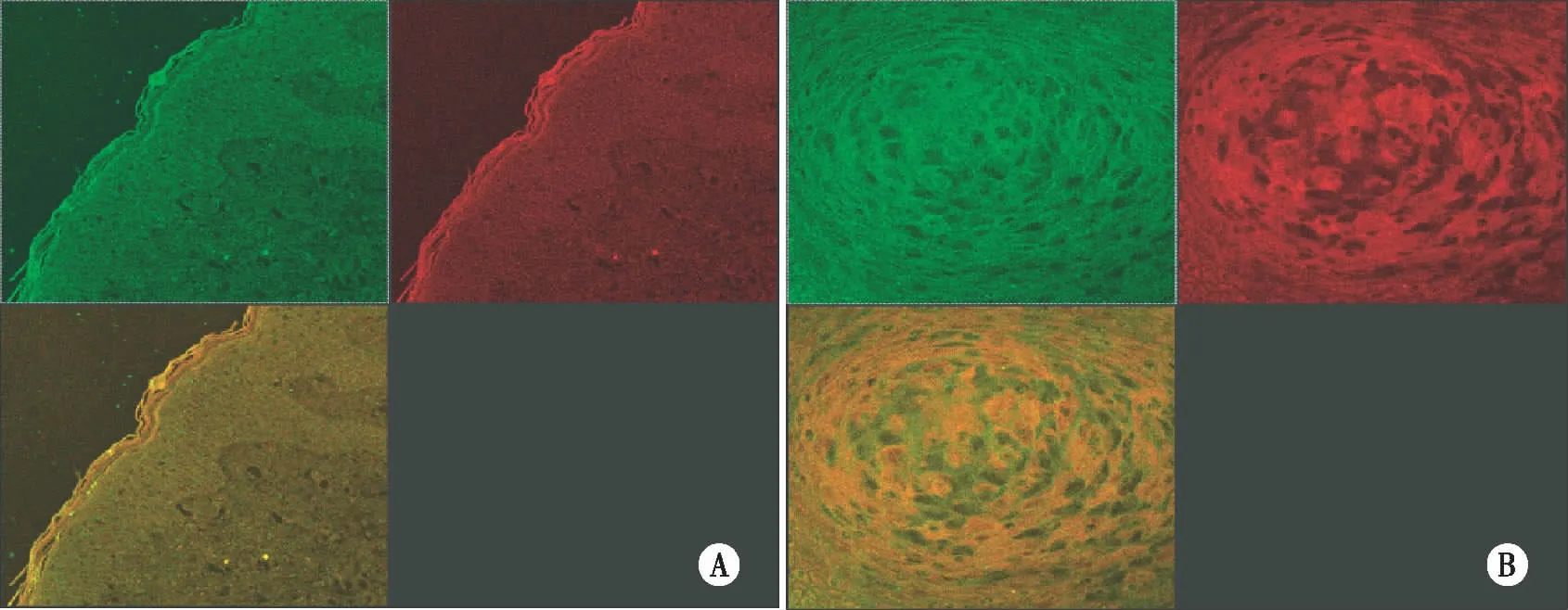
注:A 病理性瘢痕上皮中H-ras呈现较弱绿色荧光;N-ras呈现较弱红色荧光;共同表达的部位呈黄色荧光。B 瘢痕癌组织中H-ras呈现较强绿色荧光;N-ras呈现较强红色荧光;共同表达的部位呈黄色荧光。图2 病理性瘢痕上皮和瘢痕癌组织中H-ras/N-ras双标记免疫荧光(×400)
2.2 免疫组织化学标记结果的表达 H-ras、N-ras、K-ras 3种蛋白阳性表达信号呈棕黄色、颗粒状,主要定位于细胞质或细胞膜。在正常皮肤表皮中呈阴性或弱阳性表达,弱阳性表达细胞数量较少,见于基底细胞层,不见于颗粒层和棘细胞层;在瘢痕上皮中呈弱阳性或阳性表达,阳性表达细胞数较正常皮肤表皮增多,见于基底细胞层、颗粒层和棘细胞层;在瘢痕癌中呈强阳性表达(见图3~图5)。其表达水平(阳性面积)、表达强度(平均光密度)在正常皮肤、皮肤瘢痕和瘢痕癌之间有差异(H-rasFPA=22.807,PPA﹤0.001;FOD=20.808,POD﹤0.001,),(N-rasFPA=10.220,PPA﹤0.001;FOD=6.698,POD=0.003),(K-rasFPA=10.295,PPA﹤0.001;FOD=3.506,POD=0.039),瘢痕癌组分别与正常皮肤组和瘢痕组比较,差异均有统计学意义(P﹤0.01;P﹤0.05),但正常皮肤组与瘢痕组比较,差异无统计学意义(P﹥0.05),(见表2)。
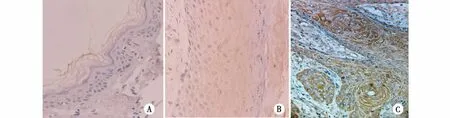
注:A 正常皮肤表皮中呈阴性;B 病理性瘢痕上皮中呈弱阳性表达 ;C瘢痕癌组织中中呈强阳性表达。图3 正常皮肤表皮、病理性瘢痕上皮和瘢痕癌组织中H-ras蛋白的表达(IHC ×400)
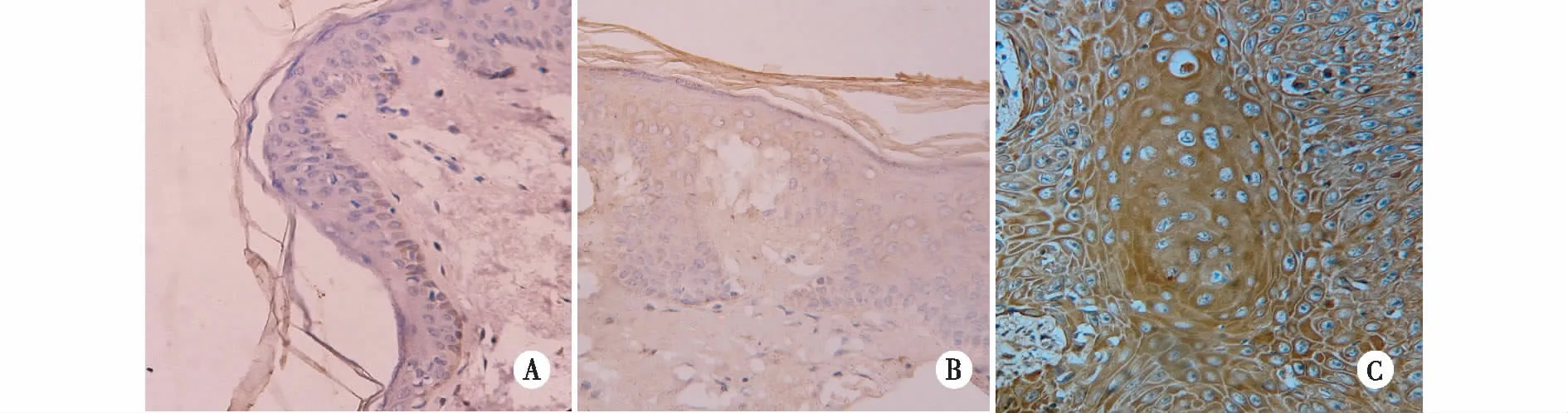
注:A 正常皮肤表皮中呈阴性表达;B在皮肤瘢痕上皮中呈弱阳性表达;C在皮肤瘢痕癌中呈强阳性表达。图4 正常皮肤表皮、病理性瘢痕上皮和瘢痕癌组织中N-ras蛋白的表达(IHC×400)
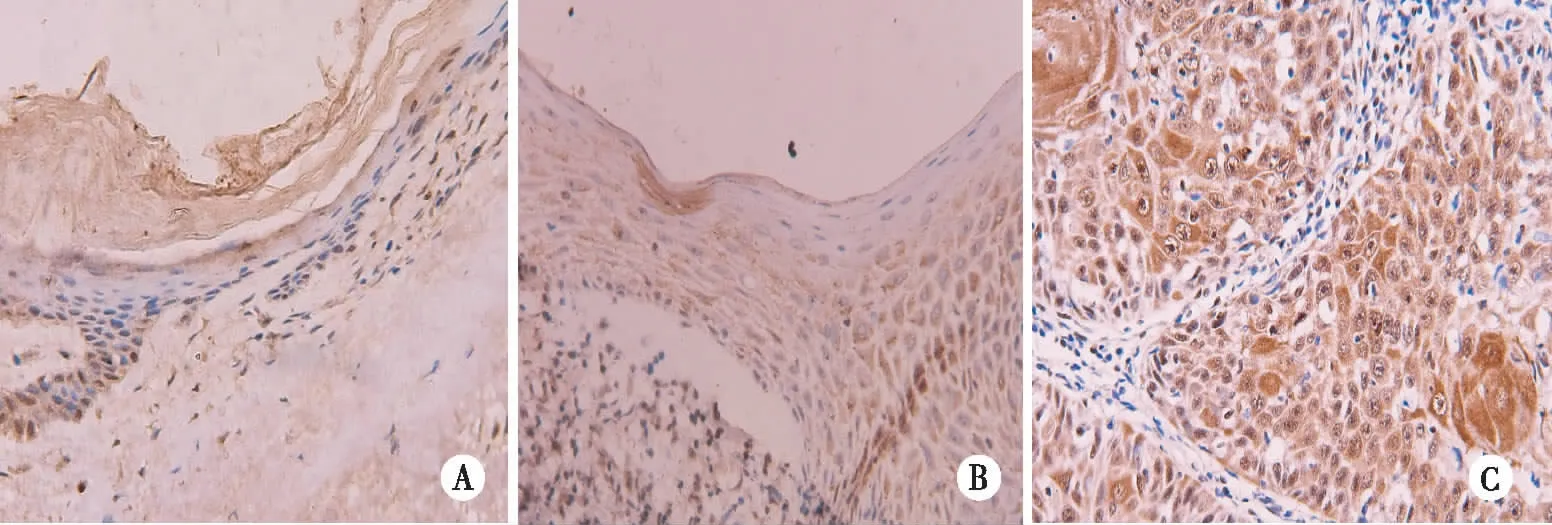
注:A 正常皮肤表皮中呈弱阳性表达;B皮肤瘢痕上皮中呈弱阳性表达;C皮肤瘢痕癌中呈强阳性表达。图5 正常皮肤表皮、病理性瘢痕上皮和瘢痕癌组织中K-ras蛋白的表达(IHC×400)
表2 H-ras、N-ras、K-ras蛋白在各组组织中的表达
注:PA代表阳性面积代数和/分析区域面积的比值;OD代表平均光密度。与正常皮肤和瘢痕组比,*P<0.05;**P<0.01。
2.3 基因突变检测结果 扩增、测序结果28个样本(病理性瘢痕和瘢痕癌各14例)均成功扩增出K-ras(162bp)、H-ras(170bp)和N-ras(183bp)的基因片段,凝胶电泳均显示为单一条带(见图6)。PCR扩增产物测序均未检测出K-ras、H-ras和N-ras基因第12、13位密码子突变。
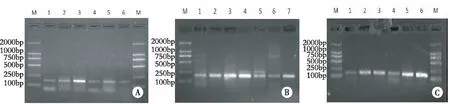
注:M为DNA marker;A H-ras基因,1为瘢痕,2、3、4、5、6为瘢痕癌;B N-ras基因,1、2为瘢痕,3、4、5、6、7为瘢痕癌;C K-ras基因,1、2为瘢痕,3、4、5、6为瘢痕癌。图6 H-ras、N-ras、K-ras 基因电泳结果
2.4 瘢痕癌中3种蛋白表达的相关性 瘢痕癌中H-ras、N-ras、K-ras蛋白阳性率分别为70%、70%、85%,经相关性分析,H-ras与K-ras表达无相关性(r=0.031,P=1.000), K-ras与N-ras表达无相关性(r=0.336,P=0.202),H-ras与N-ras表达无相关性(r=0.286,P=0.303)。
3 讨论
3.1 瘢痕癌中Ras蛋白的表达及意义 自Ras基因发现以来,其与皮肤肿瘤的研究包括有皮肤基底细胞癌、鳞状细胞癌和黑色素瘤等,Platz 等【5】研究30例转移性黑色素瘤,发现23例(76.7%)存在N-ras蛋白的高表达,研究者们认为Ras的高表达可能与皮肤恶性黑色素瘤的发生、发展有关。Kikuchi等【6】应用免疫组织化学方法研究了皮肤基底细胞癌、鳞状细胞癌,发现Ras的表达与肿瘤分化程度相一致,认为Ras的表达与肿瘤的分化有相关性。Tanikawa等【7】也报道,RAS蛋白在脂溢性角化病和Bowen病中分别呈阴性和阳性表达,在恶性黑色素瘤中呈强阳性表达。本组用免疫组织化学和激光扫描共聚焦显微技术两种不同的方法,检测了RAS 基因家族3种蛋白在瘢痕癌中的表达,结果显示3种蛋白在瘢痕癌组织中均呈强阳性、高表达,其表达水平、表达强度明显高于正常皮肤表皮和瘢痕上皮(P﹤0.05),提示三种蛋白的高表达与瘢痕癌的发生有密切相关性。经相关性分析,H-ras、N-ras、K-ras蛋白之间两两比较均无相关性(P﹥0.05),提示在瘢痕癌的形成过程中,Ras基因家族的3种蛋白可能发挥了协同作用。作用机制可能系原癌基因Ras被激活后变成有致癌活性的癌基因,通过Raf/MEK/ERK途径促使细胞从G1期进入S期,通过PI3K/PTEN/Akt介导抗凋亡,从而促进细胞增殖和癌变,介导肿瘤的发生【4.8】。
3.2 瘢痕癌中Ras 基因的突变及意义 Ras基因点突变在人类恶性肿瘤中约占30%,K-ras、N-ras、H-ras的点突变率分别为85%、15%和﹤1%【9.10】;12、13、61位密码子为常见的突变位点,尤以第12位密码子突变最常见,多为GGT突变成GTT【11】。Shields等【12】报道在胰腺癌中K-ras基因第12位密码子突变率高达95%,认为该密码子突变是胰腺癌的早期事件,是早期基因诊断胰腺癌的有效方法。还有报道,H-ras基因第12位密码子的突变与膀胱癌的发生、发展有相关性,突变率为46.7%。K-ras基因突变与异位的子宫内膜上皮恶变可能有相关性。在人体皮肤肿瘤的研究中,Ras基因的总突变率在10~20%左右【13】,其中N-ras突变率为16%~22%,而K-ras和H-ras的突变率分别为2%、1%【14】。这些研究结果提示,人类皮肤肿瘤中Ras基因突变率比其它上皮性肿瘤突变率似乎较低。本组检测的14例瘢痕癌组织,未发现12、13位密码子的突变。提示 Ras基因家族蛋白的激活可能还有其它方式,或者突变于其它位点,有待进一步探讨。
3.3 Ras蛋白的表达及基因突变与病理性瘢痕癌变的相关性 病理性瘢痕属于一种癌前病变。癌前病变发生癌变的潜伏期长短难以判断,癌变的不可预见性很大。一旦发生癌变而成为瘢痕癌,可能对患者造成严重的后果。如何早期发现病理性瘢痕的发展趋势,这是一个值得重视和探索的问题。近年来,皮肤肿瘤的发生率有逐年上升趋势,这其中不排除某些皮肤肿瘤的发生是从癌前病变开始慢慢演化而成的。Braut等【15】认为,Ras基因的异常表达是癌变过程中较早出现的分子改变,与肿瘤的启动及癌变程度密切相关,对癌症的早期发现具有重要意义。Nindl【16】等报道在光化性角化病(AK)中有H-ras和P53基因突变,Zaravinos【17】等在同样的病变中发现有H-ras的12位密码子第2碱基G>T置换。研究者认为在非肿瘤性病变进展恶变的过程中,基因突变可能是一个早期事件。本组采用两种不同的检测手段,均显示3中蛋白在病理性瘢痕上皮组织中呈现低表达,其表达水平、表达强度明显低于瘢痕癌,与正常皮肤表皮比较没有统计学意义,提示在本组研究的病理性瘢痕组织中没有Ras基因三种蛋白的异常表达。同样,对14例瘢痕组织进行基因突变检测,没有发现12、13位密码子有突变。
综上所述,本研究结果认为:Ras基因家族中的3种蛋白在瘢痕癌中呈现高表达,与瘢痕癌的发生有相关性;在病理性瘢痕和瘢痕癌中未发现12、13位密码子突变;病理性瘢痕上皮中3种蛋白的表达与正常皮肤表皮的表达没有统计学意义。后两个结果均提示,病理性瘢痕上皮中没有癌变早期信号,这不同于他人的研究,这与受检标本量有关?与RAS基因在不同来源肿瘤组织中的激活形式和突变位点有特异性?还是瘢痕和瘢痕癌中可能根本不存在基因突变?这些都留给我们更多的思考,有待进一步深入探讨。
【1】 Barauit L,Veyrie N,Jooste V,et al.Mutations in the RAS-MAPK,PI3K signaling network correlate with poor survival in a population- based series of colon cancers【J】.Int J cancer,2008,122(10):2255-2259.
【2】 Schubbert S,Shannon K,Bollag G.Hyperactive Ras in developmental disorders and cancer【J】.Nature,2007,7(4):295-308.
【3】 Ochi K,Hasuoka H,Mizushima T,et al.A case of small pancreatic cancer diagnosed by serial follow-up studies promptly by a positive K-ras point mutation in pure pancreatic juice【J】.Am J Gastroenterol,1998,93(8):1366-1368.
【4】 Stites E C,Ravichandran K S.A systems perspective of ras signaling in cancer【J】.Clin Cancer Res,2009,15(5):1510-1513.
【5】 Platz A,Jungnelius U,Grafstrǒm E,et al.Glutathione transferase P1-1 expression in human melanoma metastases:correlation to N-RAS mutations and expression【J】.Acta Oncol,1995,34(6):759-765.
【6】 Kikuchi A,Amagai M,Hayakawa K,et al.Association of EGF receptor expression with proliferating cells and of ras p21 expression with differentiating cells in various skin tumours【J】.Br J Dermatol,1990,123(1):49-58.
【7】 Tanikawa E,Mori O,Hachisuka H,et al.Expression of ras proto-oncogene related protein p21 in normal human skin and cutaneous tumours【J】.Acta Histochem,1992,93(1):282-289.
【8】 Song G,Ouyang G,Bao S.The activation of Akt/PKB signaling pathway and cell survival【J】.J Cell Mol Med,2005,9(1):59-71.
【9】 Karnoub A E,Weinberg R A.Ras oncogenes:split personalities【J】.Nat Rev Mol Cell Biol,2008,9(7):517-531.
【10】 Diaz-Flores E,Shannon K.Targeting oncogenic Ras【J】.Genes Dev,2007,21(16):1989-1992.
【11】 Yu S H,Wang T H,Au L C.Specific repression of mutant K-RAS by 10-23 DNAzyme:Sensitizing cancer cell to anti-cancer therapies【J】.Biochemical and Biophysical Research Communications,2009,378(2):230-234.
【12】 Shields D J,Murphy E A,Desgrosellier J S,et al.Oncogenic Ras/Src cooperativity in pancreatic neoplasia【J】.ncogene,2011,30(18):2123-2134.
【13】 Boukamp P.Non-melanoma skin cancer:what drives tumor development and progression【J】.Carcinogenesis,2005,26(10):1657-1667.
【14】 Milagre C,Dhomen N,Geyer FC,et al.A mouse model of melanoma driven by oncogenic KRAS【J】.Cancer Res,2010,70(13):5549-5557.
【15】 Braut T,Krstulja M,Kujundzic M,et al.epidermal growth factor receptor protein expression and gene amplification in normal,hyperplastic,and cancerous glottis tissue:immunohistochemical and fluorescent in situ hybridization study on tissue microarrays【J】.Croat Med J,2009,(50):488-497.
【16】 Nindl I,Gottschling M,Krawtchenko N,et al.Low prevalence of p53,p16(INK4a) and Ha-ras tumour-specific mutations in low-graded actinic keratosis【J】.Br J Dermatol,2007,156(3):34-39.
【17】 Zaravinos A,Kanellou P,Spandidos D A.Viral DNA detection and RAS mutations in actinic keratosis and nonmelanoma skin cancers【J】.Br J Dermatol,2010,162(2) :325-331.
CorrelationofRasgeneproteinexpressionandgenemutationandskinpathologicalscarandscarcarcinoma
Guoruizhen,Wanghaiqing,Huchengjiu,Bianke
(Department of Pathology,the Zhuhai Campus of Zunyi Medical College,Guangdong Zhuhai 519041,China)
ObjectiveTo investigate the correlation of Ras family (H-ras/N-ras/K-ras) protein expression and gene mutation between the canceration of skin pathological scar and the occurrence of scar carcinoma abuote.MethodsConfocal microscopy was used to detect the protein expression of K-ras,H-ras and N-ras in skin pathological scars and scar carcinoma tissues.K-ras,H-ras and N-ras expressions in normal skin tissue,pathological scar and scar carcinoma were measured by the immunohistochemical staining of SP method.DNA in skin pathological scar and scar carcinoma tissues was extracted and H-ras,N-ras and K-ras mutations in codons 12 and 13 were analyzed using PCR and sequencing.ResultsThe fluorescence expression of K-ras,H-ras and N-ras in scar carcinoma was higher than those in pathological scar epithelium via confocal microscopy assay.K-ras,H-ras and N-ras protin expression in normal skin tissue,pathological scar epithelium and scar carcinoma was gradually increased.Furthermore,there was significant difference of protein expression level including protein-positive area and the mean optical density between normal skin and scar carcinoma groups (P<0.05).However,no significant difference was shown between normal and skin pathological scar groups (P>0.05).In addition,the mutations of codons 12 and 13 of H-ras,N-ras and K-ras genes were not detected in skin pathological scar and scar carcinoma.Conclusion①The higher expression of K-ras,H-ras and N-ras might play an important role in the occurrence of skin scar carcinoma.②No mutations of codons 12 and 13 of H-ras,N-ras and K-ras genes were found in skin pathological scar and scar carcinoma.③Early canceration signal was not discerned in the pathological scar epithelium.
pathological scar;scar carcinoma;Ras gene;mutation;canceration
遵义医学院自然科学类招标项目(NO:F-552);贵州省科技攻关项目(NO:2010-3080)。
R739.5
A
1000-2715(2012)05-0389-07
【收稿2012-06-27;修回2012-09-03】
(编辑:谭秀荣)

