有氧运动改善高脂膳食诱导的胰岛素抵抗:增强骨骼肌线粒体融合与分裂及功能
赵斐 靳庆勋 乔海荣 张勇
天津体育学院天津市运动生理与运动医学重点实验室,健康与运动科学系(天津 300381)
胰岛素抵抗(Insulin Resistance,IR)是2型糖尿病(Type 2 Diabetes Mellitus,T2DM)的发病基础,其主要表现之一是胰岛素促进周围组织主要是骨骼肌摄取和利用葡萄糖的能力下降。已有大量研究[1-2]报道运动可以改善IR,是T2DM的防治手段之一,但其机制仍不清楚。
代谢紊乱是IR的主要特征,研究不仅显示IR的发生与细胞内最重要的能量代谢器官——线粒体的功能有密切关系[3],线粒体的形态也可能与IR和T2DM有关[4]。线粒体形态与结构具有高度动态性,在适应各种不同的生理功能和细胞内不同部位的能量的需要时,线粒体在活细胞中不断地进行着分裂、融合,其形态和数量都在不断地变化[5]。线粒体功能的差异可能不仅取决于线粒体的数量或其中代谢酶的活性,还因线粒体动态结构的改变而不同[6],融合与分裂的动态平衡异常可以导致细胞能量代谢紊乱。骨骼肌线粒体融合与分裂的变化在IR发生和运动防治IR中的作用是本研究关注的重点。
本研究采用高脂膳食诱导小鼠IR模型,观察在IR发生过程中骨骼肌线粒体融合与分裂的动态变化及氧化磷酸化功能的改变与IR发生的关系,以及长期有氧运动对此过程的干预作用,从线粒体融合与分裂动态变化对线粒体功能影响的视角,探讨IR发生的分子病理学机制以及运动防治IR的机制,为IR和T2DM的运动防治提供理论依据。
1 材料与方法
1.1 实验动物及分组
8周龄雄性C57BL/6小鼠经高脂饲料喂养8周建立IR模型,高脂饲料配方采用Research Diet Inc.的高脂饮食配方[7](热量比为:蛋白质20%,碳水化合物20%,脂肪45%)。喂养8周后测定口服糖耐量、空腹血糖(Fast Blood Glucose,FBG)和空腹胰岛素鉴定IR,模型成功率约70%。将20只IR小鼠分为高脂膳食安静组(HS)和高脂膳食运动组(HE),20只同期饲养的正常小鼠分为正常膳食安静组(NS)和正常膳食运动组(NE)。运动组进行8周跑台训练。坡度0°,速度12 m/min(75%VO2max),60 min/次,5次/周,为期8周。
1.2 空腹血糖、胰岛素测定
小鼠处死取材前禁食14~16小时,尾静脉取血测定空腹血糖,内眦取血分离血清,采用LINCO试剂盒(EZRMI-13K)ELISA法测定空腹血清胰岛素值(Fast Insulin,FINS),单位ng/ml。计算胰岛素抵抗指数(Homeostatic Model Assessment for Insulin Resistance,HOMA-IR)评价IR,计算公式为 :HOMA-IR = FINS(pmol/l)× FBG(mmol/L)/135。
1.3 骨骼肌线粒体的提取
小鼠处死后迅速取出两侧腓肠肌、股直肌(约1~1.5 g),放入预冷的介质I(0.12 M KCl,20 mM Hepes,5 mM MgCl2,1 mM EDTA,pH7.4) 中,剔除筋膜与脂肪,洗2遍。在含3 ml预冷的介质I的平皿中将肌肉剪碎。冰浴中1200 r/min电动匀浆。加入4 ml预冷的介质I,4℃、600g离心10 min。过滤上清以去除脂肪,4℃、17000g 离心10 min。弃上清,留沉淀,加入5 ml介质I(含250µl 0.1 g/ml fat free BSA),4℃、7000g离心10 min。弃上清,留沉淀,加入2 ml介质II(0.3 M Sucrose,2.0 mM Hepes,0.1 mM EDTA,pH 7.4)( 含 40 µl fat free BSA)悬起,4℃、3500g离心10 min。将沉淀用300 µl介质II悬起。考马斯亮蓝法对提取的线粒体进行蛋白定量。
1.4 线粒体呼吸功能测定
线粒体呼吸功能采用Clark氧电极法,用Oxytherm 测 氧 仪(Hansatech-Instruments Co.,UK)测定态3呼吸速率(state 3)、态4呼吸速率(state 4)及呼吸控制比(respiratory control ratio,RCR)。反应体系1 ml,30℃恒温。反应介质为:130 mM KCl,10 mM Hepes,1 mM EDTA,2.5 mM KH2PO4,1.5 mg defatted BSA,pH 7.4。线粒体蛋白浓度为1 mg/ml。加入0.1 mmol/L苹果酸和1 mmol/L谷氨酸启动态4呼吸。平稳后加入200 nmol ADP启动态3呼吸。ADP耗尽后重又回到态4呼吸。记录仪记录耗氧曲线。由此可算出态3、态4呼吸,以及RCR(态3/态4)。
1.5 线粒体ATP合成酶活力测定
采用20/20n型发光仪和荧光素-荧光素酶发光法测定ATP合成酶活力。反应温度为25℃,在0.5 ml反应体系中含有0.5 mM EDTA,10 mM HEPES,5 mM磷酸盐缓冲液,2.5 mM MgCl2,0.5 M苹果酸/0.25 M谷氨酸,100 µl荧光素-荧光素酶,50 µg线粒体。记录以上体系的发光强度为本底,加入4 µl ADP启动反应,记录发光强度。在不加线粒体和ADP的平行实验中,加入1 nM ATP,记录发光强度,标定ATP合成量。酶活力单位为nmol/min ·mg pro。
1.6 Real-time PCR测定骨骼肌Mfn2、Opa1、Drp1、Fis1 mRNA表达
用Trizol法提取小鼠骨骼肌总RNA,经紫外分光光度计检测OD值及OD260/280比值,计算RNA浓度。采用Fermentas的Revert AidTM第一链cDNA合成试剂盒进行逆转录。Real-time PCR采用TAKARA的Mix Taq试剂盒于ABI StepOne Realtime PCR仪进行。计算 CT表示mRNA相对含量。
MFN2(NM_133201.2) 上 游 引 物 :5’-CTCCAAGTGTCCGCTCCTGAA-3’,下游引物:5’-AGCTGTCCAGCTCCGTGGTAA-3’,PCR 产物80 bp。OPA1(NM_133752.2)上游引物:5’-AGGCAGCAGCTTACAAACACTGAA-3’,下游引物:5’-AGCTGAACTCGTTTGCCAGTGA-3’,PCR产物122 bp。DRP1(NM_152816.2)上游引物:5’-ATGCCTGTGGGCTAATGAACAATAA-3’, 下游引物:5’-GTTCCTGACCACCGTCTCCAA-3’,PCR 产物 132 bp。FIS1(NM_025562.2)上游引物 :5’-GAGCTGGAACGCCTGATTGATAA-3’,下游引物:5’-GGCTGCCTTCAGGATTTGGA-3’,PCR产物143 bp。PCR 反应体系:SYBR@Premix Ex Taq(2×)10 µl,PCR Forward Primer(10 µM)0.4 µl,PCR Reverse Primer(10 µM)0.4 µl,ROX Reference Dye(50×)0.4 µl,cDNA 2 µl,ddH2O 6.8µl。
1.7 Western Blot测定骨骼肌Mfn2、Opa1、Drp1、Fis1蛋白表达
RIPA法提取小鼠骨骼肌总蛋白,考马斯亮蓝法测定上清蛋白浓度。使用Tris-甘氨酸SDS进行聚丙烯酰胺凝胶电泳。采用湿法电转印将蛋白转到PVDF膜上。用含有5%BSA的抗体稀释液按比例(Mfn2、Opa1、Drp1和 Fis1分别按 1:5000、1:15000、1:10000 和1:1000稀释)稀释一抗,4℃孵育过夜。然后用1×TBST 洗膜3次,每次5分钟。用含有5%脱脂奶粉的抗体稀释液按照1:10000的比例稀释二抗,室温孵育1小时后用1×TBST洗膜3次,每次5分钟,加KPL发光底物,于暗室曝光,胶片经显影、定影后进行扫描,以 -tubulin为内参经Quantity ONE(BIO-RAD)软件对目的蛋白质进行光密度相对定量分析。
1.8 统计学分析
所有实验数据由SPSS13.0统计软件处理,计算均值和标准差(±s),组间比较采用双因素方差分析(UNIANOVA-General Linear Models),显著性水平定为P< 0.05。
2 结果
2.1 空腹血糖、空腹胰岛素和HOMA-IR
HS组小鼠经16周高脂膳食,FBG、FINS与HOMA-IR均显著高于NS组(P< 0.01);NE组与NS组无显著性差异(P> 0.05);HE组显著低于HS组(P< 0.01),但仍显著高于NS组(P< 0.01)(见表1)。
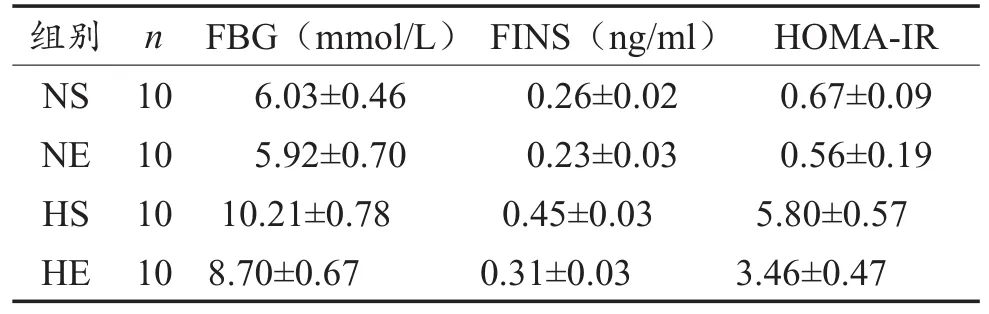
表1 各组FBG、FINS与HOMA-IR比较
2.2 骨骼肌线粒体呼吸功能
如图1显示:与NS组相比,HS组小鼠骨骼肌线粒体态4呼吸显著升高(P< 0.05),态3呼吸和RCR变化无显著性差异(P> 0.05);NE组线粒体态3呼吸和RCR显著升高(P< 0.01),态4呼吸变化无统计学意义(P> 0.05)。HE组态3呼吸和RCR显著高于HS组(P< 0.05),态4呼吸无显著性差异(P> 0.05)。高脂膳食使小鼠骨骼肌线粒体态4呼吸升高,态3呼吸和RCR降低。8周有氧运动使正常和高脂膳食小鼠骨骼肌线粒体态3呼吸和RCR均显著升高,对态4呼吸无显著影响。结果提示:长期高脂膳食诱导IR的小鼠骨骼肌线粒体呼吸功能下降,运动可通过增加态3呼吸提高线粒体呼吸功能,有利于预防和改善高脂膳食对骨骼肌线粒体功能的负性影响。

2.3 骨骼肌线粒体ATP酶合成活力
如图2所示,NE组小鼠骨骼肌ATP酶合成活力显著高于NS组(P< 0.05)。HS组骨骼肌ATP酶合成活力显著低于NS组(P< 0.01)。HE组ATP酶合成活力显著高于HS组(P< 0.01),与NS组差异无统计学意义(P> 0.05)。结果提示:高脂膳食导致骨骼肌ATP酶合成活力降低,运动则增强正常和高脂膳食小鼠骨骼肌ATP酶合成活力。

2.4 骨骼肌线粒体融合蛋白MFN2和OPA1的mRNA和蛋白表达
如图3所示:NE组小鼠骨骼肌线粒体融合蛋白MFN2和 OPA1 的mRNA和蛋白显著高于NS组(P< 0.05,P< 0.01)。HS组 MFN2 mRNA 和蛋白均显著低于NS组(P< 0.01),OPA1 mRNA显著低于NS组(P< 0.01),蛋白水平与NS组差异无显著性(P> 0.05)。HE组MFN2 mRNA和蛋白均显著高于HS组(P< 0.01),但仍均显著低于NS组(P< 0.01)。OPA1 mRNA和蛋白均显著高于HS组(P< 0.01,P< 0.05),其蛋白水平显著高于NS组(P< 0.05)。结果提示:长期高脂膳食下调了小鼠骨骼肌线粒体融合蛋白MFN2和OPA1的mRNA和蛋白表达,长期有氧运动则上调了融合蛋白的表达。Opa1表达的变化与MFN2不完全一致。
2.5 骨骼肌线粒体分裂蛋白DRP1和FIS1 mRNA和蛋白表达
如图4所示:NE组小鼠骨骼肌线粒体分裂蛋白DRP1和FIS1 mRNA和蛋白显著高于NS组(P< 0.05,P< 0.01)。HS组也均显著高于NS组(P< 0.05,P< 0.01)。HE组DRP1 mRNA和蛋白均显著高于HS组和NS组(P< 0.01)。FIS1 mRNA和蛋白与HS组比较无显著性差异(P> 0.05),蛋白水平显著高于NS组(P< 0.01)。结果提示:长期高脂膳食和长期有氧运动均上调小鼠骨骼肌分裂蛋白DRP1和FIS1的mRNA和蛋白表达。


3 讨论
3.1 胰岛素抵抗小鼠骨骼肌线粒体功能受损和融合与分裂平衡改变
IR和T2DM以糖、脂代谢异常为特征,是外周组织(如骨骼肌)在胰岛素作用下对葡萄糖的摄取和利用减少。在多基因遗传的背景下,“多吃少动”的不健康生活方式是其重要的诱因。从能量代谢角度看,这种生活方式的机体基础代谢率和日常代谢率低,能量摄入超出能量消耗,导致能量过剩。过剩能量转化为脂肪在体内堆积,损害了外周组织对糖的利用和代谢能力,造成了IR的发生和发展,并逐渐导致胰岛功能的衰竭。细胞内最重要的能量器官——线粒体的功能与IR的发生有密切关系。葡萄糖和脂肪酸的最终代谢出路都是在线粒体经三羧酸循环和呼吸链氧化磷酸化彻底氧化分解。因此线粒体氧化磷酸化功能的缺陷,必然导致脂质堆积和葡萄糖清除能力降低。虽然关于线粒体功能缺陷是IR发生的原因还是结果尚存在分歧[8,9],但可以肯定线粒体功能在IR的发生过程中发挥了重要作用。本研究中,IR小鼠骨骼肌线粒体呼吸功能和ATP合成能力减弱,削弱了对脂肪酸和葡萄糖的氧化能力,加剧了脂肪在骨骼肌的堆积,进而抑制了胰岛素刺激下的葡萄糖摄取。
线粒体形态和结构是不断变化的,呈现不断融合与分裂中的网状结构。线粒体融合与分裂是由其内外膜上的一些保守蛋白介导的[10,11],介导哺乳动物线粒体融合的蛋白主要有Mfn1/2和Opa1,介导线粒体分裂的蛋白主要有Drp1和Fis1。细胞内线粒体的网络化程度取决于线粒体融合与分裂速度的相对平衡,高度动态平衡的线粒体比相对静态的线粒体更具强势,因此保持活跃的线粒体融合与分裂活性平衡才是线粒体正常功能的保证。由融合与分裂动态平衡决定的线粒体形态和分布与其功能有密切的关系。线粒体含量和形态会因能量需求而改变[12]。
本研究结果显示,长期高脂膳食干预下,小鼠骨骼肌线粒体呼吸功能下降,骨骼肌融合基因表达减少,分裂基因表达增多。线粒体趋于分裂可能是线粒体呼吸功能下降的原因之一。骨骼肌是能量需求旺盛的组织,线粒体的网络化程度非常高。线粒体过度分裂将损害线粒体的能量代谢,融合与分裂的动态平衡能力的下降、融合与分裂的不平衡可能是导致细胞能量代谢紊乱的原因之一[13],可以导致IR时出现糖、脂代谢障碍。但在IR的发生中,高脂干预是否通过影响融合与分裂造成线粒体功能的损害,还需要增加对融合与分裂的干预实验加以验证。
3.2 长期有氧耐力训练促进骨骼肌线粒体融合与分裂、增强线粒体功能
一次急性运动即可引起线粒体形态和功能的变化,耐力运动使骨骼肌线粒体发生适应性改变。运动生理学家就很早已观察到肌纤维对运动训练的选择性肥大,其中慢肌纤维对耐力运动的适应包括线粒体增多、增大,线粒体酶活性增强。线粒体增多是生物合成增强的结果,增大则可能就是融合增加的结果。
我们的前期研究也显示急性运动降低大鼠骨骼肌MFN1/2的表达而增加FIS1的表达[14]。Garnier报道[15],经过长期有氧运动训练的健康个体骨骼肌线粒体的氧化磷酸化能力、调控线粒体形态的MFN2以及DRP1基因的表达水平明显增加。本研究结果显示,长期有氧运动可使正常或IR小鼠骨骼肌线粒体融合基因(MFN2和OPA1)、分裂基因(DRP1和FIS1)表达均增加;线粒体呼吸功能、ATP合成酶活力增强。
运动使机体代谢率升高,在细胞水平(特别是骨骼肌)能量代谢速率也会加快。由于能量消耗增加,AMP/ATP比值升高,激活AMPK,可促进GLUT4和线粒体基因的表达适应性升高[16]。此外,细胞内AMP/ATP比值的改变影响AMPK及PGC1- 等表达,进而通过改变细胞内能量器官线粒体的合成、降解、融合与分裂、移动等,调节线粒体的数量和功能,使线粒体发生适应性的变化[17]。
3.3 线粒体融合与分裂在运动改善胰岛素抵抗机制中的作用
运动预防和改善IR和T2DM已被证实[18],尽管运动是防治IR的手段,但正如IR的发生机制不清一样,运动预防和改善IR的机制也尚未明晰。研究表明,即使不改变肌内脂肪含量,一次急性运动即可通过不依赖于经典胰岛素信号通路增强骨骼肌葡萄糖摄取,而这种“胰岛素增敏作用”约持续48小时[19],这一结果为运动作为改善外周IR手段提供了有力支持。运动中骨骼肌是清除葡萄糖的最主要部位。已知运动改善IR的可能机制包括:(1)促进对脂肪酸和葡萄糖氧化分解能力;(2)促进GLUT4摄取葡萄糖。运动是否通过提高线粒体功能并通过调节线粒体动态变化改善IR仍不清楚。
运动防治IR时,线粒体为主导的能量利用/转换速率的增加应是改善IR的决定因素。Toledo等[20]通过电镜观察,发现IR的肥胖者骨骼肌线粒体含量减少、体积变小;16周有氧运动和饮食控制可以逆转这一现象,并与IR的改善相关。这表明线粒体形态和含量与IR有关。长期有氧运动训练使骨骼肌线粒体融合与分裂均加快,即加快了融合与分裂的动态平衡,线粒体融合与分裂在运动改善胰岛素抵抗机制中可能通过改善线粒体功能发挥作用。不仅融合蛋白Mfn2参与调节线粒体氧化磷酸化[21],而且融合与分裂配合线粒体自吞噬,实现线粒体群体的“质量控制”[22]。因此线粒体融合与分裂过程的动态平衡是其正常功能的保证,也可能是线粒体功能异常或改善的重要方面。
总之,线粒体对长期耐力训练的适应性表现为从功能上增强了对脂肪酸和葡萄糖的代谢能力。在对长期耐力运动的适应下,线粒体功能的增强不仅依靠增强内部的氧化磷酸化酶活性,还需要有与之相应的数量、形态和分布的改变,这都需要增强线粒体融合与分裂的动态平衡来实现。干预融合与分裂可能影响线粒体功能而改善IR,可能是运动改善IR和T2DM的关联靶向之一。
4 总结
长期高脂膳食使小鼠骨骼肌线粒体融合减少,分裂增多,呼吸功能和ATP合成能力下降,从而导致细胞内脂质堆积,可能是高脂膳食诱导IR的机制之一。而长期有氧运动训练使正常和IR小鼠骨骼肌线粒体融合和分裂均增强,促进线粒体呼吸功能和ATP合成能力,有利于预防和改善IR。
[1]Hawley JA. Exercise as a therapeutic intervention for the prevention and treatment of insulin resistance. Diabetes Metab Res Rev,2004,20(5):383-393.
[2]Schenk S,Horowitz JF. Acute exercise increases triglyceride synthesis in skeletal muscle and prevents fatty acidinduced insulin resistance. J Clin Invest,2007,117(6):1690-1698.
[3]Lowell BB,Shulman GI. Mitochondrial dysfunction and type 2 diabetes. Science,2005,307(5708):384-387.
[4]Kelley DE,He J,Menshikova EV,et al. Dysfunction of mitochondria in human skeletal muscle in type 2 diabetes. Diabetes,2002,51(10):2944-2950.
[5]Hoppeler H,Fluck M. Plasticity of skeletal muscle mitochondria:structure and function. Med Sci Sports Exerc,2003,35(1):95-104.
[6]Civitarese AE,Ravussin E. Mitochondrial energetics and insulin resistance. Endocrinology,2008,149(3):950-954.
[7]De Souza C T,Araujo EP,Bordin S,et al. Consumption of a fat-rich diet activates a proin fl ammatory response and induces insulin resistance in the hypothalamus. Endocrinology,2005,146(10):4192-4199.
[8]Kraegen EW,Cooney GJ,Turner N. Muscle insulin resistance: A case of fat overconsumption,not mitochondrial dysfunction. PNAS,2008,105(22):7627-7628.
[9]Holloszy JO. Skeletal muscle‘ mitochondrial de ficiency’does not mediate insulin resistance. Am J Clin Nutr,2009,89(suppl):463S-6S.
[10]Meeusen S,Mccaffery JM,Nunnari J. Mitochondrial fusion intermediates revealed in vitro. Science,2004,305(5691):1747-1752.
[11]James DI,Parone PA,Mattenberger Y,et al. hFis1,a novel component of the mammalian mitochondrial fission machinery. J Biol Chem,2003,278(38):36373-36379.
[12]Holloszy JO,Coyle EF. Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J Appl Physiol,1984,56(4):831-838.
[13]Chen H,Chomyn A,Chan DC. Disruption of fusion results in mitochondrial heterogeneity and dysfunction. J Biol Chem,2005,280(28):26185-26192.
[14]Ding H,Jiang N,Liu HJ,et al. Response of mitochondrial fusion and fission protein gene expression to exercise in rat skeletal muscle. Biochimica et Biophysica Acta. 2010,1800:250–256.
[15]Garnier A,Fortin D,Zoll J,et al. Coordinated changes in mitochondrial function and biogenesis in healthy and diseased human skeletal muscle. FASEB J,2005,19(1):43-52.
[16]Holmes B,Dohm GL. Regulation of GLUT4 gene expression during exercise. Med Sci Sports Exerc,2004,36(7):1202-1206.
[17]Hood DA,Irrcher I,Ljubicic V,et al. Coordination of metabolic plasticity in skeletal muscle. J Exp Biol,2006,209(Pt 12):2265-2275.
[18]Holloszy JO. Exercise-induced increase in muscle insulin sensitivity. J Appl Physiol,2005,99(1):338-343.
[19]Thyfault JP,Cree MG,Zheng D,et al. Contraction of insulin-resistant muscle normalizes insulin action in association with increased mitochondrial activity and fatty acid catabolism. Am J Physiol Cell Physiol,2007,292(2):C729-C739.
[20]Toledo FG,Watkins S,Kelley DE. Changes induced by physical activity and weight loss in the morphology of intermyo fibrillar mitochondria in obese men and women.J Clin Endocrinol Metab,2006,91(8):3224-3227.
[21]Bach D,Pich S,Soriano FX,et al. Mitofusin-2 determines mitochondrial network architecture and mitochondrial metabolism. A novel regulatory mechanism altered in obesity. J Biol Chem,2003,278(19):17190-17197.
[22]Twig G,Hyde B,Shirihai OS. Mitochondrial fusion,fission and autophagy as a quality control axis: the bioenergetic view. Biochim Biophys Acta,2008,1777(9):1092-1097.

