Cox-2/PGE-2及IL-6在Wnt/β连环蛋白-骨代谢信号通路中的作用机制
鲍捷 王国祥
1 苏州大学体育学院运动人体科学系(苏州 215021)
2 苏州大学捷美生物医学工程仪器联合重点实验室
Wnt/β连环蛋白信号通路在Wnt信号通路中最为经典,其对应力刺激敏感,能够将机械信号转化为生物化学信号,并对OPG/RANKL/RANK骨代谢信号进行调控[1]。COX-2/PGE-2作为Wnt/β连环蛋白信号对骨代谢信号通路调控的中间途径,同时也作为独立的一个信号存在,对应力刺激敏感,在整个信号通路中起到重要的作用[2]。细胞因子白介素6(IL-6)对运动应激敏感,可以影响COX-2活性,与PGE-2共同作为Wnt/β连环蛋白信号-COX-2/PGE-2-OPG/RANKL/RANK信号链的正反馈信号[3],可以解释机体应激条件下的过度运动应力促骨细胞及形态学改变致骨损伤易感性增高的机理。
1 COX-2/PGE-2与应力刺激
环氧化酶(cyclooxygenase,COX)是游离花生四烯酸合成前列腺素(prostaglandin,PG)和血栓素的限速酶,包括COX-1和COX-2两种亚型。COX-1在大多数正常细胞中呈稳定表达状态,维持正常的生理功能,而COX-2是诱导应激性表达基因,在细胞应激时迅速合成,参与应激过程,在多种炎症及肿瘤的发生发展中常见[4-6]。COX-2主要定位于细胞的核膜,其产生的PG可以直接进入核内,调节靶基因的转录。PG是存在于动物和人体内的一类不饱和脂肪酸组成的具有多种生理活性的物质,在人体内由花生四烯酸合成,由一个五环和两条侧链构成,分为A~I等9个类型。实验证实,当选择性上调COX-2,使其持续表达,可促PG持续分泌[7]。PGE-2通过特异性受体介导完成对骨组织代谢的调节,在骨代谢中具有双向调节作用,有剂量依赖性。使用3µM的PGE-2对血清培养基中的3~5个/视野的成骨细胞培养24小时,每视野下成骨细胞数目增殖至10~15个;在使用western-blot法测试PGE-2对胶原纤维蛋白水平表达的实验中,同样发现胶原纤维蛋白水平无论从PGE-2的刺激时间还是刺激浓度上都有显著的依赖性[8]。Somayaji等在对成骨细胞培养过程中,加入COX-2的抑制剂NS-398后发现,加抑制剂组PGE-2含量远低于对照组,RANKL蛋白水平显著下降。此外,还有更多的研究表明低浓度的PGE-2促成骨细胞胶原纤维合成,高浓度PGE-2参与骨的吸收过程,其剂量受COX-2的调节[9-11]。
在牙科学的研究中发现,COX-2/PGE-2对炎症和应力刺激敏感,牙周炎组的COX-2、PGE-2水平较健康组显著升高,而牙齿矫形领域的研究发现,机械牵张力促COX-2,PGE-2水平升高,且升高水平与NF-κB受体活化因子配体(ligand of receptor activator of NF-κB,RANKL)成正相关。RANKL由成骨/基质细胞分泌,在1,25(OH)2D3、PTH和IL-11辅助作用下,可以被前破骨细胞识别并通过该分子与成骨/基质细胞发生作用,继而分化为破骨细胞(osteoclast,OC),其在体外能诱导成骨细胞(osteoblast,OB)胶原纤维的生成,在体内能促进骨吸收[12,13]。将骨髓培养细胞放入重组sRANKL环境,发现其在没有成骨/基质细胞条件下分化为OC。当给小鼠注射sRANKL后也发现OC数量增多,骨吸收活跃,血钙升高[14],表明RANKL除了刺激OC分化成熟,还能活化OC,增强OC的功能。多个实验表明,PGE-2通过刺激OB细胞中RANKL的表达,调节OC活性和分化[15-17](图 1)。
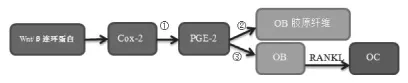
图1 COX-2/PGE-2/RANKL信号通路的作用机制
近年来应力刺激对COX-2/PGE-2水平上调的作用广受关注,相关研究试图解释运动应力对骨健康的双向调节机制[18]。研究发现,力学信号转化为生物化学信号并不直接引起COX-2水平的上调,而是通过细胞间隙结构-分子信号转换作用实现。钙粘附蛋白是一个介导细胞间黏附聚集和信号转导的家族,在不同的组织,分布有E-钙粘附蛋白、N-钙粘附蛋白、P-钙粘附蛋白等三种类型。钙粘附蛋白分子的胞浆区高度保守,并与细胞内骨架相连,在包括成骨细胞在内的很多种细胞里存在。钙粘附蛋白作为一种跨膜的钙依赖性黏附分子,在细胞膜上直接与β-连环蛋白结合形成一个复合体,它把β-连环蛋白隔离于细胞膜上,阻止β-连环蛋白向胞浆及胞核转位,发挥其调控下游基因表达的作用[19]。Adkison等给鼠肺动脉血管内皮细胞施加34%的牵张应力24 h后发现,与β-连环蛋白结合的E-钙粘附蛋白明显减少[20]。采用细胞形态与生物学、分子生物学等多种研究手段探讨牵张应力作用下成骨细胞Wnt/β-连环蛋白信号通路的变化和作用发现,牵张应力可以激活Wnt/β-连环蛋白信号,促进GSK-3β复合物解体,游离β-连环蛋白增多,GSK-3β与和E-钙粘附蛋白结合的β-连环蛋白结合后促β-连环蛋白脱离E-钙粘附蛋白后降解,无β-连环蛋白结合的E-钙粘附蛋白则引起细胞骨架的变化,而从GSK-3β复合物脱落的β-连环蛋白入核后与Tcf/Lef结合,促下游目的基因COX-2、c-Fos、c-Jun等表达,β-连环蛋白在这个过程中发挥着重要的枢纽作用。成骨细胞胞膜上的β-连环蛋白/E-粘附蛋白复合体在牵张力的作用下解聚并引起β-连环蛋白入核则可能是机械信号转导的内在机制之一[21]。细胞骨架的松散及COX-2/PGE-2大量生成,通过RANKL的促破骨细胞活性作用致骨结构改变,骨强度下降,从而使骨损伤易感性增高(图2)。
2 IL-6与运动应激

图2 -连环蛋白-E-钙粘附蛋白复合物与细胞骨架链接结构
白细胞介素(interleukin,IL)是一组由多种细胞产生的介导细胞之间相互作用的细胞因子。IL-6是白介素家族的一类具有促炎抗炎及对运动应激敏感的细胞因子,在炎症时由T细胞和巨噬细胞分泌,促进创伤部位免疫反应。IL-6通过对TNF-α和IL-1的抑制以及对IL-1Ra和IL-10的激活实现抗炎作用。运动应激状态下肌肉收缩,肌组织分泌IL-6,并在血循环中提前于其他细胞因子出现。多数组织IL-6会在运动应激状态下升高,升高程度与运动强度、运动量及运动方式密切相关[22,23],有研究发现肌肉离心运动时产生IL-6显著高于向心运动[24]。而在对大鼠进行6周递增负荷的研究中,由于大鼠免疫应激的适应过程导致血清IL-6比较平稳,说明IL-6与机体对运动量或强度的不适应所导致的应激相关,而逐步递增的适应性负荷不易引起 IL-6的变化[25]。
IL-6作为研究最完善的细胞因子之一,其通过与IL-6R结合后再与信号转导亚单位gp130结合,从而调节IL-6的生物功能[26]。gp130 是糖蛋白,也是重要的受体复合物信号调节元件,受到细胞因子刺激后,gp130发生二聚化,与gp130近膜端连接的非受体型的酪氨酸激酶(Janus kinase,JAK)被激活,从而启动一系列信号转录[27]。信号传递转录激活蛋白(signal transduction and activation of transcription,STAT)是一类信息传递与转录激活蛋白,其主要功能是促进信息核转移[28],JAK信号对其酪氨酸磷酸化后转移入核,并激活下游基因表达[29]。JAK/STAT通路是IL-6参与应激反应的细胞因子传导信号的重要途径,其可被EPO、IL-3、G-CSF、IL-6等多种细胞因子刺激所激活,可能是这些不同的细胞因子受体信号转导途径中的一个共同因素,这种与受体相联的JAK激酶可能因受体结构的不同而催化不同的底物,使JAK介导许多不同的生物学功能[30]。
在成骨细胞内,RANKL基因的表达严格地受一些促骨因子的调节,包括1,25(OH)2D3,甲状旁腺激素,还有细胞因子如IL-1、IL-6、IL-11等。IL-6与细胞膜上的gp130发生二聚化以后,激活酪氨酸激酶JAK,随后激活的JAK对STAT磷酸化,STAT3蛋白抑制分子PIAS3解离,被磷酸化的STAT入核,并促进RANKL的转录及表达,从而促进破骨细胞的成熟[31,32](图 3)。

图3 IL-6的JAK/STAT3途径直接对RANKL的影响(Tomohiro H,Takaishi H,Takito J,et al. Blood,2009[32])
除此以外,IL-6通过与gp130二聚化后,通过激活JAK促进磷脂酰肌醇-3激酶(PI-3K)磷酸化,后通过蛋白激酶(Akt)途径,激活MAPK;另一条通路是JAK和Ras结合,促Ras/MAPK通路激活,从而促破骨细胞活性[33,34]。(图 4)

图4 IL-6与gp130二聚化后的其他信号通路(Steeve KT,Marc P,Sandrine T,et al. Cytokine and Growth Factor Reviews,2004[38])
近年研究认为IL-6与COX-2的调节过程密切相关,其机制涉及运动干预、受体免疫、信号激活等多个方面[35,36]。IL-6由单核巨噬细胞、内皮细胞及淋巴细胞分泌,刺激骨组织中成骨细胞进一步分泌IL-6,从而调节破骨细胞的分化和成熟[37,38]。
3 COX2/PGE-2与IL-6在Wnt/β连环蛋白信号通路中的作用
COX-2/PGE-2/RANKL是骨吸收的重要信号之一,其同时作为Wnt/β连环蛋白信号通路的下游信号,参与对OPG/RANKL/RANK骨代谢信号调控。
骨骼系统的发育对运动应力敏感,并在运动应力的刺激下不断地进行生理重塑。骨的重塑受骨细胞系活性影响,其中最主要的就是成骨细胞(osteoblasts),骨细胞(osteocytes)及破骨细胞(osteoclasts)。成骨细胞和破骨细胞在时间和空间上有很近的联系,当获得一个刺激信号(负荷、激素或生长因子),破骨细胞出现在骨的表面,并通过细胞外酸溶机制吸收骨的矿物成分[39]。
Wnt/β连环蛋白信号对骨形成和骨量起到直接作用,目前被看作骨质疏松发生最重要因素之一[40,41]。其中 Lrp5 作为 Wnt的辅助受体,Wnt/Lrp5信号是骨合成的重要信号[42,43],通过Wnt/β连环蛋白信号刺激可以促进成骨细胞增殖及分化,并诱导抑制脂质细胞[44,45],部分实验发现其机制为与骨形成蛋白、甲状旁腺素信号互相作用,促进成骨细胞基因表达,促进成骨细胞生长[46-48]。
John给大鼠连续使用GSK-3β抑制剂(GSK-3βi),同时对大鼠活体胫骨固定后施4点弯曲力2周后发现,使用GSK-3βi的大鼠COX-2、eNOS、Wnt10B、FzD2等基因表达显著增加,其中COX-2表达是对照组的28倍[49]。在对MC3T3-E1细胞5小时内采用微压力系统加力3400次发现,COX-2和eNOS基因表达增加2.5倍,与c-fos和c-jun基因表达增加(3.5倍)相关。以上实验表明COX2、eNOS、c-fos和c-jun都是对压力敏感基因,且通过用GSK-3βi的实验证实这些基因与Wnt/β连环蛋白信号相关,且属于Wnt/β连环蛋白信号通路转换的生物化学信号的一部分。Sawakami在LRP5基因缺失的成骨细胞中发现流体力学刺激增加PGE-2的释放,从而验证了PGE-2信号与Wnt/β连环蛋白信号对于力学刺激的感应与LRP5无关[50]。在使用机械应力进行体内外的刺激的实验表明,Wnt/β连环蛋白信号的激活,包括脂肪生成抑制基因Wnt10B的表达,可以诱导COX2、eNOS、c-fos和c-jun等基因的表达,也有人认为这是机械力刺激与Wnt/β连环蛋白信号协同刺激的结果[51,52]。
有研究发现在结肠癌的发生过程中COX-2与Wnt/β连环蛋白信号有着高相关性,并在信号通路共同路径中相互影响[53]。而PGE-2的升高能通过3个途径介导,促进入核与转录因子T细胞因子/淋巴增强因子(Tcf/Lef)的活性,从而使得COX-2基因表达进一步加强。其机制在于:(1)PGE-2与G双蛋白受体(GPR)结合直接影响Wnt/β连环蛋白信号通路轴蛋白(Axin)结合复合物能力,使β-连环蛋白结合细胞膜上的E-钙黏蛋白(E-cadherin),轴蛋白(Axin)、酪蛋白激酶(casein kinase,CK)、糖原合成酶激酶-3β(GSK-3β)的巨大复合物解体,β连环蛋白游离入核与Tcf/Lef作用。(2)PGE-2与GFR的复合物通过磷酸蛋白激酶A(PKA)-cAMP旁路直接激活 Tcf/Lef的活性[54]。(3)PGE-2与 GPR 的复合物与生长因子受体(growth factor receptors,GFR)进一步结合,通过磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/Akt)途径介导β连环蛋白的去磷酸化并促进其入核。(4)PGE-2与GFR的复合物与生长因子受体(growth factor receptors,GFR)进一步结合,通过Ras/MAPK途径促Tcf/Lef的活性[55(]图5)。由此可见,在持续应力刺激的情况下,Wnt/β连环蛋白信号通路对COX-2/PGE-2的促生成呈正反馈趋势,导致PGE-2浓度持续升高,刺激成骨细胞的RANKL大量分泌并发挥其生物学效应。PEG-2的正反馈积累效应也解释了长期持续应力作用下致骨细胞及形态学变化使骨损伤易感性增高的机制。

图5 IL-6、COX-2/PGE-2在Wnt/连环蛋白信号通路中的相互作用
运动应激产生的IL-6与gp130形成二聚体后,一方面通过Jak/STAT机制促RANKL直接分泌,另一方面通过Jak促PI3K/Akt途径及ras/MAPK途径,与PGE-2形成了共刺激信号,共同促进β连环蛋白的入核及细胞核内Tcf/Lef的活性。同时,IL-6促进PGE-2大量生成也进一步促进成骨细胞分泌IL-6,也形成了运动应激的正反馈机制。持续运动应力刺激必然产生持续运动应激,当机体在应激过程中打开免疫窗口,IL-6的正反馈机制与应力刺激的PEG-2正反馈积累效应相互促进,共同抑制成骨细胞的活性,并促进破骨细胞功能,使骨形态学发生改变,应力致骨损伤易感性增高。
4 小结与展望
COX-2/PGE-2是Wnt/β连环蛋白信号对骨代谢信号调控通路的中间途径,其通过Wnt/β连环蛋白,将力学信号转换为生物信号的机制,对OPG/RANKL/RANK骨代谢信号进行调控,其研究目前多集中在口腔医学领域,是否能在运动医学的骨损伤领域运用,尚需研究。IL-6是运动应激下多组织分泌的细胞因子,在运动时伴随运动应力的刺激使COX-2/PGE-2与IL-6系统同时激活,PGE-2与IL-6是一对能够相互影响的共刺激信号,分别通过其共同及独有的分子信号链对Wnt/β连环蛋白信号进行正反馈调节,通过从口腔医学及其他医学学科基础与临床实验中总结PGE-2与IL-6的正反馈积累效应,可尝试解释过度应力刺激及应激状态下骨细胞代谢及骨形态改变,使骨损伤易感性增高的机制,但应力是否促骨损伤尚无相关基础实验验证,值得进一步研究。
[1]鲍捷,王国祥. 应力刺激对β-连环蛋白的影响以及Wnt/β-连环蛋白在骨代谢信号通路中的作用.中国运动医学杂志,2011,30(8):795-801.
[2]Yewseok S,Farrukh A,Jeremy J,et al. A plant fl avonoid fisetin induces apoptosis in colon cancer cells by inhibition of COX2 and Wnt/EGFR/NF- B-signaling pathways. Carcinogenesis,2009,30:300-307.
[3]Chang WH,Hu SP,Huang YF,et al. Effect of purple sweet potato leaves consumption on exercise-induced oxidative stress and IL-6 and HSP72 levels. J Appl Physiol,2010,109(10):1710-1715.
[4]Park JL,Shu L,Shayman JA,et al. Differential involvement of COX1 and COX2 in the vasculopathy associated with the α-galactosidase A-knockout mouse.Am J Physiol Heart Circ Physiol,2009,296(4):1133-1140.
[5]Frungieri M B. Cyclooxygenase 2(COX2) and prostaglandins:Emerging roles in the testis. Biol Reprod,2008,78:159.
[6]Nakahari T. Different regulation of PGE2 production by COX1 and COX2 in guinea pig gastric antrum. FASEB J,2006,20:1271.
[7]Forwood MR. Inducible cyclo-oxygenase(COX-2)mediates the induction of bone formation by mechanical loading in vivo. J Bone Miner Res,1996,11(11):1688-1693.
[8]Tang CH,Yang RS,Fu WM. Prostaglandin E2 stimulates fibronectin expression through EP1 receptor,phospholipase C,protein kinase Ca,and c-Src pathway in primary cultured rat osteoblasts. J Biol Chem,2005,280:22907 -22916.
[9]Somayaji SN,Huet YM,Gruber HE,et al. Staph ylococcus aureus induces expression of receptor activator of NF-kappap ligand and prostaglandin E2in infected murine osteoblasts. Infect Immun,2008,76(11):5120-5126.
[10]Krieger NS,Bushinsky DA. Pharmacological inhibition of intracellular calcium release blocks acid-induced bone resorption. Am J Physiol Renal Physiol,2011,300 :91-97.
[11]Sakurai T,Terashima S,Miyakoshi J. Enhanced secretion of prostaglandin E2 from osteoblasts by exposure to a strong static magnetic field.Bioelectromagnetics,2008,29(4):277-283.
[12]Ikeda T,Kasai M,Utsuyama M,et al. Determination of the three isotoems of the receptor activator of nuclear factor-κB ligand and their differential expression in bone and thymus. Endocrinology,2001,142(4):1419-1426
[13]Kong YY,Yoshda H,Sarosi I,et al. OPGL is a key regulator of osteoclastogenesis,lympholyte development and lymphnode organogensis. Nature,1999,397(6717):315-323.
[14]Shalhoud V,Faust J,Boyle WJ,et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell pretursors.J Cell Biochem,1999,72(2):251-261.
[15]Liu L,Igarashi K.,Kanzaki H,et al. Clodronate Inhibits PGE2 Production in Compressed Periodontal Ligament Cells. J Dent Res,2006,85(8):757-760.
[16]Steeve KT,Amiable N,Pelletier J P,et al. Modulation of OPG,RANK and RANKL by human chondrocytes and their implication during osteoarthritis. Rheumatology,2009,48:1482-1490.
[17]Suzawa T,Miyaura C,Maruyama T,et al. The Role of Prostaglandin E Receptor Subtypes(EP1,EP2,EP3,and EP4) in Bone Resorption:An Analysis Using Speci fic Agonists for the Respective Eps. Endocrinology,2000,141(6): 1554-1559.
[18]吴昌敬,李友瑞,徐亚娟,等. 细胞骨架完整性在流体剪切力诱导成骨细胞COX-2基因表达中的作用. 中华口腔医学研究杂志电子版,2009,3(4):403-409.
[19]Goodwin M,Yap AS. Classical cadherin adhesion molecules:coordinating cell adhesion signaling and the cytoskeleton. J Mol Histol,2004,35(8-9):839-844.
[20]Adkison JB,Miller GT,Weber DS,et al. Differential responses of pulmonary endothelial phenotypes to cyclical stretch. Microvasc Res,2006,71(3):175-184.
[21]Grigoryan T, Wend P, Klaus A,et al. Deciphering the function of canonical Wnt signals in development and disease: conditional loss- and gain-of-function mutations of b-catenin in mice. Genes,2008,22:2308-2341.
[22]Macdonald C,Wojtaszewski JFP,Pedersen BK,et al.Interleukin-6 release from human skeletal muscle during exercise :Relation to AMPK activity. J Appl Physiol,2003,95:2273-2277.
[23]Ronsen O,Lea T,Bahr R,et al. Enhanced plasma IL-6 and IL-1ra responses to repeated vs. single bouts of prolonged cycling in elite athletes. J Appl Physiol,2002,92:2547-2553.
[24]Haahr PM,Pedersen BK,Fomsgaard A,et al. Effect of physical exercise on in vitro production of interleukin1,interleukin 6,tumour necrosis factor-alpha,interleukin 2 and interferon-gamma. Int J Sports Med,1991,12(2):223-227.
[25]王茂叶. 6周递增跑台运动对大鼠血清Th1/Th2平衡和IL-6的影响. 体育科学,2009,29(10):46-50.
[26]M llerg J,Geib T,Jostock T,et al. IL-6 receptor independent stimulation of human gp130 by viral IL-6. J Immunol,2000,164 :4672-4677.
[27]Silver JS,Hunter CA. gp130 at the nexus of inflammation autoimmunity and cancer. J Leukoc Biol,2010,88(10):1145-1156.
[28]刘景生. 细胞信息与调控. 北京:北京医科大学中国协和医科大学联合出版社,1998. 246.
[29]Darnell JJ,Kerr IM,Stark GR. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins. Science,1994,264 :1415-1421.
[30]Bolli R,Dawm B,Xuan YT. Role of the JAK-STAT pathway in protection against myocardial is chemia/reperfusion injury. Trends Cardiovasc Med,2003,13(2):72.
[31]Somayaji SN,Ritchie S,Sahraei M,et al.Staphylococcus aureus induces expression of receptor activator of NF- Kappa B ligand and prostaglandin E2 in infected murine osteoblasts. Infect Immun,2008,76(11):5120-5126.
[32]Tomohiro H,Takaishi H,Takito J,et al. PIAS3 negatively regulates RANKL-mediated osteoclastogenesis directly in osteoclast precursors and indirectly via osteoblasts. Blood,2009,113(10):2202-2212.
[33]O’Brien CA. Control of RANKL gene expression.Bone,2010,46(4):911-919.
[34]Steeve KT,Marc P,Sandrine T,et al. IL-6 RANKL TNF-alpha/IL-1 interrelations in bone resorption pathophysiology. Cytokine Growth Factor Rev,2004,15:49-60.
[35]Liu XH,Kirschenbaum A,Yao S,et al. Interactive effect of interleukin-6 and prostaglandin E2 on osteoclastogenesis via the OPG/RANKL/RANK system.Ann N Y Acad Sci,2006,1068 :225-233.
[36]Taketa T,Sakai A,Tanaka S,et al. Selective cyclooxygenase-2 inhibitor prevents reduction of trabecular bone mass in collagen-induced arthritic mice in association with suppression of RANKL/OPG ratio and IL-6 mRNA expression in synovial tissues but not in bone marrow cells. J Bone Miner Metab,2008,26(2):143-151.
[37]Sanchez C,Gabay O,Salvat C,et al. Mechanical loading highly increases IL-6 production and decreases OPG expression by osteoblasts. Osteoarthritis,2009,17(4):473-481.
[38]Steeve KT,Nathalie A,Pelletier JP,et al. Modulation of OPG,RANK and RANKL by human chondrocytes and their implication during osteoarthritis. Rheumatology,2009,48:1482-1490.
[39]Teiteibaum SL. Osteoclast:what do and how do they do it? Am J Pathol,2007,170(2):427-435.
[40]Krishnan V,Bryant HU,Macdougald OA. Regulation of bone mass by Wnt signaling. J Clin Invest,2006,116:1202-1209.
[41]Marie PJ, Kassem M. Osteoblasts in osteoporosis:past,emerging,and future anabolic targets. Eur J Endocrinol,2011,165:1-10.
[42]Glass DA,Karsenty G. In vivo analysis of Wnt signaling in bone. Endocrinology,2007,148:2630-2634
[43]Johnson ML,Harnish K,Nusse R,et al. LRP5 and Wnt signaling:a union made for bone. J Bone Miner Res,2004,19:1749-1757.
[44]Bodine PV ,Komm BS. Wnt signaling and osteoblastogenesis. Rev Endocr Metab Disord,2006,7:33-39.
[45]Qiu W,Andersen TE,Bollerslev J,et al. Patients with high bone mass phenotype exhibit enhanced osteoblast differentiation and inhibition of adipogenesis of human mesenchymal stem cells. J Bone Miner Res,2007,22 :1720-1731.
[46]Almeida M,Han L,Bellido T. Wnt proteins prevent apoptosis of both uncommitted osteoblast progenitors and differentiated osteoblasts by beta-catenindependent and independent signaling cascades involving Src/ERK and phosphatidylinositol 3-kinase/AKT. J Biol Chem,2005,280:41342-41351.
[47]Kramer I,Keller H,Leupin O,et al. Does osteocytic SOST suppression mediate PTH bone anabolism? Trends Endocrinol Metab,2010,21:237-244.
[48]Rawadi G,Vayssiere B,Dunn F,et al. BMP-2 controls alkaline phosphatase expression and osteoblast mineralization by a Wnt autocrine loop. J Bone Miner Res,2003,18:1842-1853.
[49]Robinson JA,Chatterjee-Kishore M,Yaworsky PJ,et al. Wnt/β-Catenin Signaling Is a Normal Physiological Response to Mechanical Loading in Bone. J Bio Chem,2006,281(42):31720-31728.
[50]Sawakami K,Alexander G, Ai M , e t a l. T h e Wnt co-receptor LRP5 is essential for skeletal mechanotransduction but not for the anabolic bone response to parathyroid hormone treatment. J Biol Chem,2006,281:23698-23711.
[51]Bennett CN,Longo KA,Wright WS,et al. Regulation of osteoblastogenesis and bone mass by Wnt10b. PNAS,2005,102:3324-3329.
[52]Ross SE,Hemati N,Kenneth A,et al. Inhibition of 950-953.
[53]Castellone MD,Teramoto H,Williams BO. Prostaglandin E2 promotes colon cancer cell growth through a Gs-Axin-ß-Catenin signaling axis. Science,2005,310(12):1504-1510.
[54]Fujino H,Srinivasan D,Regan JW. Cellular conditioning and activation of ß-Catenin signaling by the FPB prostanoid receptor. J Biol Chem,2002,277(12):48786-48795.
[55]Buchanan FG,Raymond N. Connecting COX-2 and Wnt in cancer. Cancer cell,2006,(1):6-8.

