新型手性聚酰胺酰亚胺的合成及其热稳定性
杨志勇, 姚金水, 郭瑞宝, 杨 宁, 张 涛
(山东轻工业学院 材料科学与工程学院, 山东 济南 250353)
聚酰胺酰亚胺(PAI)是一类重要的高分子材料,兼有聚酰亚胺的耐热性、耐化学稳定性以及聚酰胺的可加工性和机械性能, 广泛应用于现代工业[1,2]。具有酰亚胺结构的二酸化合物是合成聚酰胺酰亚胺的重要单体,其中以手性氨基酸和酸酐制备的酰亚胺类化合物作为一种新的手性诱导剂,可进一步与其他单体发生缩聚反应,将手性基团引入到大分子结构中,制备手性PAI。
基于氨基酸的手性PAI主链中含有的天然氨基酸结构会使得聚合物容易形成有序结构,从而提高其溶解度[3,4];这种高分子材料同时具有一定的生物相容性和可降解性,可作为环境友好型材料[5~8]。
本文从分子设计的角度出发,将联苯与手性氨基酸有机地结合在PAI分子中: 3,3′,4,4′-联苯四甲酸二酐(1)与L-异亮氨酸(2)在乙酸中反应制得具有联苯酰亚胺结构的手性N,N′-(4,4′-二邻苯二甲酰基)-二[(S)-(+)-异亮氨酸](3);以3和二苯基甲烷二异氰酸酯(4)为单体,通过缩聚反应合成了新型手性聚酰胺酰亚胺(5, Scheme 1)其结构经1H NMR和IR表征。DSC测试结果表明,5在氮气氛中5%失重温度超过370 ℃; 600 ℃时残余质量为60%,显示出良好的热稳定性。
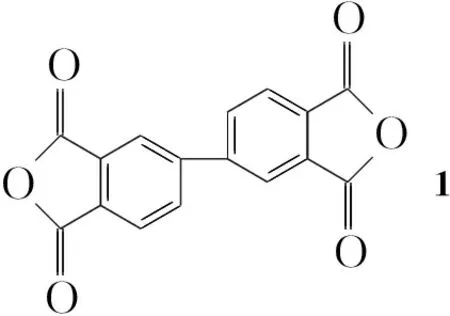
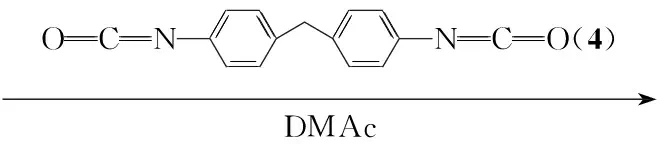
Scheme1
1 实验部分
1.1 仪器与试剂
XRC-1型显微熔点仪;WZZ-2B型数字式自动旋光仪;Bruker AVANCE Ⅱ 400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker TENSOR 27型红外光谱仪(KBr压片);Elementar Vario EL Ⅲ型自动元素分析仪;TGA/SDTA851型差热分析仪(N2, 10 ℃·min-1)。
1(含量>99%),石家庄海利精化有限责任公司;2(含量>99%),上海达瑞精细化学品有限公司;N,N-二甲基乙酰胺,分析纯,使用前经干燥重蒸。
1.2 合成
(1) 手性单体3的合成
(2)5的合成
2 结果与讨论
2.1 3与5的合成
图1为3和5的IR谱图。由图1可见,3在2 700 cm-1~3 500 cm-1处对应的是羧基上的羟基特征吸收峰; 1 775 cm-1与1 710 cm-1处是酰亚胺环羰基的不对称及对称伸缩振动吸收峰,1 379 cm-1处是C-N健的伸缩振动吸收峰,另外1 423 cm-1, 1 462 cm-1, 1 620 cm-1对应的是苯环上骨架振动的吸收峰。结合3的1H NMR和元素分析结果,表明3的结构与预期一致。
从图1还可以发现,5在3 310 cm-1处的酰胺N-H特征吸收峰;1 772 cm-1与1 715 cm-1处的酰亚胺羰基的不对称和对称伸缩振动吸收峰,1 666 cm-1处的酰胺C=O吸收峰,1 375 cm-1处的C-N特征吸收峰,此外1 510 cm-1, 1 535 cm-1, 1 595 cm-1处的苯环骨架振动吸收峰,这充分证明3与4缩聚成功,合成了预期结构的5。

ν/cm-1图 1 3 and 5的IR谱图Figure 1 IR spectra of 3 and 5
2.2 5的热性能
5的TGA曲线见图2。从图2可以看出,5在加热过程中存在两次热分解过程,第一阶段发生在350 ℃左右,可能是由于5中部分酰胺键的断裂所致;第二阶段则发生在480 ℃左右,主要是酰亚胺环的分解所致。在氮气氛中5%失重温度超过370 ℃; 600 ℃时的残余质量百分数接近60%,显示5具有良好的耐热性。
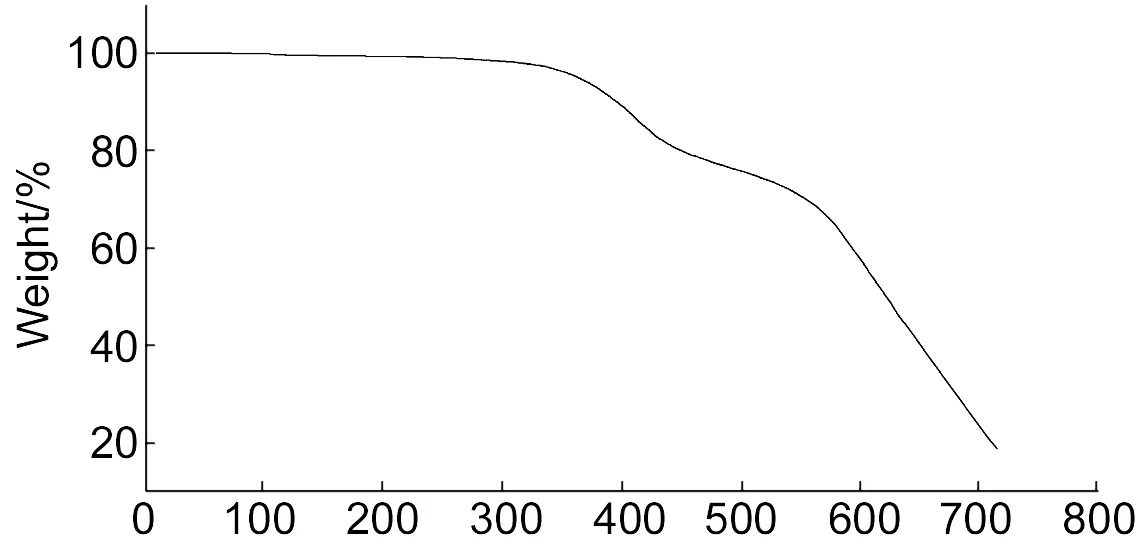
Temperature/℃图 2 5的TGA曲线Figure 2 TGA curve of 5
3 结论
从分子设计的角度出发设计并合成了一种新型的手性聚酰胺酰亚胺,本实验所制备的手性单体与手性聚酰胺酰亚胺显示出较高的旋光性,同时手性聚酰胺酰亚胺结构中存在的刚性的联苯结构赋予了其优良的热稳定性。手性聚酰胺酰亚胺在手性分离与识别、手性液晶以及生物材料等领域具有广泛的应用前景[9~12]。
[1] Shiotani A, Kohda M. Preparation of poly(amide-imide)s derived from biphenyltetrα-carboxylic dianhydride[J].J Appl Polym Sci,1997,63(7):865-873.
[2] Faghihi K H, Mozaffari Z. New polyamides based on 2,5-bis[(4-carboxyanilino)carbonyl]pyridine and aromatic diamines:Synthesis and characterization[J].J Appl Polym Sci,2008,108:1152-1157.
[3] Birchall A C, Bush S M, North M. Copolymerization of peptide derived monomers and methyl methacrylate[J].Polymer,2001,42:375-389.
[4] Sanda F, Endo T. Syntheses and functions of polymers based on aminoacids[J].Macromol Chem Phys,1999,200:2651-2661.
[5] Mallakpour S, Kolahdoozan M. Preparation of new poly(amide-imide)s with chiral architecture via direct polyamidation reaction[J].J Appl Polym Sci,2006,104:1248-1254.
[6] Shina M H, Huangh J W, Huang M C,etal. Synthesis and characterization organosoluble luminescent poly(amide-imide)s[J].Polym Bull,2008,60:597-607.
[7] Butuc E, Gherasim G M. Ordered heterocyclic copolymers:Poly amide-imides withS-triazine rings[J].J Polym Sci,Polym Chem Ed,1984,22:503-507.
[8] Okada M. Chemical syntheses of biodedeg-radable polymer[J].Prog Polym Sci,2002,27:87-133.
[9] Liaw D J, Chang F C, Liu J H,etal. Synthesis and characterization of novel thermally stable and optically active poly(amide-imide)s derived fromN,N′-(4,4′-diphthaloyl)-bis-L-leucine diacid and aromatic diamines[J].J Appl Polym Sci,2007,104:3096-3102.
[10] Okamoto Y E, Yashima E. Polysaccharide derivatives for chromatographic separation of enantiomers[J].Angew Chem Int Ed,1999,37:1020-1043.
[11] Torma V, Gyenes T, Szakács Z,etal. Novel amino acid-based polymers for pharmaceutical applications[J].Polymer Bulletin,2007,59:311-318.
[12] Terada K, Sanda F, Masuda T. Polycondensation of diketopiperazine-based dicarboxylic acids with diamines and dibromoxylenes[J].J of Macro Sci,Part A:Pure and Applied Chemistry,2007,44:789-794.

