氯苯胍在鸡组织中的残留消除规律研究
班付国,吴宁鹏,李慧素,彭 丽,周红霞
(河南省兽药监察所,郑州 450008)
氯苯胍(Robenidine)是一种新型高效合成抗球虫药,自1977年在我国研制成功后,因其疗效显著、毒性小,并具有提高增重和饲料利用率的作用,在兽医上得到广泛应用。氯苯胍分子式为C15H13C12N5,相对分子质量为334,化学名为1,3-双-对氯苯叉氨基胍,结构式如图1。目前,国内外对于氯苯胍在鸡组织中的残留消除趋势的研究较少[1]。本文以鸡为受试对象,对氯苯胍在鸡组织中的残留消除规律作了研究。

图1 氯苯胍化学结构式
1 材料与方法
1.1 试验动物 健康白来杭鸡,SPF级,体重约2 kg,购于河南农业大学。饲养温度10~20℃,每日换水换食,饲养7 d适应环境。
1.2 仪器 超高效液相色谱 -串联质谱仪(Waters公司);SIGMA 3-30K离心机(德国SIGMA公司);Buchi均质器。
1.3 药品与试剂 氯苯胍标准品,含量93.0%,购于德国Dr.Ehrenstorfer Gmbh公司;D8-氯苯胍标准品,含量99.3%,购于德国Sigma-Aldrich公司。甲醇、乙腈为色谱纯。
1.4 给药与采样 选试验用白来杭鸡30只,5只为空白,其他饲喂含氯苯胍500 mg/kg饲料7 d,停药后的第0、1、3、5、7天随机各宰杀5只,取肌肉、肝脏、肾脏、皮和脂肪五种组织分别处理。
1.5 测定方法
1.5.1 标准溶液的配制 精密称取氯苯胍标准品10 mg,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,制成1 mg/mL的标准贮备液。于-18℃保存。
1.5.2 内标溶液的配制(1 mg/mL) 精密称取D8-氯苯胍标准品10 mg,于10 mL容量瓶中,用二甲亚砜溶解后,用甲醇稀释至刻度,制成1 mg/mL的内标储备液。于-18℃保存。
1.5.3 标准曲线 量取标准溶液适量,用85%乙腈稀释,制得浓度为10、20、50、100、200 和500 ng/mL的系列标准溶液(内标溶液均为100 ng/mL),由低浓度到高浓度,供液相色谱-串联质谱仪测定。以标准溶液中被测组分峰与内标物峰面积的比值为纵坐标,标准溶液中被测组分浓度为横坐标,绘制标准曲线。
1.5.4 色谱及质谱条件
1.5.4.1 色谱条件 色谱柱:Acquity UPLC®BEH C18(2.1 mm × 100 mm,1.7 μm);柱温:30℃;流动相:A相为乙腈,B相为0.1%甲酸水溶液,梯度洗脱程序见表1。

表1 梯度洗脱程序
1.5.4.2 质谱条件 电喷雾离子源;正离子扫描;多反应监测;源温度120℃;脱溶剂温度350℃;电离电压3.0 kV;测试药物定性、定量离子对及对应的碰撞能量见表2。
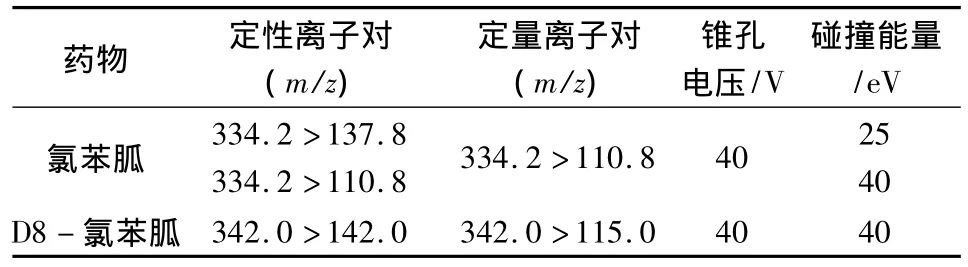
表2 氯苯胍及D8-氯苯胍定性、定量离子对及锥孔电压、碰撞能量
1.5.5 样品前处理 称取均质后(2±0.02)g试料,置于50 mL离心管内,添加100 μL 100 ng/mL内标溶液,加0.1%甲酸乙腈5 mL,涡旋混合,中速振荡10 min,7500 r/min离心10 min,取上清液于另一10 mL离心管内,加水1 mL,混匀。中性氧化铝小柱用乙腈2 mL活化,取全部提取液过柱,收集全部流出液于10 mL玻璃试管中,再用85%乙腈2 mL淋洗,合并流出液,于40℃下氮气吹至体积小于2 mL,再加入水8 mL,备用。HLB固相萃取柱依次用甲醇3 mL、水3 mL活化,取全部备用液过柱并用水3 mL淋洗,抽干30 s,正己烷3 mL淋洗,抽干10 min,甲醇5 mL洗脱,收集洗脱液,于40℃下氮气吹干,残渣用85%乙腈1.0 mL溶解,涡旋,过滤,供液相色谱-串联质谱仪测定。
1.5.6 回收率的测定 在鸡肌肉、鸡肝脏、鸡肾脏组织中添加50、100、200 μg/kg 三个不同浓度,在鸡脂肪、鸡皮中添加 100、200、400 μg/kg三个不同浓度,各浓度进行5个样品平行试验,重复3次,计算回收率。
2 结果
2.1 氯苯胍、D8-氯苯胍的定量及定性确认 氯苯胍、D8-氯苯胍标准溶液、空白试样溶液及空白添加试样溶液特征离子质量色谱图分别见图2-图4。从图中可以看出,氯苯胍在此条件下图谱无干扰。

2.2 线性、检出限、定量限及回收率 以标准溶液中氯苯胍峰与D8-氯苯胍内标峰面积的比值为纵坐标,氯苯胍浓度为横坐标,作线性回归方程为:Y=8.9885X+146.89,相关系数为 0.9985。氯苯胍在10~500 ng/mL的浓度范围内呈现良好的线性关系。五种组织中氯苯胍的检测限均为5 μg/kg,定量限为10 μg/kg。在氯苯胍三个不同添加浓度进行的回收率试验中,氯苯胍在肝脏、肌肉、肾脏、脂肪和皮中平均回收率分别为82.8% ~103.9%,85.0% ~ 107.6%、76.7% ~ 88.3%、80.9% ~91.6%和80.9% ~108.2%(表3)。
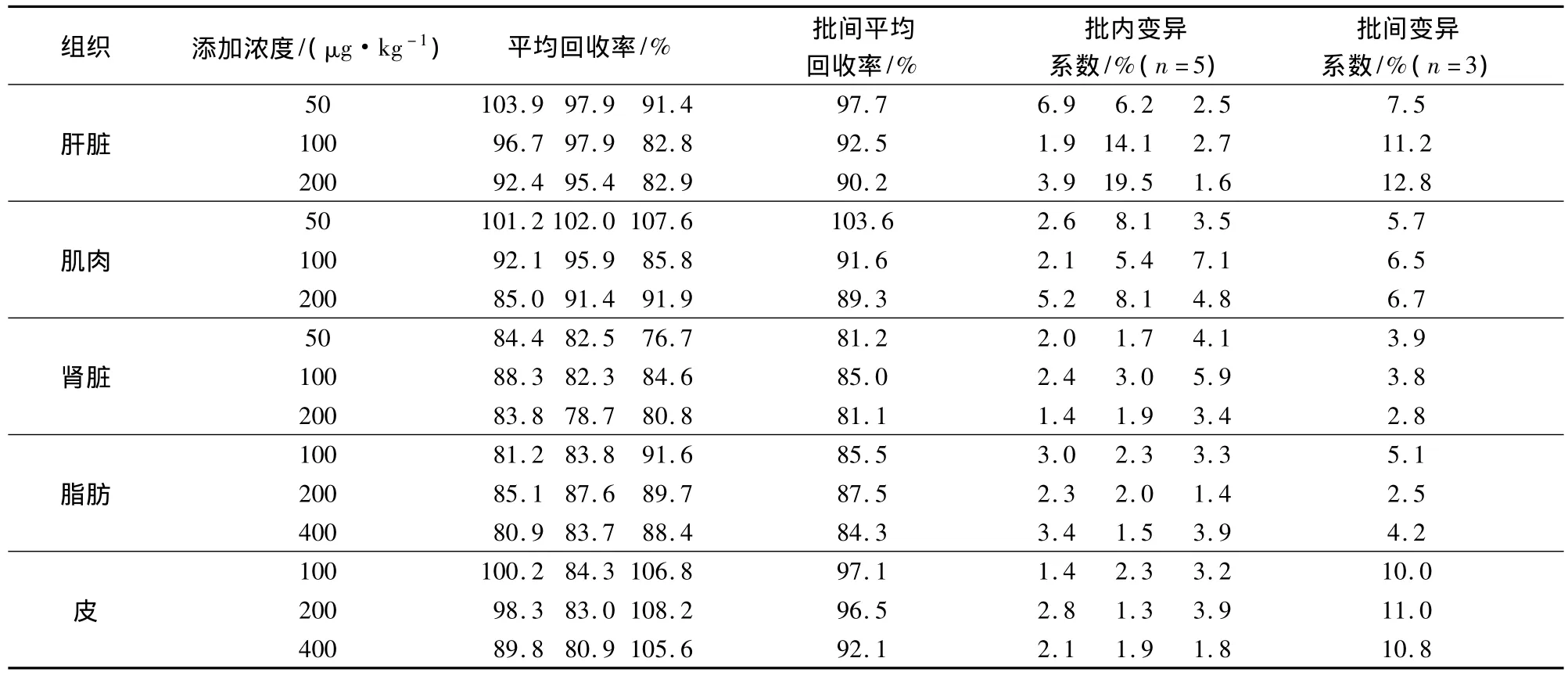
表3 空白鸡组织中氯苯胍添加回收率试验(n=5)
2.3 氯苯胍在五种组织中的残留情况 鸡肌肉、鸡肝脏、鸡肾脏、鸡脂肪和鸡皮中氯苯胍残留随时间的残留变化情况见表4。从表中可以看出,氯苯胍在鸡脂肪中残留量最高,停药第0 d的残留量高达814.4 μg/kg,而在肌肉中的残留量最低,仅为39.4 μg/kg。另外,氯苯胍在肌肉中消除速度很快,在停药后第3天未检出氯苯胍的残留。

表4 鸡组织中氯苯胍的残留浓度 μg/kg
3 讨论
氯苯胍检测方法建立的关键在于样品的净化。文献[2]中报道的净化柱有硅胶柱、阳离子交换柱、C18柱等,通过试验发现,采用HLB固相萃取柱进行净化,可以获得较好的净化效果和较低的批内、批间标准偏差;同时,脂肪和皮肤需要使用中性氧化铝固相萃取柱[3-4]和HLB柱用正己烷淋洗相结合的方法,才能达到较好的净化效果。在此基础上,采用液质联用的方法对五种组织进行了定量分析。
通过饲喂试验发现,鸡肌肉组织在停药后第3天,未检出氯苯胍残留,在停药后第5天,各种组织的残留量均低于农业部235号公告《动物性食品中兽药最高残留限量》的规定[5]。从各组织氯苯胍的残留量上来看,在脂肪中的残留量最高,其次为肝脏,肌肉中的残留量最低。在停药后第7天,除肌肉组织外,其他组织均有检出,表明氯苯胍在鸡体内残留消除较为缓慢。本试验的研究结果对保障消费者身体健康,扩大我国动物食品出口具有重要意义,并对药物代谢动力学研究具有参考价值,为以后的合理用药及制定合理的休药期提供参考。
[1] Mortier L,Huet A C,Daeseleire E,et al.Deposition and depletion of five anticoccidials in eggs[J].Agricultural and Food Chemistry,2005,(53):7142 -7149.
[2] 刘勇军,吴银良,姜艳彬.高效液相色谱法测定鸡组织与鸡蛋中氯苯胍的残留量[J].色谱,2010,28(9):905 -907.
[3] Kot- Wasik A,Wasik A.Determination of robenidine in animal feeds by liquid chromatography coupled with diode-array detection and mass spectrometry after accelerated solvent extraction[J].Analytica Chimica Acta,2005,543:46 -51.
[4] Malgorzata Olejnik,Teresa Szprengier- Juszkiewicz,Piotr Jedziniak.Multi-residue confirmatory method for the determination of twelve coccidiostats in chicken liver using liquid chromatography tandem mass spectrometry[J].Chromatography A,2009,1216:8141-8148.
[5] 农业部235号公告.动物性食品中兽药最高残留限量[Z].2002.

