以肽脱甲酰基酶为靶点的抗结核药物高通量筛选模型的建立和应用
张丽蓉,赵莉莉,魏玉珍,李秋萍,王莉宁,余利岩
结核病是由结核分枝杆菌感染引起的慢性缓发型传染病。结核病曾在全世界广泛流行,夺去了数亿人的生命[1]。异烟肼、利福平等药物的使用一度使得结核病得到了很好的控制和治疗,但近年来AIDS的蔓延和多重耐药结核分枝杆菌的出现使得肺结核的防控形势异常严峻,传统药物已不能满足临床需要[2-7]。因此,亟需加紧新型抗结核药物的研发。
肽脱甲酰基酶(peptide deformylase,PDF)是原核生物蛋白质成熟过程中的一个关键酶,它在蛋白质成熟过程中起关键作用,主要功能就是水解原核生物的新生多肽 N 端甲酰甲硫氨酸的甲酰基。若 PDF 发生突变或缺失,病原微生物则不能生长、繁殖[8]。它在真核生物中并非必需,因此被视为理想的新一代广谱抗生素药物筛选分子靶点之一[9-10]。微生物的次级代谢产物是研制新药的重要资源之一,天然产物来源的PDF 抑制剂报道很少[11-13],这些报道的天然 PDF 抑制剂结构多为非肽类,其抑酶活性和抗菌活性都相对其他类型的化合物要低,天然来源的结核分枝杆菌的PDF 抑制剂还未见报道。本研究通过建立以肽脱甲酰基酶为靶点的高通量筛选模型,期望在微生物次级代谢产物中发现新型酶抑制活性和抗菌活性均较好的抑制剂,为开发有效的新型抗耐药结核分枝杆菌药物奠定基础。
1 材料与方法
1.1 仪器与材料
Veriti 96 well Thermal Cycler PCR 扩增仪为美国 ABI公司产品;ÄKTA pufifierTM10 层析系统为美国 GE Healthcare公司产品;PolarFluostar 多功能荧光检测仪为德国 BMG公司产品;三肽for-Met-Ala-Ser 为瑞士 Bachem公司产品;Actinonin和Fluorescamin 为美国 Sigma公司产品。
菌株大肠杆菌感受态 DH5α和BL21(DE3)购于上海生工生物工程技术服务公司;克隆载体pGEM-T easy 购于美国 Promega公司;表达载体pET-28a 由本室保存;细胞 293T、A549和Raw264.7 由本所免疫室惠赠;结核分枝杆菌 H37Rv基因组DNA 由北京市结核病胸部肿瘤研究所陆宇老师惠赠。
1.2 方法

1.2.2 蛋白表达载体的构建 分别用 NdeI和XhoI 对 T-def和pET-28a 进行双酶切,获得目的基因片段和线性化的pET-28a。用 T4 连接酶在16 ℃ 连接 20 h,连接后的重组质粒命名为pET-28a-def。并用该质粒转化大肠杆菌 DH5α,然后涂布于含有 50 mg/L 卡那霉素的LB 平板上。37 ℃ 培养 16 h 筛选重组子,提取质粒,双酶切鉴定载体的正确性,并测序验证片段的正确性及插入方向的正确性。
1.2.3 重组质粒在大肠杆菌中的诱导表达和纯化 用构建成功的pET-28a-def 质粒转化 BL21(DE3),接种于50 µg/ml 卡那霉素的LB 液体培养基中,37 ℃ 振荡培养至OD600=0.5 时,加入终浓度为0.5 mmol/L的IPTG,于20 ℃、200 r/min 旋转培养过夜,诱导目的蛋白的表达。收获并裂解菌体细胞,通过 SDS-PAGE蛋白电泳检测 PDF 在BL21 中的表达。超声裂解菌体后的裂解液于4 ℃、15000×g 离心 30 min,上清用 0.45 µm 滤膜过滤。使用 ÄKTA 系统对目的蛋白进行分离纯化。
1.2.4 结核分枝杆菌 PDF 抑制剂筛选模型的建立、优化、评价及应用
1.2.4.1 蛋白活性测定 PDF 水解掉甲酰化三肽底物 for-Met-Ala-Ser N 端的甲酰基后,N 端暴露出游离的NH2,游离 NH2与荧光胺反应后所产生的荧光能够用多功能荧光检测仪在激发光 390 nm、发射光 470 nm下检测,荧光强度的变化直接反映了酶活性的强弱[14]。反应体系的总体积为50 µl,其中含有:20 ng PDF 酶、5 mmol/L 底物、0.06 mg/ml荧光胺。酶和底物用 pH 7.4的HEPES 缓冲液稀释及配制,反应 30 min 后加入荧光胺,继续反应5 min 后检测荧光值。
1.2.4.2 筛选样品处理 取 7ml 新鲜发酵液用等体积的丙酮抽提,离心,上清用乙酸乙酯萃取,挥干后用 DMSO 溶解。
1.2.4.3 模型的优化和评价 本研究考察了一系列温度(15~45 ℃)、酶浓度(10~100 ng)、底物浓度(0.1~30 mmol)以及反应时间(2~30 min)对酶活性测定的影响,选择最佳反应条件,对模型进行优化。进一步考察了 DMSO 浓度以及反应体系中各种成分对酶活性的影响。
计算下列指标:

1.2.4.4 孔板的稳定性及均一性评价 将经优化的体系于96 孔板中进行反应,分别设阴性对照和阳性对照交叉排列,每天进行 1 次体系验证,重复 3 d。
1.2.4.5 样品筛选 采用终浓度 1 µmol/L的放线酰胺素作为阳性对照,使用 96 孔板进行微生物发酵样品的筛选。样品和阳性药分别与酶在37 ℃ 预混合 5 min。加入底物反应 30 min 后,再加入荧光胺,检测荧光值大小。酶抑制率计算公式如下:
酶抑制率%=(F阴性对照均值-F样品值)/(F阴性对照均值-F阳性对照均值)×100%
计算出的数值可能大于100%,表明样品对PDF 酶的抑制作用强于阳性样品。
1.2.5 抗耻垢分枝杆菌活性测定 采用平板纸片法(K-B 法)测定抗菌活性,用耻垢分枝杆菌(Mycobacterium smegmatis mc2155)作为检定菌。将耻垢分枝杆菌按 1.5% 接种于分枝杆菌培养基中,倒平板。将加有样品的6 mm的纸片贴于平板上,37 ℃ 培养 24 h 后测量抑菌圈的大小。采用异烟肼作为阳性对照,可观察到明显抑菌圈的被认为是阳性样品。异烟肼:50 μg/纸片;发酵液样品:40 μl 发酵液/纸片。
1.2.6 样品细胞毒性的测定 采用 MTT 法[15]来检测筛选所得的阳性样品对细胞存活的影响情况。本实验测定的细胞包括人肾上皮细胞 293T,人肺腺癌细胞 A549和鼠单核巨噬细胞 Raw264.7,加入的发酵液终浓度为0.5%。细胞存活率计算公式为:

计算出的数值可能大于100%,表明样品中的组分对细胞生长具有促进作用,被认为没有细胞毒性。
2 结果
2.1 目的基因的克隆以及目的蛋白在BL21 中的表达和纯化
构建的表达载体经 NdeI和XhoI 双酶切的电泳结果与预期相符,目的DNA 片段与def 基因实际大小(594 bp)一致。经 DNA 测序结果证明,def 基因序列和插入载体的方向均无误,重组质粒pET-28a-def 构建成功。转入 pET-28a-def的BL21菌株经过 IPTG的诱导,目的蛋白结核分枝杆菌PDF 得到大量表达。蛋白 SDS-PAGE 电泳结果如图 1 所示。
2.2 酶活测定及药物筛选模型的建立、优化和评价
酶活测定结果显示,纯化所得到的PDF 酶具有较高的活性,酶与底物反应所测得的荧光值能达到 10000 左右,可用于后续高通量筛选模型的建立。

图1 PDF的表达和纯化Figure1 Expression and purification of PDF in E.coli
2.2.1 药物筛选模型的建立与优化 考察了一系列温度、酶浓度、底物浓度以及反应时间对酶活性测定的影响(图 2)。反应体系经优化后,酶的最适反应条件为:反应温度 37 ℃;反应时间 30 min;PDF 酶量 20 ng;底物 for-Met-Ala-Ser终浓度5 mmol/L。
利用双倒数作图法,将图 2D 转变为1/[ν]与1/[S]的直线关系,如图 3 所示。从直线与x 轴的截距可以得到 1/Km的绝对值,直线与y 轴的截距可得到 1/Vmax。此图可直观的为酶抑制研究提供易于识别的图形。计算即可得:酶被底物饱和时的最大反应速率Vmax=384.62 F/min,以及米氏常数 Km=0.346 mmol/L。

图2 筛选条件的优化(A:反应温度优化;B:反应时间优化;C:酶量优化;D:底物浓度优化)Figure2 Optimization of screening conditions (A: Optimization of reaction temperature; B: Optimization of reaction time; C:Optimization of enzyme concentration; D: Optimization of substrate concentration)

图3 PDF 米氏常数的测定Figure3 Curve of Michaelis-Menten equation

图4 反应体系中各成分的影响Figure4 Effect of single component on the assay
2.2.2 药物筛选模型的评价:
⑴反应体系中各成分的影响 在反应体系中分别加入缓冲液、底物和酶,检测其对荧光值的影响,结果见图 4。计算该模型的信噪比,S/N=32.41 >3,符合筛选模型的要求。
⑵DMSO 浓度对酶活性的影响 反应体系中分别加入不同浓度梯度的DMSO,观察对反应体系中酶活性的影响(图 5)。结果显示,DMSO 低于2%时,对所测定的荧光值的影响可以忽略不计。所以,本实验在50 µl 反应体系中加入 1 µl的筛选样品。
⑶孔板稳定性和均一性评价 实验结果如图 6显示,数据不存在明显趋势,无明显边缘效应。CV阴性对照=3.78%<20%;CV阳性对照=8.05%<20%;Z′=0.73 >0.4。各项指标均符合高通量模型筛选的要求。
2.3 样品筛选结果

图5 DMSO 浓度对酶活性的影响Figure5 Effect of DMSO concentration on enzyme activity

图6 孔板均一性和稳定性(A:横向排列;B:纵向排列)Figure6 Validation of the screening assay (A: horizontal array; B: vertical array)
共筛选微生物发酵液样品 12400 份。同时进行酶活性的筛选和抗耻垢分枝杆菌活性的筛选,将酶水平初筛抑制率大于30%和复筛抑制率大于50%的样品定为阳性样品,抗菌实验中可观察到明显抑菌圈的被认为是阳性样品。经过筛选,初筛得到阳性样品 497个,占总数的4%。重复 3 次得到阳性样品 33个,占总数的0.27%,其中 8个样品具有抗耻垢分枝杆菌活性(表1)。
2.4 样品细胞毒性检测结果
对最终获得的8个阳性样品分别进行了293T、A549和Raw264.7 细胞毒性的检测,加入的发酵液终浓度为0.5%,计算加入样品后的细胞存活率。如表 2 所示,每个样品的细胞毒性有差异,而单个样品对不同细胞的毒性也存在一定的差异性。其中,样品 I09AA-00657、I10AA-00705和I09AB-02482的毒性较大;I08AA-01782、I09AA-02493、I09AB-00271、I09AB-02487和I09AB-02493的细胞存活率基本为70% 以上,毒性较小,值得进一步深入研究。

表1 阳性样品的抑酶活性及抗菌活性Table1 Inhibitory effect of positive samples
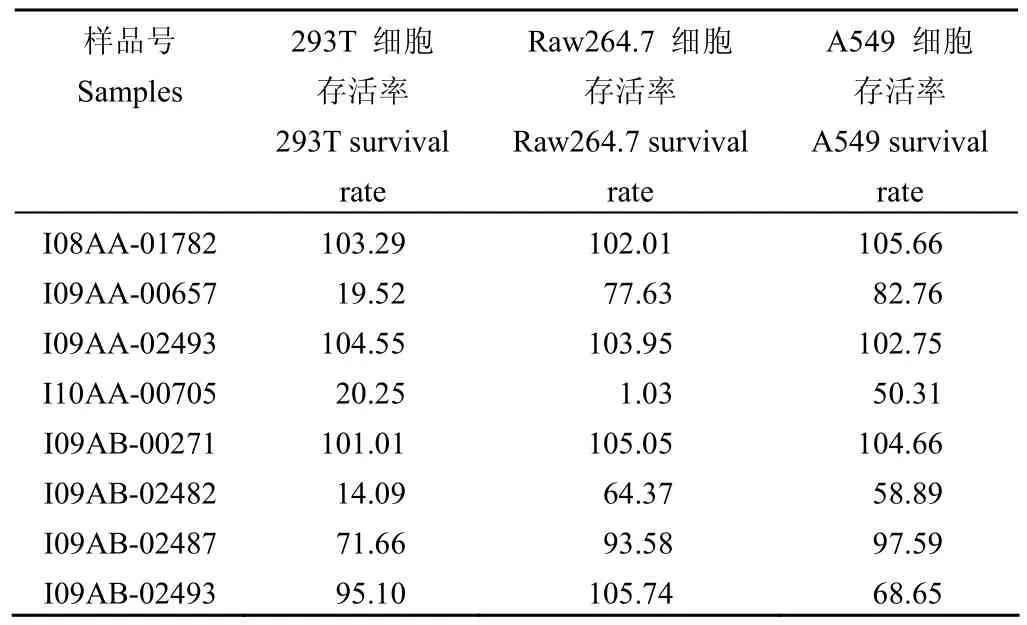
表2 阳性样品的细胞毒性Table2 Cytotoxicity of positive samples
3 讨论
PDF 对原核生物蛋白质的成熟起着关键作用,而在真核生物中并非必需。PDF蛋白的结构很保守,在所有原核生物中同源性都较高。除此之外,PDF蛋白还容易在体内外进行活性分析。良好的毒性选择性和序列的保守性,以及易纯化并测活等特性都使得 PDF 成为较理想的广谱抗生素药物筛选的分子靶点之一,利用本研究建立的筛选模型还有望筛选得到对其他病原微生物具有抑制活性的化合物。
本研究的电泳结果显示,表达得到的目的蛋白大部分存在于沉淀中。尝试了不同的诱导条件,可溶性蛋白表达量均没有得到明显改善。这可能与蛋白本身是非大肠杆菌的外源蛋白有关,其他文献也有此蛋白可溶性较小的报道[16-17]。但由于本研究蛋白用量较小,反应体系中只需加入 20 ng PDF 酶,而纯化 100ml 培养物即可得到 0.28 mg PDF 酶,足够 10000余个样品筛选之用,因此本研究中没有尝试去进一步提高可溶蛋白量的表达。纯化得到的蛋白分子量略大于理论值(20.939 kD),可能与表达的蛋白为含有 His的融合蛋白有关,His 增加了蛋白的分子量。另外,蛋白中脯氨酸残基的存在也可能影响蛋白在SDS-PAGE 电泳中的正常迁移,从而使得与预期值不符。
本研究筛选得到的33个酶水平阳性样品中,只有 8个具有抗耻垢分枝杆菌活性。推测可能的原因为:①活性物质穿透细胞壁或细胞膜的能力较弱,无法有效进入菌体内与目的蛋白作用,生物利用度低;②尽管耻垢分枝杆菌和结核分枝杆菌具有较近的亲缘关系,但两者的PDF 酶氨基酸序列之间还是存在一定的差异性。因此,有必要在以后的工作中,进一步评价这 33个阳性样品的抗结核分枝杆菌活性以及其对耻垢分枝杆菌 PDF 酶抑制活性。这 8个活性样品中有 5个细胞毒性较小。细胞毒性较大的样品也存在活性成分和毒性成分不同一的可能性,将通过后期的分离纯化再次验证。
[1]Khomenko AG.The clinical importance of the drug resistance of Mycobacterium tuberculosis in the practice of controlling tuberculosis(a review of WHO data and of foreign leterature).Probl Tuberk, 1968,46(3):72-78.
[2]Zwolska Z, Augustynowicz-Kopec E.Drug resistant tuberculosis.Pol Merkur Lekarski, 2011, 30(179):362-366.
[3]Banerjee R, Schecter GF, Flood J, et al.Extensively drug-resistant tuberculosis: new strains, new challenges.Expert Rev Anti Infect Ther,2008, 6(5):713-724.
[4]Jain A, Mondal R.Extensively drug-resistant tuberculosis: current challenges and threats.FEMS Immunol Med Microbiol, 2008,53(2):145-150.
[5]Cohn DL, Bustreo F, Raviglione MC.Drug-resistant tuberculosis:review of the worldwide situation and the WHO/IUATLD global surveillance project.International union against tuberculosis and lung disease.Clin Infect Dis, 1997, 24(1):121-130.
[6]Reniero A, Beltrán M, de Kantor IN, et al.AIDS pacient's long-term battle with multiply recurrent tuberculosis: reinfection or reactivation?Rev Argent Microbiol, 2010, 42(4):271-273.
[7]Moroni M, Gori A, Rusconi S, et al.Mycobacterial infections in AIDS:an overview of epidemiology, clinical manifestations, therapy and prophylaxis.Monaldi Arch Chest Dis, 1994, 49(5):432-438.
[8]Meinnil T, Blanquet S.Evidence that peptide deformylase and methionyl-tRNA(fMet)formyltransferase are encoded within the same operon in Escherichia coli.J Bacteriol, 1993, 175(23):7737-7740.
[9]Ferber D.Infectious disease: new weapons in the battle of the bugs.Science, 2002, 18(295):433-434.
[10]Tang XB, Si SY, Zhang YQ.Peptide deformlase as a target for new generation of broad spectrum antimicrobial agents.Chin J New Drugs,2004, 13(12):1093-1098.(in Chinese)唐先兵, 司书毅, 张月琴.新一代广谱抗生素药物筛选靶点肽脱甲酰基酶的研究进展.中国新药杂志, 2004, 13(12):1093-1098.
[11]Chen DZ, Patel DV, Hackbarth CJ, et al.Actinonin, a naturally occurring antibacterial agent, is a potent deformylase inhibitor.Biochemistry, 2000, 39(6):1256-1262.
[12]Kwon YJ, Sohn MJ, Zheng CJ, et al.Fumimycin: a peptide deformylase inhibitor with an unusual skeleton produced by Aspergillus fumisynnematus.Org Lett, 2007, 9(13):2449-2451.
[13]Kwon YJ, Zheng CJ, Kim WG.Isolation and identification of FR198248, a hydroxylated 1,3-dihydroisobenzofuran, from Aspergillus flavipes as an inhibitor of peptide deformylase.Biosci Biotechnol Biochem, 2010, 74(2):390-393.
[14]Tang XB, Si SY, Zhang YQ.The peptide deformylase of enterococcus faecium overexpressed in E.coli BL21(DE3) and the enzymatic activity assay.China Biotechnol, 2004, 24(3):63-66.(in Chinese)唐先兵, 司书毅, 张月琴.肠球菌肽脱甲酰基酶在大肠杆菌 BL21(DE3) 中高效表达及其活性检测.中国生物工程杂志, 2004,24(3):63-66.
[15]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays.J Immunol Methods, 1983, 65(1-2):55-63.
[16]Teo JW, Thayalan P, Beer D, et al.Peptide deformylase inhibitors as potent antimycobacterial agents.Antimicrob Agents Chemother, 2006,50(11):3665-3673.
[17]Saxena R, Chakraborti PK.The carboxy-terminal end of the peptide deformylase from Mycobacteriun tuberculosis is indispensable for its enzymatic activity.Biochem Biophys Res Commun, 2005, 332(2):418-425.

