响应面法优化黑豆皮花色苷提取工艺的研究
卢春晓,吴朝霞,*,徐亚平,张璇,何思,许潇涵
(1.沈阳农业大学食品学院,辽宁 沈阳 110161;2.朝阳工程技术学校食品学院,辽宁 朝阳 122000)
黑豆(Semen glycine)又称橹豆、料豆、零乌豆,是虎耳草科小灌木,全国各地均有栽培,是一种黑色皮的特殊大豆品种。黑豆不仅富含丰富的营养元素,而且还有一定的功能性成分[1]。在中国民间,“醋泡黑豆”是一种经过实践的验证获得了广泛认可的保健食品资源,具有软化血管、改善心血管系统功能、降血压、止咳、补肾益气等功效[2],但其功效成分的组成、生理功效和剂量-效应关系等问题还未能经过科学的、严谨的实验验证[3]。采用乙酸超声波法提取黑豆皮中花色苷[4],在单因素基础上采用响应面分析方法进行参数优化[5],以期为黑豆皮色素的深入研究、开发新保健食品资源及发展食疗养生提供必要的参考。
1 仪器、材料与试剂
1.1 材料与试剂
乌皮黄仁黑豆:沈阳新帝食品有限公司提供。
1.2 仪器
VIS-7220G型分光光度计:北京瑞利分析仪器公司;PHS-25数显pH计:上海雷磁精密仪器厂;电子分析天平:北京赛多利斯天平有限公司;HH-6型数显恒温水浴:国华电器有限公司;KQ-100DB型数控超声波清洗器;RE-52型旋转蒸发仪:上海博通仪器有限公司。
1.3 方法
1.3.1 原料的预处理
将黑豆人工剥皮,将皮烘干至恒重,粉碎,过40目筛后备用。
1.3.2 黑豆皮色素吸收峰的测定
称取0.5 g黑豆皮粉和3.5%乙酸水溶液50 mL,混合后于60℃水浴浸提30 min,将浸提液过滤,稀释到适当浓度,用分光光度计进行光谱扫描[6],测其特征吸收光谱。
1.3.3 黑豆皮提取液中的色素测定[7]
从1.3.2中制备的待测液中吸取1.0 mL,用pH 1.0的HCl-KCl缓冲溶液定容至10 mL,以HCl-KCl缓冲溶液为参比液,在最大吸收波长512 nm处测定吸光值,以吸光值等于1为1个花色苷单位。多次浸提黑豆皮,直至浸提液无色,分别收集各次色素提取液,合并各次提取液,得到总体积(%)和总吸光度值。
1.4 黑豆皮中花色苷的超声波萃取法提取工艺的研究
1.4.1 黑豆皮中花色苷超声波法单因素试验
1.4.1.1 超声波功率对黑豆皮花色苷提取效果的影响
在液料比10∶1,乙酸浓度10%,提取25℃,20 min条件下,研究超声波频率分别为 60、70、80、90、100 W时对黑豆皮花色苷提取效果的影响。
1.4.1.2 溶剂提取浓度对黑豆皮花色苷提取效果的影响
在液料比 10∶1,提取温度 25 ℃,提取 45 min,研究乙酸浓度分别为10%、20%、30%、40%、50%、60%、70%、80%、90%时对黑豆皮花色苷提取效果的影响。
1.4.1.3 提取液料比对黑豆皮花色苷提取效果的确定
在乙酸浓度为30%,提取温度30℃条件下,研究液料比分别为 8∶1、9∶1、10∶1 时对黑豆皮花色苷提取效果的影响。
1.4.1.4 提取温度对黑豆皮花色苷提取效果的影响
在乙酸浓度为30%,液料比为10∶1,提取时间45 min条件下,研究在20、30、40、50℃下对黑豆皮花色苷提取效果的影响。
1.4.1.5 提取时间对黑豆皮花色苷提取效果的影响
加入浓度30%的乙酸,液料比10∶1,在30℃,时间10、20、30 min下对黑豆皮花色苷提取效果的影响。
1.4.2 响应面实验
利用单因素试验结果,以超声波功率、乙醇浓度、料液比、提取时间和提取温度等5个因素,使用Design-ExpertSoft-are6.0软件设计29个实验点的响应面分析实验[8]。试验设计水平因素见表1。

表1 超声波萃取法提取黑豆皮中花色苷的响应面试验设计水平因素Table 1 Ultrasonic wave extraction method withdraws in the black dried bean curd the variety glucoside response to interview examines the design horizontal factor
2 结果与分析
2.1 黑豆皮色素含量的测定
经测定,黑豆皮色素的吸收峰在512 nm处;以黑豆皮色素溶液浓度为横坐标,吸光度为纵坐标作出黑豆皮色素含量测定标准曲线,其回归方程为:y=0.9636x-0.0268,R2=0.9995,线性关系良好。结果见图1。

图1 黑豆皮色素标准曲线Fig.1 Standard curve of anthocyanins in black soybean hull
2.2 超声波萃取法提取黑豆皮中花色苷的提取工艺研究
2.2.1 超声波法提取黑豆皮中花色苷的影响因素研究
2.2.1.1 超声波功率对黑豆皮中花色苷提取效果的影响超声波功率对黑豆皮中花色苷提取效果的影响,
见图2。
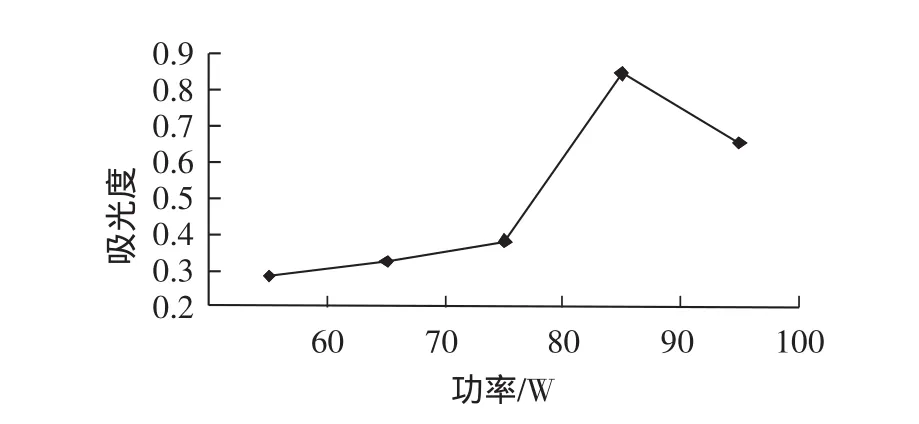
图2 超声功率对黑豆皮中花色苷提取的影响Fig.2 Effect of ultrasonic power on the extraction of anthocyanins in black soybean hull
从图2可以看出,随着超声波功率的提高,吸光度值有所增大,在90 W时达到峰值后,吸光度值开始慢慢变小。如果超声波功效太小,细胞破碎不完全,花色苷释放不完全;而功率太大时,会在提取时间内产生并聚集大量的热量,破坏花色苷的结构,不利于花色苷的提取[9]。所以90 W条件下的提取效果较佳。
2.2.1.2 提取浓度对黑豆皮中花色苷提取效果的影响
提取浓度对黑豆皮中花色苷提取效果的影响,见图3。

图3 提取浓度对黑豆皮中花色苷提取的影响Fig.3 Effect of solvent concentration on extraction of anthocyanins in black soybean hull
由图3可见,浓度的大小直接影响吸光度的大小。乙酸浓度由10%到30%范围内吸光度值随着浓度的增大而增大;而后随着浓度的逐渐上升,吸光度值缓慢下降。醋酸是一种挥发性酸,浓度过高,极性也随之发生变化,反而不利于花色苷的溶解和提取[10]。因此当提取浓度为30%左右时,可达到较为理想的花色苷提取效果。
2.2.1.3 液料比对黑豆皮中花色苷提取效果的影响
液料比对黑豆皮中花色苷提取效果的影响,见图4。
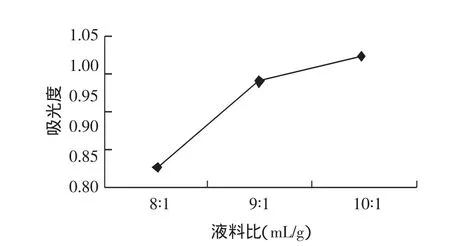
图4 液料比对黑豆皮中花色苷提取的影响Fig.4 Effect of ratio of solvent and material on extraction of anthocyanins in black soybean hull
从图4中可以看出,吸光度值随着料液比的增大而增大,乙酸和黑豆皮色素的比例越大色素中有效成分溶解越多,因为溶剂用量达到一定程度时,花色苷已基本全部溶出[11],再增加溶剂用量也不会有更好的效果,反而会浪费原料并给后续的纯化、干燥等工艺增加困难。因此,在本试验中,液料比为10∶1时的提取效果较为理想。
2.2.1.4 提取温度对黑豆皮中花色苷提取效果的影响
提取温度对黑豆皮中花色苷提取效果的影响,见图5。
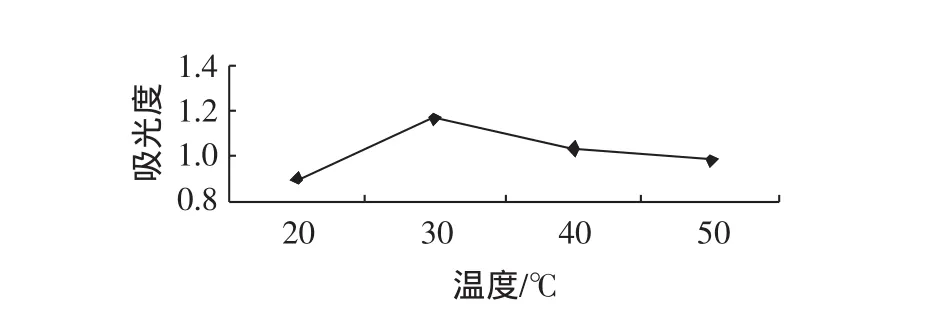
图5 提取温度对黑豆皮中花色苷提取的影响Fig.5 Effect of temperature on extraction of anthocyanins in black soybean hull
从图5中可以看出,温度由低升高时吸光度值先增大后减少,当温度升到30℃吸光度值达到最大值。这主要是由于超声波的空化作用本身会在局部产生高温高压[12],虽然本试验总体提取温度都不是很高,但由于是在超声波辅助提取的条件下,也会或多或少影响花色苷的稳定性,因此吸光度会有所下降。
2.2.1.5 提取时间对黑豆皮中花色苷提取效果的影响
提取时间对黑豆皮中花色苷提取效果的影响,见图6。
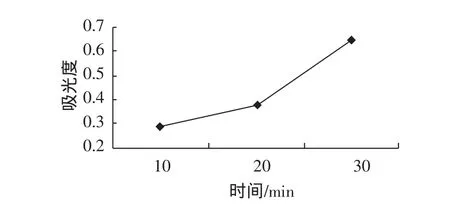
图6 提取时间对黑豆皮中花色苷提取的影响Fig.6 Effect of time on extrction anthocyanins in black soybean hull
从图6可以看出,随着时间的增加,吸光值逐渐呈上升的趋势,当提取时间到达30 min以后,吸光值基本保持不变。主要是因为超声时间较短时,花色苷不易溶出[13],从节省能源的角度考虑,提取时间在30 min提取效果最佳。
2.2.2 多因素响应面试验结果
2.2.2.1 超声波响应面试验结果与方差分析
超声波响应面试验结果与方差分析,见表2。
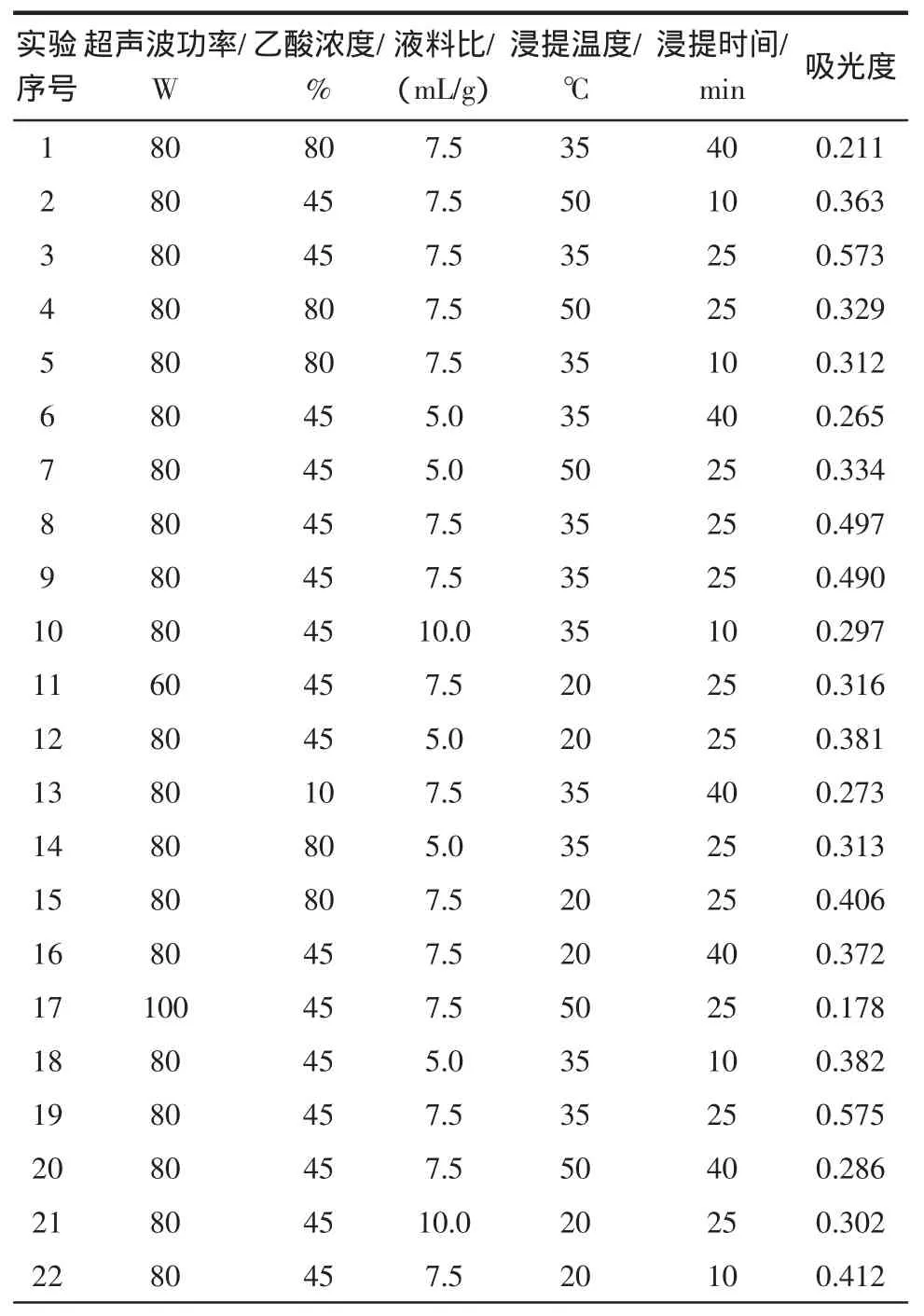
表2 超声波萃取黑豆皮中花色苷的响应面数据表Table 2 Ultrasonic extraction of anthocyanins from black hull by response surface methodology
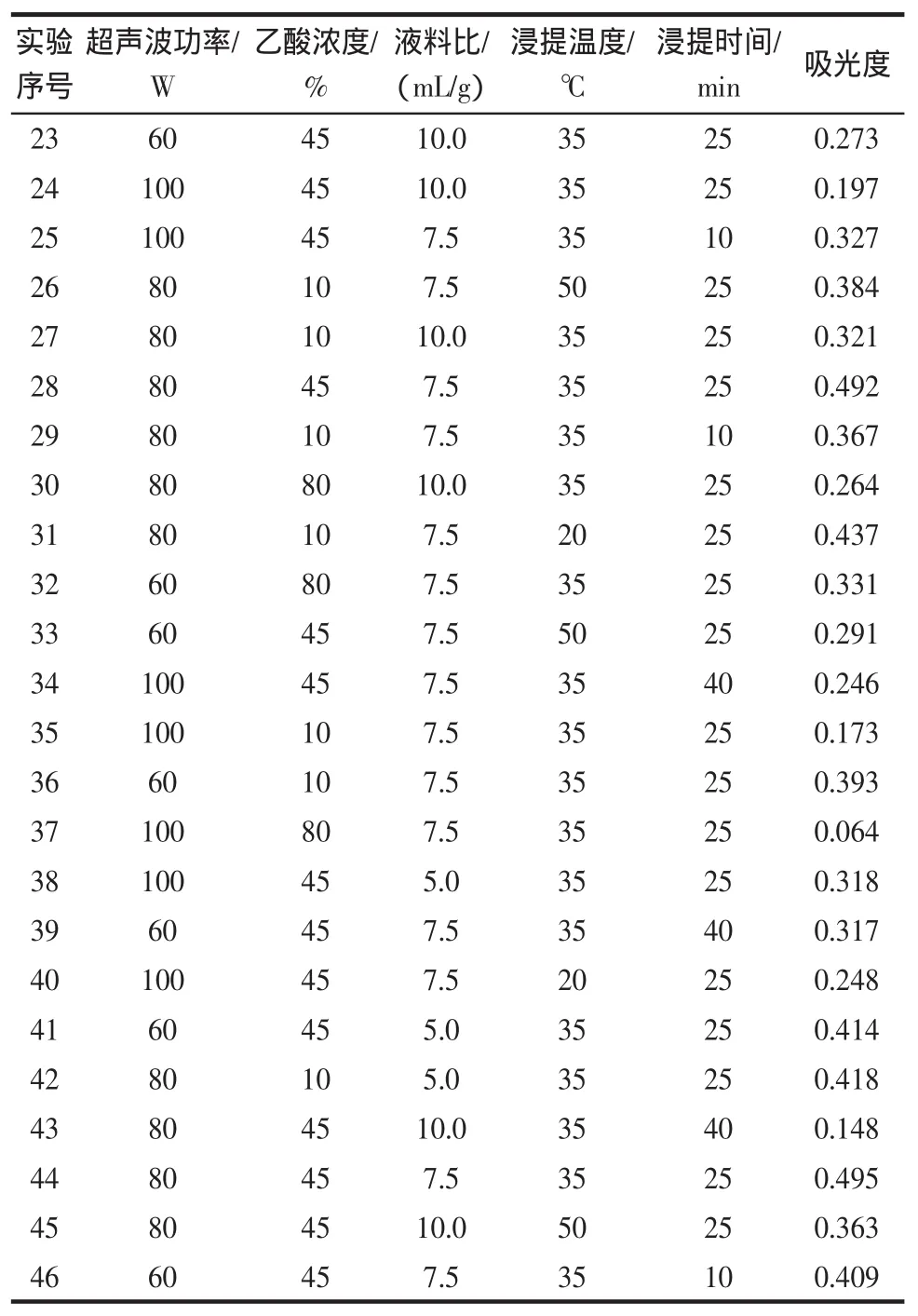
续表2 超声波萃取黑豆皮中花色苷的响应面数据表Continue table 2 Ultrasonic extraction of anthocyanins from black hull by response surface methodology
由上述结果,经分析,花色苷吸光度的数学模型如下:
吸光度=-2.96434+0.055844×A+(7.40017E-003)×B+0.19761×C+0.019187×D+0.022359×E-(1.67857E-005)×A×B+(1.00000E-004)×A×C-(3.75000E-005)A×D+(9.16667E-006)×A×E+(1.37143E-004)×B×C-(1.14286E-005)×B×D-(3.33333E-006)×B×E+(7.20000E-004)×C×D-(2.13333E-004)×C×E-(4.11111E-005)×D×E-(3.61615E-004)×A2-(8.39966E-005)×B2-0.016543×C2-(3.06944E-004)×D2-(4.60648E-004)×E2
式中:A为超声波功率,W;B为乙酸浓度,%;C为液料比,(mL/g);D 为浸提温度;E 为浸提时间,min。
通过方差分析,模型的P<0.01,响应面回归模型达到显著水平[14]。逐项显著性检验结果表明,超声波的功率、乙酸浓度、液料比、浸提温度、浸提时间相互作用对黑豆中花色苷提取影响显著。超声波乙酸提取黑豆皮中花色苷的最佳工艺参数为超声波功率90 W,乙酸浓度30%,液料比10∶1,提取温度30℃,提取时间为30 min,得率预测值为0.659%;在该条件下,黑豆皮中花色苷提取率验证值为0.575%,与预测值的相对误差为0.084%。
3 讨论
近年来,超声波辅助提取方法在天然产物研究中已经得到了越来越广泛的应用[15]。花色苷类的成分在氧、光照、较高温度下通常不够稳定[16],因此在提取技术上,为保证有效成分不破坏、不分解,对技术有特殊的要求。超声波萃取时处理温度较低,可有效控制那些具有热不稳定性功效成分的分解损失;通过促使细胞破壁,可有效提高功效成分的提取率;超声波处理另一优势是作用时间较短,本试验中超声波萃取30min即可获最佳提取率,仅为水煮、醇沉法的三分之一或更少,在实际生产中具有重要的意义;此外,超声波萃取还具有安全性好、操作简单易行、维护保养方便、萃取效率高、适用性广、能耗低等优点,是一项具有广阔前景的应用技术之一。
超声波辅助提取中,如能与酶共同作用,可能会更有利于花色苷的充分溶出,而本试验提取的温度较为接近酶的适宜作用温度,可能会有效提高花色苷的提取率,有待进一步研究。该试验同时也为我国传统“醋泡黑豆”中活性成分的研究提供了一定的参考。
4 结论
以超声波辅助提取黑豆皮花色苷色素的工艺中,超声波功率、乙酸溶液的浓度、提取时间、提取温度、液料比等因素均对花色苷提取率有一定的影响。在单因素试验基础上,通过二次回归设计得到了黑豆皮中花色苷乙酸超声波提取率与超声功率、超声温度、超声时间、液料比关系的回归模型,经检验证明该模型是合理可靠的,能够较好的预测黑豆皮中花色苷的超声提取率。利用模型的响应面及其等高线,对影响黑豆皮中花色苷超声提取的关键因素及其相互作用进行探讨,超声波乙酸提取黑豆皮中花色苷的最佳工艺参数为超声波功率90 W,乙酸浓度30%,液料比10∶1,提取温度30℃,提取时间为30 min,得率预测值为0.659%;在该条件下,黑豆皮中花色苷提取率验证值为0.575%,与预测值的相对误差为0.084%。
[1]董李平,吴珍龄.黑豆皮醇提物清除自由基效果的研究[J].西南农业大学学报,2002(5):445-449
[2]崔堂兵,石漫莹,郭勇,等.银杏黄酮的提取与大孔树脂吸附研究[J].广西农业生物科学,2002,21(4):265,269
[3]曹小勇,李新生.黑米花色素甙类色素研究现状及展望[J].氨基酸和生物资源,2002,24(1):3-6
[4]陈在新,李俊凯,陈义全.分光光度法测定板栗黄酮含量[J].果树学报,2003,20(2):149-151
[5]戴启广,陈国平,王幸宜.新型甜味耕一二氢查尔酮衍生物[J].精细化工中间体,2004,34(3)7-9
[6]王海堂.黑豆色素的提取工艺、理化性质研究和应用[J].洛阳工学院报,1998(6):213-216
[7]刘小玲,许时婴,王璋.火龙果色素的基本性质及结构鉴定[J].无锡轻工大学学报,2003,22(3):62-65
[8]夏明,杜琪珍.天然红色素研究进展[J].食品研究与开发,2002(6):38-41
[9]Bermfldez-Soto M J,Tomas-Bfll-bcm F A.Evaluation of Commercial Red Fruit Juice Concentrates as Ingredients for Antioxidant Functional Juice[J].European food research and technology,2004(2):133-141
[10]徐渊金,杜琪珍.花色苷分离鉴定方法及其生物活性[J].食品与发酵工业,2006(3):66-67
[11]Robak J,Grgglewesik R J.Flavonoids as Scavengers of Superoxide Anion[J].Biochem Pharmacol,1988(37):837-841
[12]Hsieh R J G,Kinsella.Antioxidant:Flavonoids in Adv[J].Food Nutr Res,1989(33):233-241
[13]张萍,王玉珠,李红宁.荞麦中生物类黄酮的提取方法研究[J].食品研究与开发,2006(2):45-47
[14]周如梅.超临界萃取技术在天然产物中的应用[J].企业技术开发,2005(7):15-17
[15]赵伯涛,钱骅,张卫明,等.黑莓榨汁残渣中花色素的提取纯化、稳定性及功能研究[J].食品科学,2005(9):157-159
[16]Hus Qin S R J,Cillard P C.cillard.Hydroxyl Scavenging Activity of flavonoids[J].lbid,1987(26):2487-2491
——营养
——去皮

