姜辣素对顺铂致大鼠异嗜模型行为的作用
王茂龙,杨玉玲,魏朝霞,岳 旺,徐万群
(青岛大学医学院附属医院1.胸外科、2.感染科,山东 青 岛 266003;3.青岛大学医学院药理学教研室,山东青岛 266021;4.青岛大学医学院附属医院急诊内科,山东 青 岛 266003)
呕吐是机体的保护性反射,可由多种因素诱发,肿瘤化疗是最常见的原因之一,高致吐性化疗药顺铂是良好的动物模型致吐剂。人类呕吐化学感受器触发区(chemoreceptor trigger zone,CTZ)位于延髓背面极后区(the area postrema,AP)内,与迷走神经背核邻近,顺铂刺激后5-HT、P物质等经血液循环至AP区可以刺激CTZ引起呕吐。大鼠虽无呕吐反射,但延髓亦具有AP区,其作用与CTZ相似,使用顺铂后,5-HT、P物质等化学物质作用于CTA,可以产生条件味觉厌恶(conditioned taste aversion,CTA)反应,使大鼠产生异嗜高岭土的行为,其异嗜高岭土的程度可间接反映呕吐的程度[1]。
生姜作为传统中药已有一千多年的历史,有“止呕圣药”之美誉,姜辣素(gingerol)是生姜提取物之一,其主要成分有[2]-、[4]-、[6]-姜酚和姜烯酚[2-3]等,止吐效果已得到广泛研究。地塞米松有良好的止吐作用,可联合5-HT3受体阻滞剂及NK1受体阻滞剂应用[4],但其具体作用机制尚不清楚。
本研究观察姜辣素抑制顺铂所致的大鼠异嗜高岭土行为,并观察大鼠AP区神经元和回肠末端神经节c-fos蛋白的表达。
1 材料与方法
1.1 药品和试剂 姜辣素(宝鸡宏远生物制药,批号2005071223)溶于质量分数为1%的西黄耆胶;顺铂(齐鲁制药,批号903005CE)溶于50℃温生理盐水;盐酸昂丹斯琼注射液(奥赛康制药,批号090102);阿瑞吡坦(Chemvon生物制药,批号CV2910A006095)溶于质量分数为1%的西黄耆胶;磷酸地塞米松钠注射液(鲁抗制药,批号090717302);兔抗c-fos试剂盒(北京博奥森生物bs0469R)。
1.2 动物试验 健康♂成年Wistar大鼠[华中科技大学实验动物中心,SCXK(鄂)2004-0007]36只,体质量200~250 g,室温(22±2)℃,单笼饲养,12 h明暗周期(18:00~6:00为暗周期)。随机分成6组:空白组、模型组、昂丹司琼+地塞米松组、阿瑞吡坦+地塞米松组、姜辣素组及姜辣素+地塞米松组。顺铂(3 mg·kg-1)腹腔注射(ip)造模,并于顺铂注射前1 h及注射后24 h、48 h各组分别给予以下处理:生理盐水(10 mg·kg-1,ig)、西黄芪胶(10 ml·kg-1,ig)、昂丹司琼(4 mg·kg-1,ip)+ 地塞米松(5 mg·kg-1,ip)、阿瑞吡坦(8 mg·kg-1,ig)+ 地塞米松(5 mg·kg-1,ip)、姜辣素(400 mg·kg-1ig)、姜辣素(400 mg·kg-1,ig)+ 地塞米松(5 mg·kg-1,ip);观察顺铂注射后0~24 h、48 ~72 h各组大鼠摄食量和啃食高岭土量。72 h后处死大鼠,取AP区及回肠末端(距回盲瓣约20 cm)组织于4%的甲醛4℃固定。
1.3 免疫组化和图像分析 将组织石蜡包埋,切片,严格按照抗c-fos免疫组化试剂盒说明操作。常规漂洗,抗体封闭,加1∶200稀释的兔c-fos多克隆抗体,漂洗后加生物素化二抗,显色,复染,脱水,透明,中性树胶封片。200倍光镜下随机选取5个视野并照相,观察外周回肠及AP区组织阳性产物的染色情况。黄光源下为浅黄色背景,标记阳性颗粒在细胞质表达,呈棕黄色或棕褐色。用奥林巴斯图像分析系统计算阳性细胞灰度值(0代表强阳性,255代表阴性)。
2 结果
2.1 嗜高岭土量 分别记录0~24 h、48~72 h各组大鼠啃食高岭土量。两个时间段内,模型组啃食高岭土量明显高于正常组(P<0.01)。0~24 h,各治疗组啃食高岭土量低于模型组(P<0.05)。姜辣素组及姜辣素+地塞米松组啃食高岭土量与昂丹斯琼+地塞米松组相比差异无显著性。48~72 h,阿瑞吡坦+地塞米松组、姜辣素组、姜辣素+地塞米松组与模型组相比均减少(P<0.05)。姜辣素组、姜辣素+地塞米松组啃食高岭土量低于阿瑞吡坦+地塞米松组(P<0.05),两个时间段内,姜辣素组与姜辣素+地塞米松组啃食高岭土量差异无显著性。
2.2 摄食量 分别记录0~24 h、48~72 h各组大鼠摄食量。两个时间段内,模型组与正常组相比摄食量减少(P<0.01)。0~24 h,姜辣素组进食量高于昂丹司琼+地塞米松组和模型组(P<0.05),姜辣素+地塞米松组进食量高于模型组(P<0.05),与昂丹司琼+地塞米松组比较无差异;姜辣素组进食量高于姜辣素+地塞米松组(P<0.05)。48~72 h,姜辣素组摄食量高于模型组和阿瑞吡坦+地塞米松组(P<0.05)。姜辣素+地塞米松组与模型组比较差异无显著性。

Tab 1 The kaolin and food ingestion and c-fos immunoexpression of rats in every group
2.3 c-fos表达 c-fos阳性颗粒在回肠末端组织表达于肌间神经节(Fig 1),在AP区表达于神经元(Fig 2)。模型组阳性颗粒灰度值低于正常组(P<0.01)。与模型组相比,其余4组阳性颗粒灰度值均增加(P<0.05)。昂丹司琼+地塞米松组、姜辣素组灰度值均低于阿瑞吡坦+地塞米松组(P<0.05),姜辣素+地塞米松组灰度值与阿瑞吡坦+地塞米松组比较差异无显著性。姜辣素组灰度值低于姜辣素+地塞米松组(P<0.05)。

Fig 1 Immunoexpression for c-fos in the ileum of rats in every group(HE×200)
3 讨论
化疗诱发的恶心呕吐反应(chemotherapy-induced nausea and vomiting,CINV)按发生时间不同可分为预期性、急性和迟发性三大类[5]。急性恶心呕吐(acute CINV)发生于化疗开始后24 h内,即本实验的第0~24 h期。研究表明,神经递质5-HT及其受体-3在急性CINV期起主要作用[7],临床常用选择性5-HT3受体拮抗剂(昂丹斯琼等)对急性期CINV有良好治疗作用[8]。本实验选用昂丹斯琼联合地塞米松作为阳性药物对照,比较了姜辣素及其联用地塞米松在急性CINV期的抗呕吐效果。迟发性CINV一般发生于化疗后24~48 h后,有时可持续长达1周,相当于本实验的48~72 h时期。上世纪90年代开始发现神经激肽P物质及其受体NK1在迟发CINV中具有重要作用[9],本实验选用选择性NK1受体拮抗剂阿瑞吡坦联合地塞米松作为另一阳性药物对照,比较姜辣素及其联用地塞米松在迟发性CINV期的抗呕吐效果。
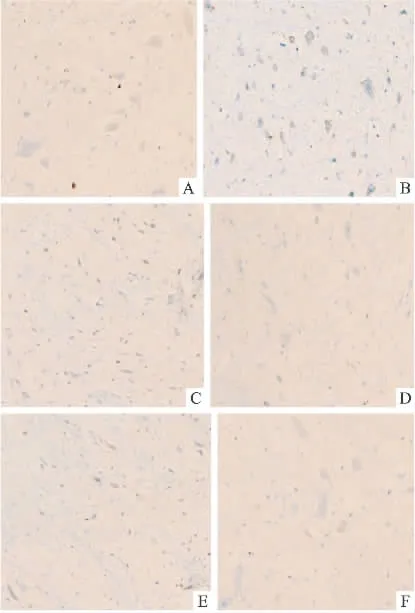
A:The immunoexpression for c-fos in the AP of the blank control group was light;B:The immunoexpression for c-fos was significant in model group;C:The change of immunoexpression for c-fos in Ondansetron+D group was significant compared with blank control group;D:The change of immunoexpression for c-fos in aprepitant+D group was not significant compared with blank control group;E:The changes of immunoexpression for c-fos in gingerol and gingerol+D groups were similar compared with aprepitan+D group and blank control group.
多项动物实验结果表明生姜可抑制顺铂所致恶心呕吐[10-11],亦有临床研究证实生姜可有效改善顺铂化疗患者的恶心呕吐情况[12]。生姜抗呕吐作用主要有效成分为姜辣素,是[6]-、[8]-、[10]-姜酚(gingerol)和[6]-、[8]-、[10]-姜烯酚(shogaol)等的混合物[2-3],其作用机制最初认为是可阻断 5-HT3受体[13],后证实其抑制5-HT3受体的功能并非与5-HT3受体竞争性结合,而是作用于一个调节性位点,此位点可调节P物质受体和胆碱能受体表达[14],也有研究证实姜辣素可作用于辣椒素受体(VR1)[15],因此,姜辣素通过作用于多种受体发挥抗呕吐作用。本研究显示在0~24 h内,姜辣素、姜辣素+地塞米松组啃食高岭土量与昂丹斯琼+地塞米松组相比差异无显著性,即无论是否联用地塞米松,姜辣素与昂丹斯琼联用地塞米松抗呕吐效果相当,先前实验亦证明姜辣素可通过下调5-HT表达抑制急性期CINV[16]。阿瑞吡坦+地塞米松组啃食高岭土量多于昂丹斯琼+姜辣素组,因阿瑞吡坦为选择性NK1受体拮抗剂,对主要由5-HT引起的急性期CINV作用较弱,故美国临床肿瘤学会(ASCO)肿瘤化疗抗呕吐指南中指出,阿瑞吡坦需与5-HT3受体拮抗剂联合应用以增强其抗呕吐效果[4]。姜辣素联用地塞米松与单用姜辣素相比食高岭土量差异无显著性,说明地塞米松对姜辣素治疗急性呕吐无辅助作用。在48~72 h内,姜辣素组、姜辣素+地塞米松组与阿瑞吡坦+地塞米松组相比食高岭土量减少,即姜辣素抗呕吐效果优于阿瑞吡坦+地塞米松,其原因可能是阿瑞吡坦是单一NK1受体拮抗剂,而姜辣素可通过作用于多种介质及受体联合发挥抗呕吐作用[8]。姜辣素组与姜辣素+地塞米松组食高岭土量差异无统计学意义,提示地塞米松对姜辣素治疗迟发性呕吐也无辅助作用。
生姜被证实可逆转顺铂引起的胃排空障碍[17],增加胃动力[18],促进食欲[19]。本研究中姜辣素组大鼠进食量较模型组增加,说明姜辣素作为生姜的有效止吐成分,可促进大鼠进食。也有学者认为生姜对胃动力的促进作用是其止吐机制之一[20]。姜辣素+地塞米松组24 h内比模型组摄食量增加,但48~72 h期间,该组大鼠摄食量与模型组差异无显著性,其原因尚不清楚。
c-fos存在于中枢和外周神经系统,中枢神经细胞受刺激后,引起 c-fos、c-jun转录,翻译成 fos、jun等磷蛋白,形成同源或异源二聚体激活蛋白-1(AP-1),调节靶基因编码,进而导致CNS形态、结构和功能长时程的改变[21]。研究发现,给哺乳动物注射催吐药物后可引起脑内 c-fos蛋白表达增加[22-23],给予5-HT3受体拮抗剂预处理可使急性期c-fos表达减少[24],说明c-fos表达可以从组织学角度反映呕吐行为的严重程度。本实验通过测定延迟期c-fos的表达,进一步证实姜辣素在延迟期抑制大鼠异嗜行为的效果。顺铂注射后大鼠AP区神经元及回肠末端肌间神经节c-fos表达均增加。治疗组c-fos表达较模型组均减少,其中阿瑞吡坦+地塞米松组、姜辣素组、姜辣素+地塞米松组c-fos表达均少于昂丹斯琼+地塞米松组,说明阿瑞吡坦及姜辣素抑制延迟性呕吐的作用强于昂丹斯琼。姜辣素联用地塞米松后c-fos表达少于单用姜辣素组,此结果与两组大鼠食高岭土量结果有差异,原因尚需进一步研究。
综上所述,姜辣素是从天然食用品生姜中提取的有效成分,毒副作用小,无须与地塞米松联合应用,即对类似于人类呕吐的大鼠异嗜模型急性期及延迟期均有抑制作用,并可以促进大鼠摄食,有利于改善营养状况,是一种具有临床实用价值的新型止吐药物。
[1]Takeda N,Hasegawa S,Morita M,et al.Pica in rats is analogous to emesis:an animal model in emesis research[J].Pharmacol Biochem Behav,1993,45(4):817-21.
[2]Kawai T,Kinoshita K,Koyama K,et al.Anti-emetic principles of Magnolia obavata bark and Zingiber officinale rhizome[J].Planta Med,1994,60:17-20.
[3]Yang Y,Kinoshita K,Koyama K,et al.Structure-antiemetic activity of some diarylheptanoids and their analogues[J].Phytomedicine,2002,9:146-52.
[4]Kris M G,Hesketh P J,Somerfield M R,et al.American society of clinical oncology guideline for antiemetics in oncology:Update 2006[J].J Clin Oncol,2006,24(18):2932-47.
[5]Licitra L,Spinazzw S,Roila F.Antiemetic therapy[J].Crit Rev Oncol Hematol,2002,43(1):93-101.
[6]赵忠斌,魏振平,芮 伟.化疗止吐临床治疗药物新进展[J].
世界临床药物,2006,27(8):480-4.
[6]Zhao Z B,Wei Z P,Rui W.The research of clinical anti-emetic medicines[J].World Clin Drugs,2006,27(8):480-4.
[7]Endo T,Minami M,Hirafuji M,et al.Neurochemistry and neuropharmacology of emesis-the role of serotonin[J].Toxicology,2000,153:189-201.
[8]Kris M G,Hesketh P J,Herrstedt J,et al.Consensus proposals for the prevention of acute and delayed vomiting and nausea following high-emetic-risk chemotherapy[J].Support Care Cancer,2005,13:85-96.
[9]Kris M G,Roila F,DeMulder P H,et al.Delayed emesis following anticancer chemotherapy[J].Support Care Cancer,1998,6(3):228-32.
[10]Frisch C,Hasenohrl R U,Mattern C M,et al.Blockage of lithium chloride-induced conditioned place aversion as atest for antiemetic agents:comparison of metoclopramide with combined extracts of Zingiber officinale and Ginkgo biloba[J].Pharmacol Biochem Behav,1995,52:321-7.
[11]Sharma S S,Kochupillai V,Gupta S K,et al.Antiemetic efficacy of ginger(Zingiber officinale)against cisplatin-induced emesis in dogs[J].J Ethnopharmacol,1997,57:93-6.
[12]Hickok J T,Roscoe J A,Morrow G R,et al.A phase Ⅱ/Ⅲ randomized,placebo-controlled,double-blind clinical trial of ginger(Zingiber officinale)for nausea caused by chemotherapy for cancer:a currently accruing URCC CCOP cancer control study[J].Suppportive Cancer Therapy,2007,4(4):247-50.
[13]Yamahara J,Huang Q R,Iwamoto U,et al.Active components of ginger exhibiting antiserotonergic action[J].Phytother Res,1989,3:70-1.
[14]Abdil-Aziz H,Windeck T,Ploch M,et al.Mode of action of gingerols and shogaols on 5-HT3receptors:binding studies,cation uptake by the receptor channel and contraction of isolated guineapig ileum[J].Eur J Pharmacol,2006,530:136-43.
[15]Borrelli F,Capasso R,Pinto A,et al.Inhibitory effect of ginger(Zingiber officinale)on rat ileal motilityin vitro[J].Life Sci,2004,74:2889-96.
[16]Qian Q H,Yue W,Wang Y X,et al.Gingerol inhibits cisplatininduced vomiting by down regulating 5-Hydroxytryptamine,Dopamine and Substance P expression in Minks[J].Arch Pharm Res,2009,32(4):565-73.
[17]Sharma S S,Gupta Y K.Reversal of cisplatin-induced delay in gadstric emptying in rats by ginger(Zingiber officinale)[J].J Ethnopharmacol,1998,62:49-55.
[18]Wu K L,Rayner C K,Chuah S K,et al.Effects of ginger on gastric emptying and motility in healthy humans[J].Eur J Gastroenterol Hepatol,2008,20:436-40.
[19]Wadikar D D,Nanjappa C,Premavalli K S,et al.Development of ginger based ready-to-eat appetizers by response surface methodology[J].Appetite,2010,55:76-83.
[20]Stewart J J,Wood M J,Wood C D,et al.Effects of ginger on motion sickness susceptibility and gastric function[J].Pharmacology,1991,42:111-20.
[21]程记伟,白 宇.即刻早期基因c-fos与癫痫关系的研究进展[J].现代医药卫生,2008,24(2):221-2.
[21]Chen J W,Bai Y.The relationship of c-fos and epilepsy[J].Mod Med Health,2008,24(2):221-2.
[22]Miller A D,Ruggiero D A.Emeti reflex are revealed by epression of ther immediate-early gene c-fos in the cat[J].J Neurousc,1994,14(2):871-88.
[23]Billig I,Yates B J,Rinaman L.Plasma hormone levels and central c-fos expression in ferrets after systemic administration of cholecystokinin[J].Am J Physiol,2001,281(4):1243-55.
[24]Endo T,Minami M,Nakayasu M,et al.Effects of granisetron and vagotomy on c-fos mRNA expression in the rat medulla oblongata as assessed by in situ hybridization[J].Biomed Res,2004,25:229-35.

