UGT1A1 基因多态性与转移性结直肠癌伊立替康化疗毒性及疗效的关系*
张君孝, 王晨亮, 黄美近, 傅新晖, 卢碧燕, 邓艳红△, 刘焕亮△
(1 中山大学胃肠病学研究所,2 中山大学附属第六医院,广东 广州510655)
伊立替康(irinotecan,CPT-11)是喜树碱半合成衍生物,在体内经羧酸酯酶(carboxylesterases,CE)水解转化为7-乙基-10-羟基喜树碱(7-ethyl-10-hydroxy-camptothecin,SN-38),SN-38 为DNA拓扑异构酶Ⅰ抑制剂,作用于细胞周期S 期,抑制DNA 单链断裂后的修复,干扰DNA 复制和转录,从而发挥细胞毒效应[1]。伊立替康是目前治疗转移性结直肠癌(metastatic colorectal cancer,mCRC)最有效的化疗药物之一[2]。国外临床研究表明采用伊立替康为基础的化疗方案可以提高患者的化疗有效率、无疾病进展生存时间(progression-free survival,PFS)和总生存时间(overall survival,OS)[3-4]。
虽然伊立替康治疗mCRC 的效果较好,但是由于可能发生严重的血液毒性和消化道毒性而应用受到限制。伊立替康的剂量依赖性毒性主要为迟发性腹泻和中性粒细胞减少,两者发生率分别可达到约46%和30%,甚至可以导致患者死亡[3],其中药物代谢的遗传多态性是造成个体间不良反应差异的主要因素之一。伊立替康在体内的主要代谢部位为肝脏,经静脉注射后,在体内转化为细胞毒性更强的活性代谢产物SN-38,SN-38 经尿苷二磷酸葡萄糖醛酸转移酶家族(uridine diphosphate glucuronosyltransferases,UGTs)灭活为葡萄糖醛酸产物SN-38G 后,经胆汁排泄进入肠道,在肠道细菌β-葡萄糖醛酸酶(β-glucuronidase)作用下转换为SN-38,引发肠黏膜损伤及迟发性腹泻;而肠道内的UGTs 酶又可再度催化SN-38 为SN-38G 进行解毒,UGTs 酶的表达及其活性,与伊立替康的疗效及不良反应密切相关[5]。
国外临床研究表明在高加索人群应用伊立替康的患者中,UGT1A1 基因启动子区TATA 重复序列的变化即UGT1A1*28 的杂合突变型TA6/7 和纯合突变型TA7/7 显著增加患者发生严重粒细胞减少和腹泻的风险[6-7]。然而UGT1A1*28 基因多态性的分布存在着明显的种族差异,UGT1A1*28 的纯合突变型TA7/7 在亚洲人中仅为0%~5%[8-9],远低于在非洲人和高加索人中的频率12% ~27% 和5% ~15%[10]。因此,UGT1A1*28 基因多态性能否作为在中国患者中的不良反应预测指标存在争议。另外,近年的研究显示在亚洲人群应用伊立替康进行治疗的患者中UGT1A1*6(第1 外显子211 位)杂合突变型G/A 和纯合突变型A/A 显著增加患者发生3 ~4级中性粒细胞减少、血小板减少及腹泻的风险[11-14]。UGT1A1*6 突变在亚洲人群中的发生率高达13%~23%[10],我们认为预测中国患者不良反应的发生应综合考虑UGT1A1*6 和UGT1A1*28 位点基因多态性的影响。本研究通过对207 例消化道肿瘤患者的UGT1A1*6 和UGT1A1*28 基因多态性进行检测,探讨UGT1A1 基因多态性在中国人群中的分布,并对其中56 例采用含伊立替康方案化疗的mCRC 患者情况进行分析,探讨UGT1A1 基因多态性与伊立替康化疗的不良反应和疗效之间的关系。
材 料 和 方 法
1 材料
收集2010 年4 月至2012 年3 月期间在我院做基因检测的207 例消化道肿瘤患者的外周血样标本,进行UGT1A1*6 和UGT1A1*28 基因多态性的检测。观察记录其中56 例采用含伊立替康方案化疗的mCRC 患者在化疗中出现不良反应的情况、肿瘤进展时间及化疗疗效。56 例患者中男35 例,女21例,均为汉族,年龄21 ~78 岁(中位年龄55.5 岁)。患者均经病理和(或)CT 证实为mCRC,无合并严重心、肺、肝、肾及造血功能障碍;无黄疸及消化道梗阻;未伴发急性感染;Karnofsky Performance Status(KPS)评分90 ~100 分43 例,70 ~80 分13 例;均采用二线化疗方案,其中采用FOLFIRI 方案33 例,XELIRI 方案8 例,靶向药物+FOLFIRI 方案11 例,靶向药物+XELIRI 方案4 例。
2 方法
2.1 UGT1A1 基因分型 化疗前收集患者血液2 mL 抗凝,采用RelaxGene Blood DNA System 试剂盒(北京天根生化科技有限公司),严格按照说明书操作分批次统一提取基因组DNA,并测定浓度。PCR扩增UGT1A1 基因的目的片段,扩增引物序列为:正向引物5’-TCCCTGCTACCTTTGTGGAC-3’,反向引物5’-ATGGCACAGGGTACGTCTTC-3’;PCR 反应采用40 μL 体系包括DNA 模板10 ng(2 μL),PCR mix 预混液(上海基星生物科技有限公司)20 μL,ddH2O 14 μL 及正向引物和反向引物各2 μL;反应条件为:初始变性94 ℃5 min,94 ℃30 s,64 ℃30 s,72 ℃30 s,共40 个循环,最后72 ℃7 min。电泳观察PCR 产物是否清晰单一,符合标准后送上海英骏生物技术有限公司进行直接测序。UGT1A1*28 测序引物为:5’- ATGGCACAGGGTACGTCTTC-3’;UGT1A1*6 测序引物为:5’- ACCTCTGGCAGGAGCAAAG-3’。测序结果采用DNAStar 软件显示,人工校读分析UGT1A1*28 和UGT1A1*6 基因型。
2.2 数据收集 在每一个化疗周期,通过查阅病史、体格检查、影像学检查和常规实验室检查(包括生化检查、血液检查和肿瘤标志物检查)对患者的不良反应、化疗疗效进行评估并记录肿瘤进展时间(time to progression,TTP)。
2.3 药物毒性评价标准 依据美国国立癌症研究所(National Cancer Institute,NCI)提出的NCI-CTC Classification (Version 3.0)对药物的毒性进行评价和分级。
2.4 疗效评价标准 依据美国国立癌症研究所提出的实体肿瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)进行疗效评价。
2.5 研究终点和统计学处理 主要研究终点为肿瘤进展时间,次要研究终点为化疗方案反应率、总生存时间和不良反应事件。应用SPSS17.0 软件进行统计分析,不同基因型之间不良反应和疗效的比较采用χ2检验或Fisher’s 精确概率法,生存分析采用Kaplan-Meier 方法,不同基因型之间肿瘤进展时间的比较采用log-rank 检验,以P <0.05 为差异有统计学意义。
结 果
1 UGT1A1* 28 基因多态性分布情况
本组207 例患者中,164 例(79.2%)UGT1A1 基因启动子区TA 序列呈6 次重复,为野生型TA6/6;41 例(19.8%)基因型为TA 序列6 次和7 次重复的杂合突变型TA6/7;2 例(1.0%)基因型为TA 序列7次重复的纯合突变型TA7/7。56 例接受伊立替康化疗的mCRC 患者中,47 例(83.9%)为野生型TA6/6;8 例(14.3%)为杂合突变型TA6/7;1 例(1.8%)为纯合突变型TA7/7;基因型分布与总体207 例分布相似(P >0.05)。多态性测序结果见图1。
2 UGT1A1* 6(第1 外显子211 位)基因多态性分布情况
本组207 例患者中,154 例(74.4%)UGT1A1 基因第1 外显子211 位为野生型G/G;51 例(24. 6%)UGT1A1 基因第1 外显子211 位为杂合突变型G/A;2例(1.0%)UGT1A1 基因第1 外显子211 位为纯合突变型A/A。56 例接受伊立替康化疗的mCRC 患者中,38 例(67.9%)为野生型G/G;18 例(32.1%)为杂合突变型G/A;基因型分布与总体207 例分布相似(P >0.05)。多态性测序结果见图2。
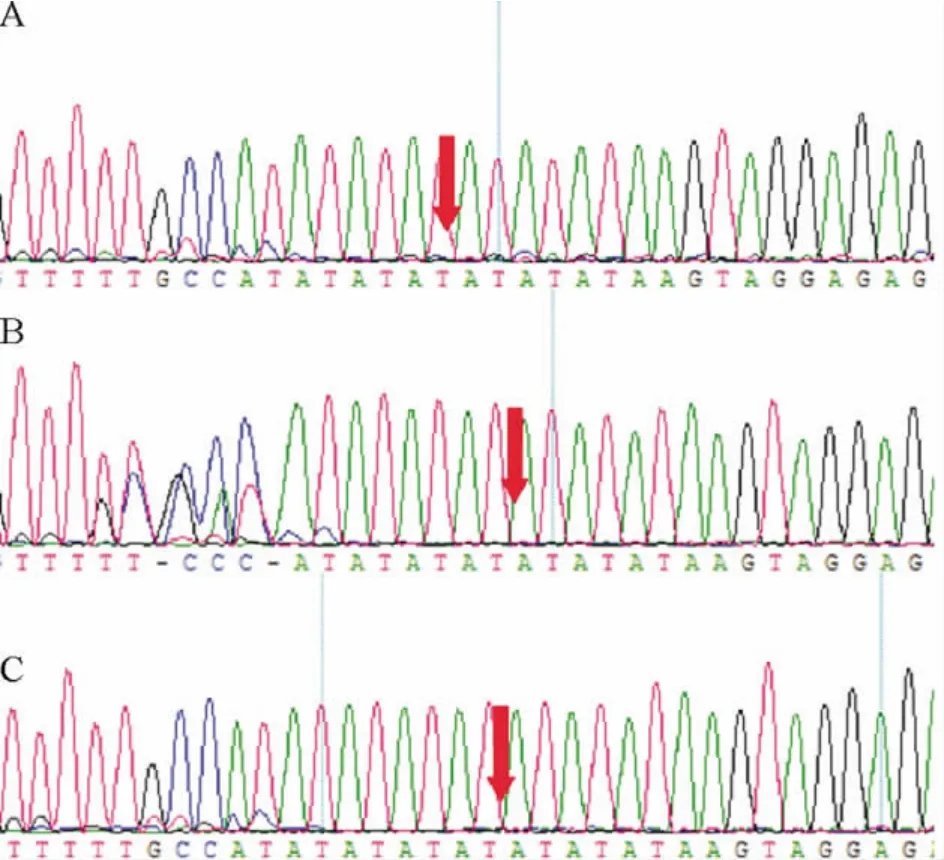
Figure 1. Representative sequencing diagram of UGT1A1* 28 genotypes.A:TA6/6 wild-type genotype;B:TA 6/7 heterozygous genotype;C:TA7/7 homozygous genotype.图1 UGT1A1* 28 3 种基因型TA6/6、TA6/7 和TA7/7 的代表性测序图
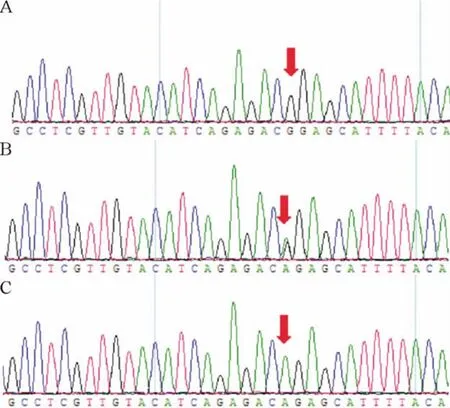
Figure 2. Representative sequencing diagram of UGT1A1* 6 genotypes.A:G/G wild-type genotype;B:G/A heterozygous genotype;C:A/A homozygous genotype.图2 UGT1A1* 6 3 种基因型G/G、G/A 和A/A 的代表性测序图
3 mCRC 患者UGT1A1 基因型和药物不良反应情况
56 例患者中,UGT1A1*28 野生型(TA6/6)47例,其中出现3 ~4 级腹泻9 例;3 ~4 级白细胞减少8例;3 ~4 级中性粒细胞减少16 例;3 ~4 级血红蛋白减少8 例;3 ~4 级血小板减少1 例;UGT1A1*28 突变型(TA6/7 和TA7/7)9 例,其中出现3 ~4 级腹泻1 例;3 ~4 级白细胞减少3 例;3 ~4 级中性粒细胞减少6 例;3 ~4 级血红蛋白减少3 例;3 ~4 级血小板减少3 例;UGT1A1*6 野生型G/G 38 例,其中出现3~4 级腹泻3 例;3 ~4 级白细胞减少6 例;3 ~4 级中性粒细胞减少11 例;3 ~4 级血红蛋白减少6 例;3 ~4 级血小板减少4 例;UGT1A1*6 突变型(G/A 和A/A)18 例,其中出现3 ~4 级腹泻7 例;3 ~4 级白细胞减少5 例;3 ~4 级中性粒细胞减少11 例;3 ~4 级血红蛋白减少5 例。统计分析发现,UGT1A1*28 突变型可以增加患者发生3 级以上血小板减少的风险,UGT1A1*6 突变型可以增加患者发生3 级以上腹泻和中性粒细胞减少的风险,见表1。
4 mCRC 患者UGT1A1 基因型与疗效的关系
56 例接受伊立替康化疗的mCRC 患者中,疗效在UGT1A1 各基因型之间的差异无统计学意义,见表2。

表1 UGT1A1 基因型和药物不良反应情况Table 1. Adverse drug reaction in different UGT1A1 genotypes

表2 UGT1A1 各基因型的疗效情况Table 2. Response to treatment with regard to UGT1A1 genotypes
5 肿瘤进展时间与UGT1A1 基因型之间的关系
UGT1A1*28 野生型(TA6/6)和突变型(TA6/7和TA7/7)的中位肿瘤进展时间分别为8.8 个月和8.1 个月,差异无统计学意义(P >0.05);UGT1A1*6野生型(G/G)和突变型(G/A 和A/A)的中位肿瘤进展时间分别为10.8 个月和8.1 个月,差异无统计学意义(P >0.05),见图3。
讨 论
伊立替康不良反应的发生存在明显的个体差异,UGT1A1 是伊立替康在体内代谢的最主要代谢酶[15],其基因多态性与伊立替康的疗效和毒性有密切的关系。
本研究中207 例汉族消化道肿瘤患者的UGT1A1*28 基因多态性分布情况为野生型TA6/6,164 例 占79. 2%;杂 合 突 变 型TA6/7,41 例 占19.8%;纯合突变型TA7/7,2 例占1%,与Zhang等[8]报道的对539 例和马冬等[9]报道的对317 例中国人中UGT1A1*28 的基因多态性分布情况相一致。UGT1A1*28 杂合突变型TA6/7 和纯合突变型TA7/7的频率明显低于在高加索人群(杂合突变型TA6/7频率为35% ~50%,纯合突变型TA7/7 频率10% ~15%)和非洲人群(杂合突变型TA6/7 频率为44% ~52%,纯合突变型TA7/7 频率12% ~27%)中的突变率[10]。UGT1A1*6 的基因多态性分布情况为野生型G/G,154 例占74. 4%;杂合突变型G/A,51 例占24.6%;纯合突变型G/G,2 例占2.0%,与Nakamura等[16]在日本人群、Han 等[17]在韩国人群及Jada 等[14]在亚洲人群中的UGT1A1*6 基因多态性研究结果相似,但是UGT1A1*6 基因突变频率在高加索人群和非洲人群中突变频率非常低[10]。本研究结果提示在中国汉族人群中,UGT1A1*6 基因突变型(G/A 和A/A)的频率为(26. 6%)高于UGT1A1*28 基因突变型(TA6/7 和TA7/7)的频率(20.8%),显得更为普遍。
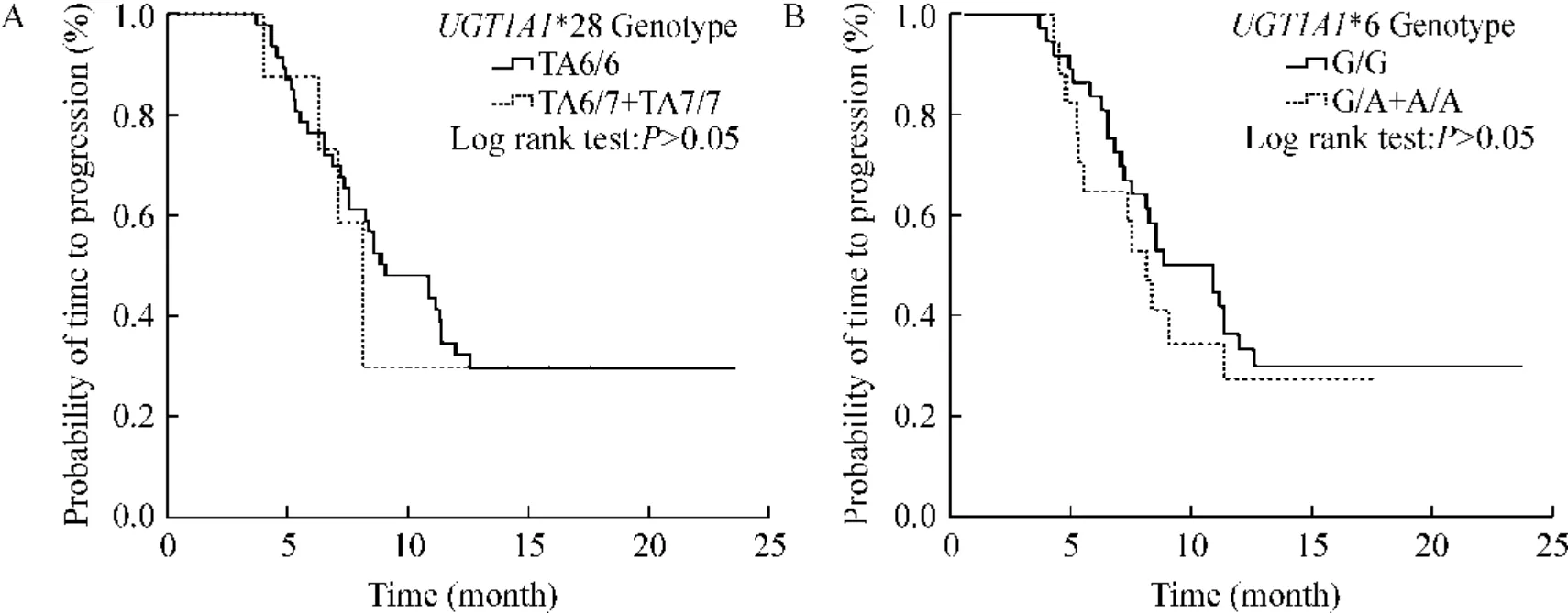
Figure 3. Comparison of time to progression (TTP)between UGT1A1 wild type and mutant.A:comparison of TTP between UGT1A1* 28 wild type (TA6/6)and mutant (TA6/7 and TA7/7);B:comparison of TTP between UGT1A1* 6 wild type (G/G)and mutant (G/A and A/A).图3 UGT1A1* 28 和UGT1A1* 6 野生型和突变型之间肿瘤进展时间的比较
本研究中对56 例采用含伊立替康方案化疗的mCRC 患者的不良反应和UGT1A1 基因多态性关系分析发现:UGT1A1*28 的突变型(TA6/7 和TA7/7)与野生型TA6/6 相比,可以增加患者发生3 级以上血小板减少(33.3% vs 2.1%,P <0.05)的风险,但不会增加患者发生3 级以上白细胞减少和中性粒细胞减少的风险;消化道毒性方面,UGT1A1*28 的突变型(TA6/7 和TA7/7)与野生型TA6/6 相比,不会增加患者发生3 级以上腹泻的风险(11.1% vs 19.1%,P >0.05)。我们的研究结果与Schulz 等[18]和马冬等[9]的研究一致,分析没有发现UGT1A1*28 突变型(TA6/7 和TA7/7)可以增加患者发生3 级以上腹泻的风险可能是因为UGT1A1*28 在中国人群中突变频率太低所造成的。
UGT1A1*6 突变型(G/A 和A/A)与野生型G/G相比,可以增加患者发生3 级以上中性粒细胞减少(61.1% vs 29. 0%,P <0. 05)和腹泻(38. 9% vs 7.9%,P <0.05)的风险,与多项在日本的临床研究结果一致[11-14]。原因可能是因为伊立替康的活性形式为SN-38,为拓扑异构酶Ⅰ抑制剂,可抑制DNA 单链断裂后修复,干扰DNA 复制和转录,肝和肠内的代谢酶UGT1A1 可将SN-38 代谢为灭活产物SN-38G,UGT1A1*6 突变型可以使UGT1A1 的活性下降30% ~70%[19-20],使肠道内SN-38 转换为SN-38G 的速率下降,导致SN-38 在肠道内蓄积产生细胞毒性,直接作用于肠粘膜引起组织损伤,导致严重腹泻。
本研究结果显示UGT1A1*28 和UGT1A1*6 基因多态性和疗效之间无相关性(P >0.05 和P >0.05);UGT1A1*28 野生型TA6/6 的中位TTP 为8.8月,突变型(TA6/7 和TA7/7)的中位TTP 为8.1 月,差异无统计学意义(P >0. 05);UGT1A1*6 野生型G/G 的中位TTP 为10.8 个月,突变型(G/A 和A/A)的中位TTP 为8.1 个月,差异无统计学意义(P >0.05);我们的研究结果与Schulz 等[18]和Seo 等[21]的研究结果一致,未发现UGT1A1*6 和UGT1A1*28基因型与TTP 之间的相关性。化疗疗效在各基因型之间没有差别的原因可能是因为本研究中样本量较少和纳入的患者化疗方案均为二线化疗方案所致,我们将进一步收集样本,观察病人的远期疗效,分析UGT1A1 基因多态性和伊立替康疗效之间的关系,并进行机制方面的实验研究。
综上所述,本研究结果发现在中国汉族人群中UGT1A1*28 突变型可以增加患者发生3 级以上血小板减少的风险;UGT1A1*6 突变型可以增加患者发生3 级以上腹泻和中性粒细胞减少的风险;UGT1A1*6突变频率明显高于UGT1A1*28,提示UGT1A1*6 与中国人群中伊立替康的毒性反应更为密切,因此,在临床伊立替康毒性预测中,应综合考虑UGT1A1*6和UGT1A1*28 基因多态性检测,从而更好地指导临床医生优化化疗方案,以达到个体化医疗的目的。
[1] Toffoli G,Cecchin E,Corona G,et al. Pharmacogenetics of irinotecan[J]. Curr Med Chem Anticancer Agents,2003,3(3):225-237.
[2] Ulukan H,Swaan PW. Camptothecins:a review of their chemotherapeutic potential[J]. Drugs,2002,62(14):2039-2057.
[3] Douillard JY,Cunningham D,Roth AD,et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer:a multicentre randomised trial[J]. Lancet,2000,355(9209):1041-1047.
[4] Saltz LB,Cox JV,Blanke C,et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer.Irinotecan Study Group[J]. N Engl J Med,2000,343(13):905-914.
[5] Hahn KK,Wolff JJ,Kolesar JM. Pharmacogenetics and irinotecan therapy[J]. Am J Health Syst Pharm,2006,63(22):2211-2217.
[6] Ando Y,Saka H,Ando M,et al. Polymorphisms of UDP-glucuronosyltransferase gene and irinotecan toxicity:a pharmacogenetic analysis[J]. Cancer Res,2000,60(24):6921-6926.
[7] Martinez-Balibrea E,Abad A,Martinez-Cardus A,et al. UGT1A and TYMS genetic variants predict toxicity and response of colorectal cancer patients treated with first-line irinotecan and fluorouracil combination therapy[J].Br J Cancer,2010,103(4):581-589.
[8] Zhang A,Xing Q,Qin S,et al. Intra-ethnic differences in genetic variants of the UGT-glucuronosyltransferase 1A1 gene in Chinese populations[J]. Pharmacogenomics J,2007,7(5):333-338.
[9] 马 冬,张绪超,杨冬阳,等. 中国人UGT1A1*28 的基因多态性以及与伊立替康毒性和疗效的关系[J]. 中山大学学报:医学科学版,2011,32(4):495-499.
[10] Kaniwa N,Kurose K,Jinno H,et al. Racial variability in haplotype frequencies of UGT1A1 and glucuronidation activity of a novel single nucleotide polymorphism 686C >T(P229L)found in an African-American[J]. Drug Metab Dispos,2005,33(3):458-465.
[11] Onoue M,Terada T,Kobayashi M,et al. UGT1A1*6 polymorphism is most predictive of severe neutropenia induced by irinotecan in Japanese cancer patients[J]. Int J Clin Oncol,2009,14(2):136-142.
[12] Takano M,Kato M,Yoshikawa T,et al. Clinical significance of UDP-glucuronosyltransferase 1A1*6 for toxicities of combination chemotherapy with irinotecan and cisplatin in gynecologic cancers:a prospective multi-institutional study[J]. Oncology,2009,76(5):315-321.
[13] Minami H,Sai K,Saeki M,et al. Irinotecan pharmacokinetics/pharmacodynamics and UGT1A genetic polymorphisms in Japanese:roles of UGT1A1*6 and*28[J].Pharmacogenet Genomics,2007,17(7):497-504.
[14] Jada SR,Lim R,Wong CI,et al. Role of UGT1A1*6,UGT1A1*28 and ABCG2 c. 421C >A polymorphisms in irinotecan-induced neutropenia in Asian cancer patients[J]. Cancer Sci,2007,98(9):1461-1467.
[15] Iyer L,King CD,Whitington PF,et al. Genetic predisposition to the metabolism of irinotecan (CPT-11). Role of uridine diphosphate glucuronosyltransferase isoform 1A1 in the glucuronidation of its active metabolite (SN-38)in human liver microsomes[J]. J Clin Invest,1998,101(4):847-854.
[16] Nakamura Y,Soda H,Oka M,et al. Randomized phase II trial of irinotecan with paclitaxel or gemcitabine for non-small cell lung cancer:association of UGT1A1*6 and UGT1A1*27 with severe neutropenia[J]. J Thorac Oncol,2011,6(1):121-127.
[17] Han JY,Lim HS,Shin ES,et al. Comprehensive analysis of UGT1A polymorphisms predictive for pharmacokinetics and treatment outcome in patients with non-small-cell lung cancer treated with irinotecan and cisplatin[J]. J Clin Oncol,2006,24(15):2237-2244.
[18] Schulz C,Heinemann V,Schalhorn A,et al. UGT1A1 gene polymorphism:impact on toxicity and efficacy of irinotecan-based regimens in metastatic colorectal cancer[J]. World J Gastroenterol,2009,15(40):5058-5066.
[19] Udomuksorn W,Elliot DJ,Lewis BC,et al. Influence of mutations associated with Gilbert and Crigler-Najjar type II syndromes on the glucuronidation kinetics of bilirubin and other UDP-glucuronosyltransferase 1A substrates[J]. Pharmacogenet Genomics,2007,17(12):1017-1029.
[20] Gagne J F,Montminy V,Belanger P,et al. Common human UGT1A polymorphisms and the altered metabolism of irinotecan active metabolite 7-ethyl-10-hydroxycamptothecin (SN-38)[J]. Mol Pharmacol,2002,62(3):608-617.
[21] Seo BG,Kwon HC,Oh SY,et al. Comprehensive analysis of excision repair complementation group 1,glutathione S-transferase,thymidylate synthase and uridine diphosphate glucuronosyl transferase 1A1 polymorphisms predictive for treatment outcome in patients with advanced gastric cancer treated with FOLFOX or FOLFIRI[J]. Oncol Rep,2009,22(1):127-136.

