类胡萝卜素及其在番茄果实生长发育中的变化
刘云飞,万红建,袁 伟,俞 锞,杨悦俭
(1.浙江省农业科学院 蔬菜研究所,浙江 杭州 310021;2.南京农业大学 园艺学院,江苏 南京 210095)
类胡萝卜素是一类天然色素的总称,是异戊二烯化合物,主要包括 β-胡萝卜素、α-胡萝卜素、叶黄素以及番茄红素等。类胡萝卜素广泛存在于植物、动物、细菌以及真菌中,在人体内不能合成,必须由膳食中获得。类胡萝卜素具有极强的抗氧化活性,可延缓衰老。有研究报道,类胡萝卜素可以减少冠心病、黄斑退化等与老化相关的疾病以及癌症的发病率。番茄中的番茄红素,虽然没有维生素A的活性,但作为一种抗氧化和猝灭氧离子自由基的物质,是治疗癌症的一种有效物质[1]。另外,类胡萝卜素中的β-胡萝卜素是人和动物体内维生素A的合成前体。由此可见,类胡萝卜素是人和动物进行正常生命活动必不可少的一类物质。番茄是提供类胡萝卜素的重要蔬菜之一,也是研究类胡萝卜素的模式植物,通过对番茄中类胡萝卜素的研究,有助于深入了解类胡萝卜素代谢途径,更好的调控类胡萝卜素的合成。
1 类胡萝卜素的生理作用
对于植物本身而言,首先,类胡萝卜素是叶绿体中重要的光合色素之一,它参与光合组织天线系统中光能的捕获,同时也是光合反应中心叶绿素结合蛋白的重要组成部分。β-胡萝卜素主要富集在PSI(光系统I)中,而在 PSII(光系统 II)中富集的是叶黄质,PSII反应中心的核心复合物上存在有β-胡萝卜素。其次,类胡萝卜素具有极强的抗氧化性能,它能猝灭由于强光或者生理生化反应产生的超氧阴离子自由基和单态氧离子等,进而保证有机体正常代谢功能的进行[2],有研究表明,β-胡萝卜素的衍生物单环氧的玉米黄质也有类似功能[3]。此外,部分类胡萝卜素还可与蛋白形成色素-蛋白复合体进而参与植物生理生化活动。植物类胡萝卜素生物合成途径中产生的环氧类胡萝卜素堇菜黄质以及新黄质是植物激素脱落酸 (ABA)的生物合成的前体,类胡萝卜素也与维持细胞膜的稳定性以及基因的表达有关。类胡萝卜素合成过程中产生的新黄质在酶的作用下可以产生紫黄质,且这个反应可双向进行,该反应与光强有关,可减少强光对植株的伤害。
2 类胡萝卜素的理化特性
类胡萝卜素是世界上最大的一类天然色素,是一类脂溶性物质。最早在胡萝卜中发现,因此命名为胡萝卜素,随后又发现许多同胡萝卜素相似的色素,最终将这一类物质定名为类胡萝卜素,目前,已经发现超过600种的类胡萝卜素。在植物中,类胡萝卜素大量存在于红色、黄色的花以及各种水果和蔬菜中[4]。类胡萝卜素除了在光合系统中占有重要地位以外,它还参与植物花、果实等颜色的形成。有研究表明,类胡萝卜素的总量在植物果实颜色的形成中并不起决定性作用,起决定性作用的是不同类胡萝卜素的比例[4]。不同的类胡萝卜素配比使植物的花、果实以及某些种类植物的叶片产生不同的颜色,以吸引昆虫、鸟类或其他动物来帮助植物授粉和传播种子,同时对园艺植物的观赏性和经济价值也有着重要作用。类胡萝卜素是一类萜类化合物,萜类化合物的共同特点是由多个异戊二烯组成,即类胡萝卜素具有很多双键结构[5](图1)。这些双键决定着类胡萝卜素的生理生化活性以及类胡萝卜素的颜色,双键具有较强的还原性,这就是类胡萝卜素具有强抗氧化性的原因。类胡萝卜素双键系统中双键的数目也与其颜色有关,类胡萝卜素的颜色随着分子结构中双键数目的增加颜色越远离红色。
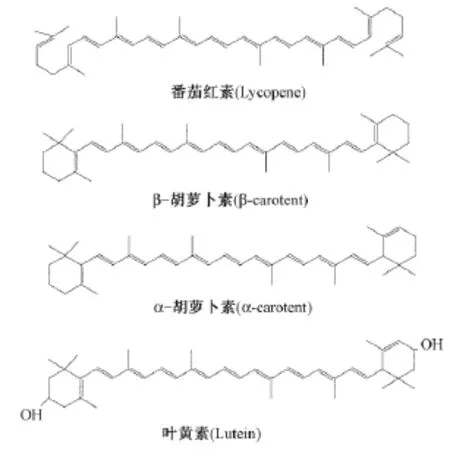
图1 部分类胡萝卜素的化学结构式
3 类胡萝卜素的生物合成途径
高等植物中类胡萝卜素的合成途径最早由Lincoln等[6]提出。Armstrong从一种光合细菌荚膜红细菌中分离得到类胡萝卜素生物合成的基因[7]。Misawa等[8]从菌类中克隆得到参与类胡萝卜素生物合成途径的相关基因。2001年 Moehs等[9]从高等植物中分离出类胡萝卜素合成基因。
类胡萝卜素在生物体中有多种合成途径[10-11]。类胡萝卜素可以在真菌和植物细胞液以及内质网上合成。在番茄果实中,类胡萝卜素积累在特殊的质体 (载色体)中[12],合成途径中的酶是由核内基因编码并翻译成蛋白质后转运到质体中参与类胡萝卜素的合成。类胡萝卜素合成前体异戊二烯焦磷酸(IPP)是由乙酰CoA经羟甲基戊二酰-CoA形成甲羟戊酸,随后再经激酶反应,产生甲羟戊酸焦磷酸,然后脱羧为 IPP,这一途径称为 MVA途径。类胡萝卜素生物合成途径[12]如图2所示。

图2 类胡萝卜素合成途径
丙酮酸和甘油醛-3-磷酸通过一系列酶合成牻牛儿基牻牛儿基焦磷酸 (GGPP)的合成前体,再经过IPP异构酶 (IPI)和牻牛儿基牻牛儿基焦磷酸合酶 (GGPS)的作用生成 GGPP,参与合成的丙酮酸和甘油醛-3-磷酸表明GGPP是由光合作用产生的葡萄糖转化而来[13-14]。随后,2个 GGPP在与膜相联系的八氢番茄红素合成酶 (PSY)的催化下缩合产生1,5-顺式八氢番茄红素,再在八氢番茄红素脱饱和酶 (PDS)以及 ζ-胡萝卜素脱氢酶(ZDS)等作用下产生番茄红素。合成途径中番茄红素的下游,类胡萝卜素生物合成反应主要分为2个分支:α-分支和 β-分支。其中 α-分支是番茄红素在番茄红素ε-环化酶 (LCY-e)和番茄红素β-环化酶 (LCY-b)的作用下产生 α-胡萝卜素和叶黄素;β-分支则是番茄红素在 LCY-b等作用下生成β-胡萝卜素。α-胡萝卜素、叶黄素和 β-胡萝卜素的生成并不是类胡萝卜素合成途径的终结,如产生的β-胡萝卜素可以进一步作为其他类胡萝卜素合成的原料,β-胡萝卜素在一系列酶的催化下产生玉米黄质 (zeaxanthin),进而合成三色堇黄质和新黄质[12],产生的三色堇黄质和新黄质还可作为其他物质的合成前体。
4 类胡萝卜素在番茄中的研究现状
4.1 类胡萝卜素在番茄果实中的变化
番茄是研究果实发育、进化以及生理生化等方面的模式植物[15]。番茄果实成熟过程可分为绿熟期、发白期、转色期、粉红期、红熟Ⅰ期和红熟Ⅱ期。红果番茄中,各种类胡萝卜素随着果实不同成熟阶段表现出不同的变化。程孙亮等[16-17]研究显示,在番茄成熟过程中,类胡萝卜素总体呈上升趋势,最终类胡萝卜素的含量达到果实未转色时的10~14倍。番茄红素在果实发白期开始出现,随后积累量不断增加,在果实粉红期积累速度最快,红熟Ⅱ期积累量达到最大;β-胡萝卜素在绿熟期开始出现,含量在整个果实成熟过程中除在发白期略有下降之外,其余各阶段皆处于上升状态,在红熟Ⅱ期达到顶峰;叶黄素的积累规律和 β-类胡萝卜素积累规律相似,但其积累速度变化较 β-类胡萝卜素相对平稳[16]。叶黄素和 β-胡萝卜素在果实成熟过程中先降后升的原因可能是发白期前期合成的叶黄素和β-胡萝卜素快速转化为下游物质[17]。有研究[18]表明,类胡萝卜素在果实的不同部位分布也有很大差异,β-胡萝卜素在胶质中含量最高,番茄红素在胶质中含量最低,大部分番茄红素存在于果皮中,果实成熟期叶黄素的含量在胶质胎座中达到最大。
4.2 类胡萝卜素合成途径中相关基因的研究状况
目前,类胡萝卜素的合成途径已经比较清晰,参与合成途径的有关基因已取得一定的研究进展。植物中已有许多参与合成途径的基因被克隆,其中不同来源的GGPP合成酶基因约有5个,其中有来自藻类的crtE,来自拟南芥的Ggps。在番茄中克隆的八氢番茄红素合成酶基因有PSY1和PSY2,其中PSY1控制番茄花和果实成熟过程中的GGPP到八氢番茄红素的合成过程,而PSY2控制绿色组织包括未转色的果实中的相应过程[19-20]。番茄中除了拥有同其他植物共有的 β-环化酶基因 (LCY-b)外,还有其自身特有的类似基因 CYC-b[21],LCY-b与CYC-b有53%的相似性[20]。PDS定位于3号染色体上[22-24],其作用受到除草剂的抑制[20]。ZDS定位于1号染色体上,且发现该基因分子标记fc1.1[21]。CRTLSO 已 从 类 番 茄 中 克 隆 得 到,CRTLSO在番茄中催化合成反式番茄红素的反应,解决了类胡萝卜素异构化难题[25]。
番茄成熟时类胡萝卜素各种成分及其含量决定着番茄果实的颜色,已发现控制番茄果实颜色有3对等位基因Y-y,R-r和 T-t,分别位于第1,3,10号染色体。另外,控制果色的基因还有 dg,B,MOB,hp,Del等。r基因是使类胡萝卜素合成途径中关键酶PSY丧失功能的突变基因,它阻碍GGPP向八氢番茄红素转化,使果实表现为黄色,且已发现与该基因连锁的分子标记 TG621[22]。隐性纯合tt基因使番茄果实中参与合成类胡萝卜素的番茄红素前体主要为顺式结构,反式番茄红素前体仅占2%[23]。高色素基因 (hp)和深绿色基因(dg)都可增加未成熟果实中叶绿素含量,叶绿素在番茄果实成熟过程中转化为类胡萝卜素,从而使类胡萝卜素含量得到大幅度提高[22]。在番茄的生长过程中,果实内色素含量变化很大。果实中色素主要是类胡萝卜素和叶绿素两大类,其中类胡萝卜素主要为番茄红素、β-胡萝卜素,叶绿素主要为叶绿素a和叶绿素b。番茄红素是许多果实产生鲜亮红色的主要原因[26],也是 β-胡萝卜素的合成前体,它转化为β-胡萝卜素的过程由番茄红素 β-环化酶 (LCY-b)催化,所以番茄红素在果实成熟时的积累就要求低的 LCY-b表达活性[27],相反则需要增加其活性,可增加下游产物的合成量。除了直接合成的类胡萝卜素外,叶绿体中色素在番茄果实成熟过程中会转变为类胡萝卜素,使整个叶绿体转变为有色体。
4.3 番茄中类胡萝卜素与果实成熟及糖含量的相关性
番茄中的类胡萝卜素除影响果实颜色之外,还与果实的成熟以及果实成熟过程中糖的积累量有密切关系。类胡萝卜素合成过程中产生的新黄质在酶的作用下产生紫黄质,新黄质与紫黄质已证实为ABA的合成前体[20],而ABA是果实成熟过程中的重要内源激素。在已经克隆的控制番茄果实成熟的Tom系列基因中,Tom5被定位在2,3号染色体上的八氢番茄红素合成酶基因,其序列与荚膜红细菌和欧文氏菌中发现的编码原八氢番茄红素焦磷酸合成酶的基因有较高的同源性[28],Dellapenna等[29]将Tom5的反义基因转入番茄后发现类胡萝卜素合成途径受阻,果实成熟后呈黄色,而将Tom5基因正向导入黄色突变植株后可恢复合成番茄红素能力。在番茄果实成熟过程中果糖和葡萄糖含量不断升高,蔗糖含量不断降低。有研究[18]显示,糖含量的变化与类胡萝卜素的含量呈现出一定的相关性,其中,番茄红素和β-胡萝卜素同果糖及葡萄糖的积累量呈现出显著的正相关,而与蔗糖则表现为显著的负相关性,这证明类胡萝卜素合成前体物质GGPP由光合作用的葡萄糖转化而来。
4.4 番茄中类胡萝卜素合成途径的调控
植物绿色组织主要通过感受光的强度以及光质来调控类胡萝卜素合成,现已证实类胡萝卜素合成在果实的调控机理与绿色组织中的有所不同[30-31]。Corona等[32-34]研究发现,在番茄进入转色期以后,PSY1以及PDS的mRNA表达水平显著提高,表明在此期间PSY1和PDS相当活跃,而参与下游合成的LCY-b等基因表达水平下降。目前发现的调控类胡萝卜素合成的基因突变主要从3个方面进行影响合成:第1种是位于类胡萝卜素合成途径上游的基因发生突变,使得类胡萝卜素含量整体降低,如t基因就是由于 CRTLSO缺失产生的[23,35];第 2种是合成途径的下游尤其是番茄红素之后的基因丧失功能,这会影响类胡萝卜素各种组成的比例变化,但不会改变总体类胡萝卜素的积累量,如已经发现的 Delta突变体[25,36];第3种可提高类胡萝卜素总体含量的变异,如hp(高色素基因)能有效提植物高光合能力[37]。在类胡萝卜素合成途径中,除了转录水平上的调控外还存在转录后的调控,比如合成产物的积累会反作用于合成途径的关键基因,使基因表达受到影响[20]。
5 基因工程在类胡萝卜素方面的运用
自孟德尔遗传规律发现以来,对于基因的研究一直是生物界的核心内容。从20世纪50年代起,人们在这一方面的研究取得了飞速发展。植物育种方面,已由原始的育种方式转向与现代生物技术相结合的更为高效的育种方式,且更多的投入到控制某些性状基因的研究。到目前为止,基因工程在提高植物中类胡萝卜素含量等方面已经取得了一定的研究进展,较传统遗传育种方式更为明确、快速,运用范围广,而且番茄是研究类胡萝卜素合成遗传、生理生化以及分子生物学的模式植物,所以,利用基因工程对番茄类胡萝卜素的研究越来越广泛。
1956年就有研究[38]报道,hp突变植株能有效的提高类胡萝卜素的水平,但是伴随着这一突变而产生的植株矮小以及生活力衰退等问题,使得其在生产上的运用受到限制,含有该基因的渐渗系已被广泛收集,这为提高类胡萝卜素的研究提供了广泛的资源[39]。许多类胡萝卜素相关基因已成功导入番茄[40],但它们产生的作用各不相同。Bird等[41]将反义PSY1导入番茄,结果显示类胡萝卜素含量急剧下降,与此同时赤霉素含量上升;来自欧文氏菌的CrtI导入番茄后,β-胡萝卜素增高而番茄红素含量降低,同样来源的CrtB导入番茄后则使八氢番茄红素、番茄红素以及-胡萝卜素含量都增高[42-44];番茄 PSY1的 cDNA导入番茄,植株矮化,番茄红素积累提前;来自拟南芥的 β-Lcy的cDNA导入番茄后,结果显示在整体类胡萝卜素含量不降低的情况下,β-胡萝卜素得到增加[45];来自番茄的Det1导入番茄后,类胡萝卜素及黄酮类增加[46]。但是另外一些基因在导入番茄后出现了在果实中不表达的情况,如来自副球菌的CrtW和CrtZ。为防止导入外源基因引起的不良反应,在导入基因中一般选择番茄本身发现的基因,此外,启动子的选择也影响着基因的表达水平。有研究表明,Davuluri所用的启动子DET1对于控制果实中类胡萝卜素合成更为有效[46-47]。同样,类胡萝卜素在其他植物中也有研究,苦瓜中番茄红素合成酶(PSY)与番茄红素脱氢酶 (PDS)的表达程度是决定-胡萝卜素积累量的关键因素[48],实验中还通过组成成分分析 (PCA)证实,在果实不同成熟阶段类胡萝卜素的不同,且成熟果实中类胡萝卜素含量比未成熟果实含量高。
抑制番茄环化酶的表达是增加番茄红素含量最简便而又有效的方法。目前已有通过基因库中基因序列U46919和X86452构建成的在番茄果实中表达的有效载体,通过农杆菌转化法成功导入番茄植株并获得转化植株,结果表明,通过 RNAi法(RNA干扰法)操纵类胡萝卜素的合成可以高效提高植物中番茄红素的含量[49]。不同来源的 PSY导入番茄后,对增加植物中类胡萝卜素功效不同,Jacqueline Paine等[50]在研究黄金水稻中发现,来自黄水仙中的PSY在一定程度上限制 β-胡萝卜素的积累,而把从玉米中发现的PSY与来自欧文氏菌体的CrtI组合后导入植株,可使植株中总类胡萝卜素含量为普通黄金水稻的23倍,这也适用于其他植物。
除了通过导入类胡萝卜素合成途径中相关基因的方法来调控类胡萝卜素合成外,Schofield等[51]又加以光处理的方法进行研究。番茄果实是在黑暗中被光照射打断的条件下开始进入成熟,光中主要作用成分为红光,实验中暗处理过程用红光或者红光后加远红光 (R/FR)照射处理进行打断,使果实进入成熟阶段。实验结果显示,红光处理的类胡萝卜素积累量比在暗中或者R/FR处理的高50%,FR具有逆转类胡萝卜素积累作用,R/FR处理的类胡萝卜素积累在PSY的活性峰中也表现明显,这证实PSY可能是平衡调控基因。
6 番茄果实中类胡萝卜素研究存在问题及其展望
虽然植物、真菌等中含有类胡萝卜素,人及动物可从食物中获得类胡萝卜素,但类胡萝卜素在植物等中的含量并不高,不能满足人们的需要,因此,提高植物中类胡萝卜素含量是解决这一矛盾的重要途径。对于番茄而言,不同地区的人们倾向于不同色泽的果实,类胡萝卜素作为番茄成熟果实中的主要色素,其含量及各种类胡萝卜素的比例控制着成熟番茄果实的营养价值以及色泽。研究显示,植物中类胡萝卜素合成途径基本相似,但不同物种中合成途径相关基因在导入其他植物时其产生的效果各不相同,番茄中参与类胡萝卜素合成基因在番茄果实类胡萝卜素合成中的作用还有待进一步研究。目前许多研究者侧重于已发现的合成途径中主要限速酶及其基因的研究,可透彻了解这些环节的作用机制,但单纯对其中的某个基因的研究并不足以全面的调控类胡萝卜素的合成,因此对多个关键基因以及其他个别基因的研究也是不可或缺的。在研究控制番茄果实中类胡萝卜素合成途径中有关基因的同时也应注重基因间的相互作用和合成过程中产物对基因表达的调控,同样也要注重其他物质对类胡萝卜素的代谢的影响,比如糖类的积累。类胡萝卜素在番茄果实中的积累控制着果实颜色,如何调整类胡萝卜素在果实中的量及其各种类胡萝卜素的比例状况势必成为育种中改变果实颜色的重要手段,此外,叶绿体向有色体的转化及其转化程度,也同样控制着果实颜色,这些都有待进一步探讨研究。
[1] Dias M C,Vieiralves N F L,Gomes M,et al.Effects of lycopene,synbiotic and their association on early biomarkers of rat colon carcinogenesis [J].Food and Chemical Toxicology,2010,48(3):772-780.
[2] Guil-Guerrero J,Rebolloso-Fuentes M.Nutrient composition and antioxidant activity of eight tomato (Lycopersicon esculentum)varieties[J].Journal of Food Composition and Analysis,2009,22(2):123-129.
[3] GilmoreA M, YamamotoH Y. Linearmodelsrelating xanthophylls and lumen acidity to non-photochemical fluorescence quenching.Evidence that antheraxanthin explains zeaxanthin-independent quenching [J]. Photosynthesis Research,1993,35(1):67-78.
[4] Rodríguez-Bernaldo de Quirós A, Costa H S.Analysis of carotenoids in vegetable and plasma samples:A review [J].Journal of Food Composition and Analysis,2006,19(2):97-111.
[5] RaoA, Rao L. Carotenoids and human health [J].Pharmacological Research,2007,55(3):207-216.
[6] Porter J,Lincoln R.1.Lysopersicon selections containing a high content of carotenes and colorless polyenes.2. The mechanism of carotene biosynthesis [J]. Archives of Biochemistryand Biophysics,1950,27:390-403.
[7] Armstrong G A.Genetics of eubacterial carotenoid biosynthesis:a colorful tale[J].Annual Reviews in Microbiology,1997,51(1):629-659.
[8] Misawa N,Nakagawa M,Kobayashi K,et al.Elucidation of the Erwinia uredovora carotenoid biosynthetic pathway by functional analysis of gene products expressed in Escherichia coli[J]. Journal of Bacteriology, 1990, 172 (12):6704-6712.
[9] Moehs C P,Tian L,Osteryoung K W,ey al.Analysis of carotenoid biosynthetic gene expression during marigold petal development[J].Plant Molecular Biology,2001,45(3):281-293.
[10] Bramley P M.Regulation of carotenoid formation during tomato fruit ripening and development[J].Journal of Experimental Botany,2002,53(377):2107-2113.
[11] Hirschberg J.Carotenoid biosynthesis in flowering plants[J].Current Opinion in Plant Biology,2001,4(3):210-218.
[12] Apel W,Bock R.Enhancement of carotenoid biosynthesis in transplastomic tomatoes by induced lycopene-to-provitamin A conversion[J].Plant Physiology,2009,151(1):59-66.
[13] Rodrigo M J,Marcos J F,et al.Biochemical and molecular analysis of carotenoid biosynthesis in flavedo of orange(Citrus sinensis L.)during fruit development and maturation [J].Journal of Agricultural and Food Chemistry,2004,52(22):6724-6731.
[14] Benedict C,Rosenfield C,Mahan J,et al.The chemical regulation of carotenoid biosynthesis in citrus [J]. Plant Science,1985,41(3):169-173.
[15] Sato S,Tabata S,Hirakawa H,et al.The tomato genome sequence provides insights into fleshy fruit evolution [J].Nature,2012,485:635-641.
[16] 程孙亮,周宝利,马迎.红果番茄果实成熟过程中类胡萝卜素含量动态变化研究 [J].安徽农业科学,2007,35(22):6728-6728.
[17] Fraser P D,Truesdale M R,Bird C R,et al.Carotenoid biosynthesis during tomato fruit development(evidence for tissue-specific gene expression)[J].Plant Physiology,1994,105(1):405-413.
[18] 于洋,翁倩,周宝利.番茄果实成熟过程中不同部位类胡萝卜素和糖含量变化及其相关性 [J].沈阳农业大学学报,2012,42(6):683-687.
[19] Fraser P D,Kiano J W,Truesdale M R,et al.Phytoene synthase-2 enzyme activity in tomato does not contribute to carotenoid synthesis in ripening fruit[J].Plant Molecular Biology,1999,40(4):687-698.
[20] 刘仲齐,薛俊,金凤媚.番茄果实中类胡萝卜素的合成及其调控 [J].天津农业科学,2005,11(1):6-11.
[21] Ronen G,Carmel-Goren L,Zamir D,et al.An alternative pathway to β-carotene formation in plant chromoplasts discovered by map-based cloning of Beta and old-gold color mutations in tomato[J].Proceedings of the National Academy of Sciences,2000,97(20):11102.
[22] Kinzer S,Schwager S,Mutschler M.Mapping of ripeningrelated or-specific cDNA clones oftomato (Lycopersicon esculentum)[J].Theoretical and Applied Genetics,1990,79(4):489-496.
[23] Isaacson T,Ronen G,Zamir D,et al.Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of β-carotene and xanthophylls in plants [J].The Plant Cell,2002,14(2):333-342.
[24] 金凤媚,薛俊,郏艳红,刘仲齐.番茄果实颜色相关基因的研究进展 [J].天津农业科学,2006,12(4):3-6.
[25] Park H,Kreunen S S,Cuttriss A J,et al.Identification of the carotenoid isomerase provides insight into carotenoid biosynthesis, prolamellar body formation, and photomorphogenesis[J].The Plant Cell,2002,14(2):321-332.
[26] Skelton R L,Yu Q,Srinivasan R,et al.Tissue differential expression of lycopene β-cyclase gene in papaya [J].Cell Research,2006,16(8):731-739.
[27] Pecker I,Gabbay R,Cunningham F X,et al.Cloning and characterization of the cDNA for lycopene β-cyclase from tomato reveals decrease in its expression during fruit ripening[J].Plant Molecular Biology,1996,30(4):807-819.
[28] 李正国.果实成熟的基因调控 [J].生物工程进展,2000,20(3):30-34.
[29] DellaPenna D,Kates D S,Bennett A B.Polygalacturonase gene expression in Rutgers,rin,nor,and Nr tomato fruits [J].Plant Physiology,1987,85(2):502-507.
[30] Lintig J,Welsch R,Bonk M,et al.Light-dependent regulation of carotenoid biosynthesis occurs atthelevelofphytoene synthase expression and is mediated by phytochrome in Sinapis alba and Arabidopsis thaliana seedlings[J].The Plant Journal,1997,12(3):625-634.
[31] Fuentes P,Pizarro L,Moreno J C,et al.Light-dependent changes in plastid differentiation influence carotenoid gene expression and accumulation in carrotroots [J]. Plant Molecular Biology,2012:1-13.
[32] Carrari F,Fernie A R.Metabolic regulation underlying tomato fruit development[J].Journal of Experimental Botany,2006,57(9):1883-1897.
[33] Corona V,Aracri B,Kosturkova G,et al.Regulation of a carotenoid biosynthesis gene promoter during plant development[J].The Plant Journal,1996,9(4):505-512.
[34] Giovannoni J J. Fruit ripening mutants yield insights into ripening control[J].Current Opinion in Plant Biology,2007,10(3):283-289.
[35] Sandmann G.Molecular evolution of carotenoid biosynthesis from bacteria to plants[J].Physiologia Plantarum,2002,116(4):431-440.
[36] Ronen G,Cohen M,Zamir D,et al.Regulation of carotenoid biosynthesis during tomato fruit development:expression of the gene forlycopene epsilon-cyclase is down-regulated during ripening and is elevated in the mutant Delta[J].The Plant Journal,1999,17(4):341-351.
[37] Srinivas A,Behera R K,Kagawa T,et al.High pigment1 mutation negatively regulates phototropic signal transduction in tomato seedlings[J].Plant Physiology,2004,134(2):790-800.
[38] Reynard G.Origin of webb special(Black Queen)in tomato[J]. Report of the Tomato Genetics Cooperative,1956,6:22.
[39] Menda N,Semel Y,Peled D,et al.In silico screening of a saturated mutation library of tomato [J].The Plant Journal,2004,38(5):861-872.
[40] 马敬,姜娜娜,王兴军.利用基因工程改良植物类胡萝卜素的合成 [J].生物技术通报,2011(1):8-13.
[41] Bird C R,Ray J A,Fletcher J D,et al.Using antisense RNA to study gene function:inhibition of carotenoid biosynthesis in transgenic tomatoes[J].Nature Biotechnology,1991,9(7):635-639.
[42] Römer S,Fraser P D,Kiano J W,et al.Elevation of the provitamin A content of transgenic tomato plants [J].Nature Biotechnology,2000,18(6):666-669.
[43] Fraser P D,Romer S,Shipton C A,et al.Evaluation of transgenic tomato plantsexpressing an additionalphytoene synthase in a fruit-specific manner[J].Proceedings of the National Academy of Sciences,2002,99(2):1092.
[44] 张建成,周文静,邓秀新.超表达草生欧文氏菌crtB基因促进转基因番茄类胡萝卜素合成的研究 [J].园艺学报,2010,37(3):390-396.
[45] Rosati C, AquilaniR, DharmapuriS, etal. Metabolic engineering of beta-carotene and lycopene content in tomato fruit[J].The Plant Journal,2000,24(3):413-420.
[46] Davuluri G R,Van Tuinen A,Fraser P D,et al.Fruit-specific RNAi-mediated suppression of DET1 enhances carotenoid and flavonoid content in tomatoes [J]. Nature Biotechnology,2005,23(7):890-895.
[47] Enfissi E M A,Fraser P D,Bramley P M.Genetic engineering of carotenoid formation in tomato[J].Phytochemistry Reviews,2006,5(1):59-65.
[48] Tuan P A,Kim J K,Park N I,et al.Carotenoid content and expression of phytoene synthase and phytoene desaturase genes in bitter melon(Momordica charantia)[J].Food Chemistry,2011,126(4):1686-1692.
[49] Wan Q,Zhang X G,Song M.Fruit-specific RNAi-mediated restraining expression of Lcy gene to enhance lycopene content in tomatoes[J].Chinese Journal of Biotechnology,2007,23(3):429-434.
[50] Paine J A,Shipton C A,Chaggar S,et al.Improving the nutritional value of Golden Rice through increased pro-vitamin A content [J]. Nature Biotechnology, 2005, 23 (4):482-487.
[51] Schofield A,Paliyath G.Modulation of carotenoid biosynthesis during tomato fruit ripening through phytochrome regulation of phytoene synthase activity [J]. Plant Physiology and Biochemistry,2005,43(12):1052-1060.

