苜蓿褐斑病菌离体叶片接种方法及侵染途径观察
王华荣,史 娟,2,任 斌
(1.宁夏大学农学院,宁夏 银川750021;2.西部土地退化与生态恢复国家重点实验室培育基地,宁夏 银川750021)
苜蓿褐斑病是由苜蓿假盘菌(Pseudopeziza medicaginis)引致的叶部病害,在全世界各苜蓿种植区均有不同程度的发生,特别是在气候冷凉和高海拔地区,更为严重和普遍[1-2]。在中国,苜蓿褐斑病是严重威胁苜蓿生产的重要病害,主要分布在西北、华北、东北等苜蓿栽培区,流行年份可使苜蓿减产40%~60%,落叶3%~73%,严重影响苜蓿的产量和品质,成为生产优质苜蓿的主要生物限制因子之一[3]。近十年来,随着苜蓿产业的发展,苜蓿褐斑病的研究得到了长足发展,研究内容涉及细胞和分子生物学领域[4-8]。草地生态系统的特殊性,在一定程度上限制了化学农药的使用,因此,生产中通过种植抗病品种控制其流行危害,是目前苜蓿生产中急需解决的课题之一。
鉴定和评价苜蓿种质资源对褐斑病的抗病性,是选育和利用抗病品种的基础,这些基础工作离不开病害的人工接种。自然状态下,苜蓿假盘菌在叶片上形成成熟的子囊盘随落叶进入土壤中越冬,翌年当雨水较多时,子囊孢子弹射至叶片上完成初侵染,侵染关系建立后,随着病菌在叶片组织内的扩展,形成直径约1mm的子囊盘。由于子囊孢子的成熟和释放直接影响接种效果,有关苜蓿褐斑病的接种技术,一直是国内外研究者关注的问题[9-11],目前虽筛选出了一些接种方法,但接种效果差异较大。为了筛选出适宜的接种方法,完善该病害的实验研究技术,本研究选用5种接种方法进行了接种效果的对比,以期筛选出接种量高、污染少的接种技术,并利用该方法对苜蓿假盘菌子囊孢子的萌发和侵入情况进行扫描电镜观察。
1 材料与方法
1.1 供试菌种、苜蓿品种及其培养、繁殖 苜蓿假盘菌分离自宁夏固原原州区苜蓿引种试验区的阿尔冈金(Medicagosativacv.Algonquin)病叶。挑取20%V8汁CaCO3平板上分离培养的苜蓿假盘菌菌落,加入适量的灭菌水捣碎,制成菌落悬浮液,移入20%V8汁CaCO3培养基上扩繁。
供试苜蓿品种为德国大叶(M.sativacv.Germany),由宁夏大学草业科学研究所提供。按常规方法种植于直径为30cm的花盆内,正常管理。株高生长至10cm左右时剪取生长一致的苜蓿叶片(保留叶柄),用灭菌水冲洗2遍后,置于底部铺有保湿滤纸的无菌培养皿内待用。
1.2 接种方法 选用以下5种接种方法,利用离体的苜蓿叶片进行接种试验。
逆向产孢培养法:将V8培养基上成熟的苜蓿假盘菌菌落挑出,移至底部铺有灭菌滤纸的培养皿盖上,置于20℃、黑暗条件下保湿4~6h,取出置于苜蓿叶片的正上方,利用子囊盘自然弹射进行接种,2~4h后将接种菌落移出。为了保证离体叶片上有足够的游离水,不定期地用灭菌水对接种后的离体叶片进行喷雾。
菌落悬浮液涂抹法:选取生长30d左右成熟的菌落,置于灭菌小烧杯中,加入灭菌水2mL,用灭菌的镊子充分将菌落捣碎,制成菌落悬浮液,用洁净毛笔刷将悬浮液涂抹在苜蓿叶片上。
菌落接种法:将成熟的菌落置于每个叶片中间,喷灭菌水保湿、盖上培养皿盖。
病叶接种法:将田间采集的苜蓿褐斑病病叶用灭菌水反复冲洗后,置于烧杯中,加入适量的灭菌水4℃下浸泡48h左右,取出置于湿润的滤纸上,将滤纸放入培养皿盖或瓷盘上,倒置在苜蓿叶片上方。
孢子悬浮液喷雾法:将配制好的菌落悬浮液转入常规离心机离心后取上清液即为孢子悬浮液,悬浮液浓度为(3.0×105)~(1.5×106)mL-1,将孢子悬浮液移入小型喷雾器内对苜蓿叶片进行喷雾接种。
将接种后的苜蓿叶片均置于20℃黑暗条件下培养。
1.3 接种结果观察 于接种后8h取样,将接种的苜蓿叶片透明后置于光镜下观察孢子数量及其萌发状况。样品的脱色和透明处理:首先用脱色液脱色14h(脱色液的体积比为三氯乙酸∶乙醇∶氯仿=0.3∶150∶50),其次用饱和的水合三氯乙醛[CCl3CH(OH)2](2.5g·mL-1)进行透明[12]24h。40%甘油制片,Olympus微分干涉相差显微镜观察和拍照。
1.4 扫描电镜(SEM)样品的制备与观察 分别于接种后6、12、24h取样,并将叶片切成1cm2的小块,按康振生[13]的方法处理样品。先将样品在4%的戊二醛磷酸缓冲液(0.1mol·L-1、pH值6.8)中于4℃下固定8~12h。然后用相同的缓冲液冲洗2h、系列乙醇脱水,醋酸异戊脂置换,二氧化碳临界点干燥、粘样、喷金后,在JEOL-JSM-6360LV型扫描电镜下观察、拍照。
2 结果与分析
2.1 接种效果比较 比较5种接种方法,接种到苜蓿叶片上的孢子数量明显不同(图1),其中以逆向产孢培养法接种孢子数量最多,平均每个叶片60多个;其次是病叶接种法,平均达28个;菌落接种法,平均为21个;孢子悬浮液喷雾法接种,平均为12个;菌落悬浮液涂抹法接种最少,平均为6个。接种质量也明显不同,逆向产孢培养法接种到叶片上的孢子整齐、干净,叶片表面没有杂质(图2),而菌落叶片接种法虽释放出一定量的孢子,但叶片和菌落接触的部位易造成损伤,影响结果观察;病叶接种优于菌落和孢子悬浮液接种法,但病叶上附生的杂菌同时也接种到叶片上,干扰了结果的观察;效果最差的为孢子和菌落悬浮液接种法,不仅接种孢子数量少,且叶片表面有很多的杂质及未破碎的子囊和子囊盘。用逆向产孢培养法无论是接种在水琼脂表面还是苜蓿叶面的孢子,不仅数量较多,整齐一致,且叶面干净,有利于接种结果的观察(图3)。通过比较分析认为,逆向产孢培养法优于其他4种接种方法,是该病害较为理想的接种方法。
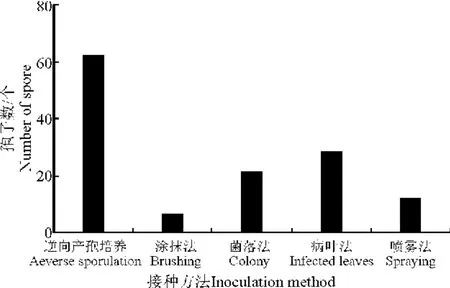
图1 5种接种方法的孢子数Fig.1 Number of spores by different inoculation methods

图2 逆向产孢培养法接种在水琼脂表面的子囊孢子Fig.2 Ascospore on the surface of water agar surface naturally ejected by reverse spore-generating method

图3 逆向产孢培养法接种到苜蓿叶片表面的子囊孢子(标迟为10μm)Fig.3 Ascospore on the surface of alfalfa leaf naturally ejected by reverse spore-generating method(Yardstick:10μm)
2.2 苜蓿褐斑病菌侵入途径的SEM观察光镜和扫描电镜观察发现,接种到苜蓿叶片上的子囊孢子为卵圆形,2~4h开始萌发(图3-1,图4-1),平板统计4h萌发率超过90%。从孢子的中部萌发产生单根芽管,两端不萌发,12~24h萌发的芽管直接侵入苜蓿叶片组织(图3-2,图4-2)。半薄切片清晰地显示出芽管以机械方式穿透寄主表皮组织,直接进入表皮细胞,穿透部位的细胞壁未观察到缢缩现象(图4-4),且侵入到表皮细胞中的菌丝未观察到膨大现象。同时还观察到叶片上的部分孢子从叶片的细胞胞间隙处侵入(图4-3),24h以后,成功侵入的孢子整体开始出现坍陷(图4-2)。从孢子萌发到侵入苜蓿叶片组织未观察到附着胞等侵染结构的形成,但少数孢子芽管顶端略有膨大(图3-2,图4-3),12至24h内孢子基本完成接触、萌发到侵入的全过程。在观察过程中发现,绝大多数孢子在叶片上以芽管直接侵入,仅有少数孢子通过细胞胞间隙侵入,但始终未观察到孢子由气孔侵入。这表明接种至叶片上的P.medicaginis侵入部位没有选择性,除气孔之外,叶片上的任何部位都可以侵入,机械穿透是苜蓿褐斑病菌最主要的侵入方式。

图4 苜蓿假盘菌子囊孢子在寄主叶表萌发和侵入的扫描电镜图Fig.4 Ascospore on the surface of host leave naturally ejected by reverse spore-generating method
3 讨论
本研究采用5种接种方法,通过接种量和叶面有无杂菌污染等进行对比,筛选出适宜于苜蓿假盘菌的接种方法为逆向产孢培养法。该方法操作简单、快速,接近自然状态下的孢子释放,且接种孢子数量多、均匀,叶片没有杂菌和杂质污染,可清晰地观察到试验结果,是一种理想的室内实验接种技术。孢子悬浮液喷雾接种法是叶部病害常用的接种方法,对于苜蓿假盘菌来说喷雾法则不太理想,原因可能是子囊孢子不同于分生孢子,需从子囊中释放出来才能进行有效的接种。国内学者报道利用不同缓冲液配制的孢子悬浮液是比较理想的接种方法[9],这可能是缓冲液中的葡萄糖有利于孢子释放,而使得配制的孢子悬浮液中游离的孢子数量增多。利用田间发病的病叶进行接种,取决于子实体的发育程度。除此之外,病叶浸泡程度达不到子囊盘的充分吸涨,孢子也不能释放。国外研究者[10-11]利用田间感病的病株或病叶作为接种源,悬挂于接种苜蓿的上方进行接种。但是该方法接种至叶片上的杂菌比较多,影响接种效果。本研究通过扫描电镜观察,利用逆向产孢培养法接种苜蓿叶片,首次证实了P.medicaginis以机械穿透的方式侵入寄主组织,侵入途径没有选择性,可以是叶片上的任何一个部位,少数孢子也可以从细胞胞间隙处侵入,但始终未观察到孢子由气孔侵入以及孢子侵入前形成附着胞等侵染结构。苜蓿假盘菌子囊孢子不形成侵染结构,以芽管直接侵入,这一现象说明,芽管除了机械穿透外,可能涉及化学侵入的酶解作用。前人[14]有研究表明,没有明显侵染结构分化的真菌,致病主要靠酶解而不是机械穿透力。关于苜蓿假盘菌依靠何种力量侵入寄主,尚有待于进一步系统研究。这些研究结果的获得,将会为进一步阐明苜蓿假盘菌侵入机制提供线索。弹射到叶片表面的成对的孢子被一层膜包裹,这与 Morgan和Parbery[14]观察到的结果一致。猜测膜的作用可能是将孢子黏附在叶片表面,起到固定的作用,也可能是粘膜能够保持一定的水分,以满足释放到体外孢子的萌发,从而更有利于在短时间内侵入寄主。Morgan和Parbery[14]通过超显微研究还发现,成对的孢子被包围在一个普通的膜囊内,成对孢子外围腊状晶体结构有饰纹,每一部分的边缘有轻微的隆起,并得出成对的孢子有助于孢子附着在寄主表面。
4 结论
适宜于苜蓿褐斑病的室内接种方法为逆向产孢培养法,该方法为病害的细胞学和分子生物学方面的研究提供了接种技术。P.medicaginis子囊孢子侵入前不形成附着胞等侵染结构,主要的侵入途径可以是叶片上除气孔之外的任何部位,以机械穿透直接侵入寄主细胞。
致谢:本论文中的扫描电镜研究在西北农林科技大学陕西省农业分子生物学重点实验室完成,在此谨表谢意。
[1]南志标.我国的苜蓿病害及其综合防治体系[J].动物科学与动物医学,2001,18(4):1-4.
[2]袁庆华,李向林,张文淑.苜蓿假盘菌及其生物学特性研究[J].植物保护,2001,27(1):8-12.
[3]张蓉,马建华,杨芳,等.宁夏苜蓿主要病害田间发生规律的研究[J].石河子大学学报,2004,22:168-171.
[4]史娟,韩青梅,张宏昌,等.苜蓿假盘菌侵染苜蓿叶片的细胞学研究[J].菌物学报,2008,27(2):183-192.
[5]王瑜,袁庆华,李向林,等.与苜蓿褐斑病(CLS)抗性基因连锁的SRAP标记研究[J].中国农业科学,2010,43(2):438-442.
[6]袁庆华,张君艳.苜蓿假盘菌ISSR反应体系优化及指纹图谱构建[J].草地学报,2008,16(1):117-22.
[7]毕波,王瑜,袁庆华.苜蓿褐斑病抗性相关分子标记验证[J].草地学报,2011,19(4):663-667.
[8]孟芳,袁庆华,苏德荣.苜蓿抗褐斑病基因ISSR标记的筛选及验证[J].植物保护,2008,34(4):46-49.
[9]宋卫玲,袁庆华.苜蓿褐斑病接种方法研究[J].中国草地学报,2006,28(5):38-41.
[10]Pratt R C.Screening for resistance toSclerotiniatrifuliorumin alfalfa by inoculation of excised leaf tissue[J].Phytopcothology,1996,86:923-928.
[11]Cohen R.A leaf assay for detection of resistance of melons toSphaerothecafuliginearece [J].Plant Disease,1993,77:513-517.
[12]张敬泽,徐同.柿树炭疽菌侵染不同柿树种、品种和部位的 细 胞 学 研 究 [J].菌 物 系 统,2005,24(1):116-112.
[13]康振生.植物病原菌超微结构[M].北京:中国科学技术出版社,1996.
[14]Morgan W C,Parbery D G.Ascospore liberation,ger-mination and attachment to host surface byPseudopezizamedicaginis[J].Australian Journal of Agricultural Research,1977,28(5):777-784.

