花色素苷在丁香新生叶光合机构中的作用
张会慧,张秀丽,李 鑫,王良再,胡举伟,孙广玉
花色素苷在丁香新生叶光合机构中的作用
张会慧,张秀丽,李 鑫,王良再,胡举伟,孙广玉
(东北林业大学 生命科学学院,黑龙江 哈尔滨 150040)
以叶片富含花色素苷的紫丁香Syringa oblata和花色素苷含量低的紫丁香变种白丁香Syringa oblata var. alba为试验材料,研究了丁香新生叶、半展开叶和展开叶中花色素苷对叶片光合机构的影响。结果表明:紫丁香新生叶片叶绿素含量较低,而花色素苷含量较高,其含量是白丁香叶片的17.3倍,单位反应中心吸收的光能(ABS/RC)低于白丁香20.17﹪,并且吸收的光能用于电子传递的比例(φEo)和单位反应中心用于电子传递比例(ETo/RC)也显著低于白丁香,紫丁香新生叶片的光化学效率和电子传递速率明显低于白丁香。紫丁香新生叶片中的花色素苷减少了PSⅡ对光能的吸收,降低了PSⅡ反应中心的光能转换效率和原初反应速度,因此,紫丁香新生叶片激发能产生的数量明显低于白丁香。白丁香新生叶片中叶绿素含量较高,叶片中花色素苷含量较低,比紫丁香叶片吸收光能的能力强,其新生叶片中有活性的反应中心的数量和反应中心的活性较高,对光能的利用能力明显高于紫丁香; 白丁香新生叶片的非光化学淬灭(NPQ)、非光化学猝灭的最大量子产额(φDo)和单位反应中心耗散掉的能量(DIo/RC)明显高于紫丁香。因此可以推断花色素苷改变了紫丁香和白丁香新生叶对光能吸收和利用的途径和过剩光能耗散的方式。
丁香属;花色素苷;光合机构; 光保护
花色素苷是一类普遍分布于植物花瓣、果实、茎和叶片等器官的水溶性类黄酮色素,目前已知有27个科73个属植物有花色素苷的存在[1]。植物叶片中的花色素苷主要存在于细胞的液泡中,不同植物叶片中的花色素苷分布有一定的差异,有些植物的花色素苷存在于植物上表皮细胞中,有些植物则分布在表皮细胞之下的细胞液泡中[2]。植物叶片花色素苷的吸收光谱位于400~600 nm波长范围,与光合色素的吸收光谱处于相似的范围内,因此,叶片中花色素苷的存在必然影响到光合色素的光能吸收,从而影响到植物的光合能力[3]。并且有研究表明,叶片中花色素苷的合成与叶绿素的降低有关[4],积累花色素苷的红色彩叶草Coleus blumei 叶片的光合放氧能力明显低于没有花色素苷的绿色叶片[4]。但是,当植物叶片吸收光能出现过剩时,叶片花色素苷可吸收和过滤入射的高强度的太阳光中的蓝紫光而保护叶片下表皮细胞下方的细胞[6],减轻光氧化伤害[7],花色素苷起到了光过滤和光衰减的作用。
丁香是我国北方重要的绿化树种之一,种类多样,其中紫丁香和白丁香是两个常见的绿化树种,白丁香Syringa oblata var. alba为紫丁香Syringa oblata的变种,二者除了花的颜色不同之外,白丁香在春季伸出的叶片呈现绿色,花色素苷含量较低,而紫丁香呈现红色,叶片含有很高的花色素苷。两种丁香叶片花青素含量的差别为研究花色素苷在植物光保护方面的作用提供了材料。为此,本文以两种丁香为材料,探讨两种丁香叶片在伸展和完全展开两种生长状态下花青素苷对光能吸收和利用的影响,尤其是花色素苷在光合机构中电子传递、PSⅡ光化学特性等方面的作用,为揭示花色素苷在植物叶片光合作用的功能提供参考。
1 材料与方法
1.1 试验材料
试验于2011年5月在哈尔滨市东北林业大学城市林业示范基地进行,供试丁香品种为紫丁香Syringa oblata和白丁香Syringa oblata var. alba,白丁香属于紫丁香的一个变种,其叶片比紫丁香没有或花色素苷含量极低(见图1)。两个丁香作为研究花青素的作用是很好的对比材料。试验中选择树龄和长势相对一致的当年生新生枝条进行测定。

图1 紫丁香和白丁香叶片颜色差异Fig.1 Differences of color on Syringa oblata and Syringa oblata var. alba new leaves
1.2 测定参数和方法
叶绿素和花色素苷含量的测定:分别选择紫丁香和白丁香新生枝条上从上往下数第1、2和第3对叶片记为新生叶片、半展开叶片和完全展开叶片,避开叶片的主叶脉取样,测定其叶绿素含量、叶绿素a和b的含量,并计算叶绿素a和b的比值[8];花色素苷含量的测定按照Pirie and Mullins[9]等的方法。
叶绿素荧光参数的测定:分别将两种丁香的新生叶片、半展开叶片和完全展开叶片进行30 min暗适应,然后利用便携式脉冲调制荧光仪FMS-2(Hansatch公司,英国)参照Hu等的方法[10]分别测定其初始荧光(Fo)、最大荧光(Fm)、PSⅡ的最大光化学效率(Fv/Fm)、PSⅡ的潜在光化学活性(Fv/Fo)、电子传递速率(ETR)以及非光化学淬灭(NPQ)等;利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100max,捷克)分别测定两种丁香的新生叶片、半展开叶片和完全展开叶片的快相叶绿素荧光诱导曲线(OJIP),得到叶绿素荧光参数:OJIP曲线上2 ms时的相对可变荧光(VJ)、荧光上升的初始斜率(Mo)、有活性反应中心的开放程度(Ψo)、原初光化学反应的最大量子产额(φPo)、非光化学猝灭的最大量子产额(φDo)、吸收光能用于QA-以后的电子传递的能量比例(φEo)、单位反应中心吸收的光能(ABS/RC)、单位反应中心捕获的用于还原QA的能量(TRo/RC)、单位反应中心捕获的用于电子传递的能量(ETo/RC)和单位反应中心耗散掉的能量(DIo/RC)等。
1.3 数据处理方法
运用Excel和SPSS软件对测定数据进行统计分析,图中数据为3 次重复的平均值±标准差(SE),并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
2 结果与分析
2.1 紫丁香和白丁香叶片叶绿素和花色素苷含量变化
由图1可以看出,两种丁香在不同发育阶段叶片中的花色素苷含量明显不同,紫丁香新生叶片和半展开叶片的花色素苷含量分别是白丁香的17.3倍和7.5倍,叶片完全展开时,紫丁香叶片的花色素苷急剧下降,与白丁香叶片花色素苷含量之间的差异没有达到显著水平(P>0.05)。丁香新生叶片的总叶绿素、叶绿素a和叶绿素b含量低于展开叶片,两种丁香比较,紫丁香新生叶片的总叶绿素含量、叶绿素a和叶绿素b含量分别低于白丁香34.09﹪(P<0.05)、33.62﹪(P<0.05)和54.97﹪(P<0.05)。两种丁香叶片中叶绿素a/b表现为新生叶片<半展开叶<展开叶,紫丁香新生叶片的叶绿素a/b值低于白丁香5.79﹪(P<0.05)。

图2 紫丁香和白丁香叶片叶绿素和花色素苷含量的差异Fig.2 Differences of chlorophyll and anthocyanin content in Syringa oblata and Syringa oblata var. alba new leaves
2.2 花色素苷对叶片Fo、Fm、Fv/Fm和ETR的影响
随着两种丁香叶片的展开,Fm、和Fv/Fo呈增加趋势,但Fo却没有发生明显的变化(P>0.05),紫丁香完全展开叶的Fm、Fv/Fm、Fv/Fo和分别高于白丁香 7.69﹪(P< 0.05)、1.39﹪(P<0.05)、10.22﹪(P < 0.05)和 17.11﹪(P < 0.05),均达显著差异水平,但紫丁香新生叶片的Fv/Fm和Fm和ETR均明显低于白丁香(P<0.05),白丁香新生叶片吸收的光能除了维持正常用的电子传递外,非光化学淬灭(NPQ)也显著高于紫丁香42.54﹪(P<0.05),达显著差异水平。
2.3 花色素苷对丁香叶片光合电子传递连上QA-氧化还原状态的影响
两种丁香在叶片展开过程中,VJ和Mo均呈现降低的趋势,就两个丁香品种而言,紫丁香半展开叶和完全展开叶的VJ和Mo均显著低于白丁香,说明紫丁香展开叶的光合能力优于白丁香,这与图3中的Fv/Fm和ETR的变化结果相符,但紫丁香新生叶片中VJ和Mo分别低于白丁香8.45﹪(P<0.05)和29.28﹪(P<0.05)。

图3 紫丁香和白丁香叶片叶绿素荧光参数的差异Fig.3 Differences of chlorophyll fluorescence characteristic in Syringa oblata and Syringa oblata var. alba new leaves
2.4 花色素苷对丁香叶片光合能量分配的影响
随着叶片的展开丁香叶片PSⅡ电子受体侧QB位点的改变和PQ库容量增加(图4),两种丁香叶片原初光化学反应的最大量子产额φPo和用于电子传递链上QA-以后的电子传递能量比例φEo增加,用于热耗散的比例和φDo减少,紫丁香新生叶片φPo和φEo分别低于白丁香4.99﹪(P<0.05)和9.68﹪(P<0.05),均达到显著差异水平,而白丁香新生叶片用于热耗散的比例和φDo高于紫丁香8.65﹪(P<0.05),并且紫丁香新生叶片OJIP曲线上2 sm时有活性反应中心的开放程度(Ψo)也低于白丁香8.75﹪(P<0.05),达显著差异水平。
2.5 花色素苷对丁香叶片单位PSⅡ反应中心比活参数的影响
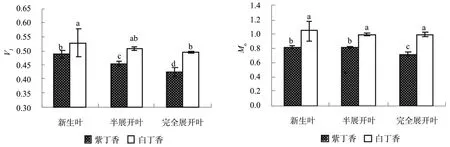
图4 紫丁香和白丁香叶片光合电子传递连上QA-氧化还原状态的差异Fig.4 Differences of QA- oxidation in Syringa oblata and Syringa oblata var. alba new leaves
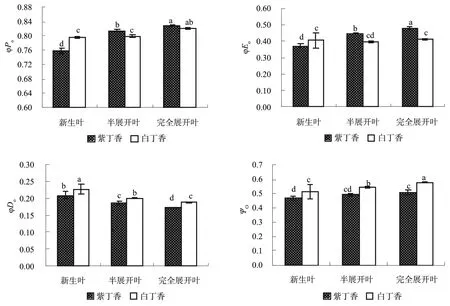
图5 紫丁香和白丁香叶片能量分配参数的差异Fig.5 Differences of energy flux ratios in Syringa oblata and Syringa oblata var. alba new leaves
ABS/RC、TRo/RC、ETo/RC和DIo/RC分别反映了单位反应中心吸收的光能、单位反应中心捕获的用于还原QA的能量、单位反应中心捕获的用于电子传递的能量和单位反应中心耗散掉的能量[11],由图6可以看出,由于紫丁香新生叶片单位反应中心吸收的光能ABS/RC低于白丁香20.17﹪(P<0.05),从而导致其TRo/RC、ETo/RC和DIo/RC低于白丁香,特别是紫丁香新生叶片DIo/RC低于白丁香24.84﹪(P<0.05),达显著差异水平,并且紫丁香展开叶和半展开叶的ABS/RC、TRo/RC、ETo/RC和DIo/RC也均显著低于白丁香。
3 讨 论
高等植物叶片的的色素主要有叶绿素类、类胡萝卜素类和花色素苷三大类[12]。本研究中,紫丁香新生叶片的总叶绿素含量、叶绿素a和b含量均明显低于白丁香,但其花色素苷含量却明显高于白丁香,已有研究证明花色素苷在叶片中会起到过滤[13]、衰减[14]以及反射[15]光能的作用,Gould[16]等的研究结果均发现植物叶片中花色素苷的屏障作用会使用叶片具有阴生特性,本试验结果发现紫丁香叶片的叶绿素a/b值显著低于白丁香,说明紫丁香的新生叶片具有阴生特点,这同样与Kyparissis[17]在Prunus cerasifera上的研究结果一致,因此紫丁香新生叶片主要通过形成花色素苷含量来降低光能的吸收,因此不论是从叶绿素还是从花色素苷含量的变化角度均可以说明紫丁香新生叶片对光能的吸收能力显著低于白丁香。所以,紫丁香新生叶片主要通过增加花色素苷含量、降低叶绿素含量以及调整叶绿素a /b的比值的方式来降低光能的吸收防止过剩激发能的产生。

图6 紫丁香和白丁叶片ABS/RC, TRo/RC, ETo/RC and DIo/RC的差异Fig.6 Differences of ABS/RC, TRo/RC, ETo/RC and DIo/RC in Syringa oblata and Syringa oblata var. alba new leaves
随着叶片的展开,两种丁香电子传递链上PQ库容量增加[18],ETR增加导致叶片的Fv/Fm和Fo/Fm增加,研究表明,当叶片发生光抑制或光破坏Fv/Fm下降的同时常伴随Fo的升高[19],但本试验中初始荧光(Fo)随着叶片的展开却没有明显的变化,因此两种丁香叶片展开过程中只是光化学效率的增加,新生叶片在自然条件下虽然光能利用能力较低,但并没有发生光抑制或光破坏;紫丁香新生叶片的Fv/Fm和Fm和ETR均明显低于白丁香,说明紫丁香新生叶片的光能转换效率和电子传递速率较低,光合作用的原初反应速度较慢,但这可以减少形成过剩激发能的机会,对叶片的光合机构起到种保护作用,虽然白丁香新生叶片叶绿素含量较高,而且没有花色素苷的保护作用,对光能的吸收能力较强,电子传递速率和最大光化学效率均显著高于紫丁香,因此,白丁香不但光化学能量耗散的较紫丁香强,并且过剩的光能主要通过增加非光化学能量耗散及时耗散,从而避免光系统的损害。
由于紫丁香新生叶片的叶绿素含量较低而花色素苷含量较高,叶片对光能的捕获和吸收能力较差,从而导致紫丁香新生叶片的φPo和ETo/RC均显著低于白丁香,VJ和Mo也显著低于白丁香,说明紫丁香新生叶片的光能转换效率和电子传递速率较低,QA-的积累量和电子传递链的还原程度较低,光合作用的原初反应速度较慢,但这可以减少形成过剩激发能的机会。白丁香新生叶片用于热耗散的比例和φDo高于紫丁香,同样说明了白丁香主要通过增加热能热耗的形式来减轻激发能对PSⅡ反应中心的压力,这与图3中NPQ的变化结果相同。此外,紫丁香新生叶片Ψo显著低于白丁香,说明紫丁香新生叶片光合系统捕获光能用于推动电子进入QA-以后的能量比例较低,有效地缓解了电子传递链的还原程度,这也是紫丁香新生叶片为减轻过剩激发能对PSⅡ反应中心造成伤害的一种防御机制。
单位反应中心比活参数的变化不但可以分析叶片对光能的吸收和利用情况,而且是说明叶片有活性反应中心数量和反应中心活性的重要指标[20],由于紫丁香叶片单位反应中心吸收的光能ABS/RC较低,从而导致其TRo/RC、ETo/RC和DIo/RC低于白丁香,并且紫丁香展开叶和半展开叶的ABS/RC、TRo/RC、ETo/RC和DIo/RC始终低于白丁香,但紫丁香完全展开叶片的φPo高于白丁香(图4),因此虽然紫丁香完全展开叶φEo较白丁香高,而单位反应中心比活参数TRo/RC、ETo/RC却较低,其原因是由于紫丁香完全展开叶片有活性的反应中心数量较多引起的,说明紫丁香完全展开叶的光合性能强于白丁香,这与图3的变化结果相符,而在新生叶片中,紫丁香TRo/RC、ETo/RC、φPo和φPo均低于白丁香(图5),所以紫丁香新生叶片TRo/RC、ETo/RC的降低主要是由于吸收光的降低引起的,同样说明了花色素苷在紫丁香新生叶片中具有降低光能吸收的作用,即紫丁香新生叶片主要通过降低光能的吸收来保护叶片的光合机构。
4 结 论
紫丁香新生叶片叶绿素含量较低,叶片中有大量花色素苷的存在,叶片主要能过减少对光能的吸收、降低PSⅡ反应中心的光能转换效率和原初反应速度来降低激发能的产生,而白丁香新生叶片叶绿素含量较高,对光能的吸收能力较强,叶片中没有花色素苷的存在,但其叶片的光合机构发育的比较完善,新生叶片中有活性的反应中心的数量和反应中心的活性较高,吸收的光能除了维持正常用的电子传递启动光化学作用以外,过剩的能量主要通过非光化学能量耗散的形式及时耗散,降低了反应中心的压力。
[1] Gould K S, Kuhn D N, Lee D W, et al. Why leaves are sometimes red[J]. Nature, 1995, 378: 241–242.
[2] Gould K S, Markham K R, Smith R H, et al. Functional role of anthocyanins in the leaves of Quintilia serrata A.Cunn[J].Journal of Experimental Botany, 2000, 51: 1107–1115.
[3] 王良再, 胡彦波, 张会慧, 等. 植物叶片花青素的光破坏防御机制研究进展[J].应用生态学报, 2012,23(3):835-841.
[4] 陈晓林,陈建华,侯伯鑫,等.不同品种红花檵木光合特性的比较分析[J].中南林业科技大学学报,2010, 30(5):117-122.
[6] Dodd IC, Critchley C, Woodall GS, et al. Photoinhibition in differently coloured juvenile leaves of species[J]. Journal of Experimental Botany, 1998, 49: 1437–1445.
[6] Chalker-Scott L. Environmental significance of anthocyanins in plant stress responses[J]. Photochemistry and Photobiology,1999, 70: 1–9.
[7] Steyn W J, Wand S J E, Holcroft D M, et al. Anthocyanins in vegetative tissues: a proposed unified function in photoprotection[J]. New Phytologist, 2002, 155: 349–361.
[8] 王晶英, 敖 红, 张 杰, 等. 植物生理生化实验技术与原理[M]. 哈尔滨: 东北林业大学出版社, 2003: 135-136.
[9] Pirie A, Mullins M G. Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose,nitrate, and sbscisic acid[J]. Plant physiology, 1976, 58, 468–472.
[10] Hu Y B, Sun G Y, Wang X C. Induction characteristics and response of photosynthetic quantum conversion to changes in irradiance in mulberry plants[J]. Journal of Plant physiology,2007, 164: 959–968.
[11] 张会慧, 张秀丽, 许 楠, 等. 外源钙对干旱胁迫下烤烟幼苗光系统Ⅱ功能的影响[J]. 应用生态学报, 2011, 22(5): 1195–1200.
[12] 姜卫兵, 庄 猛, 韩浩章, 等. 彩叶植物呈色机理及光合特性研究进展[J]. 园艺学报, 2005, 32(2): 352-358.
[13] Chalker-Scott L. Environmental significance of anthocyanins in plant stress responses[J]. Photochemistry and Photobiology,1999, 70: 1–9.
[14] Gould K S. Nature's swiss army knife: the diverse protective roles of anthocyanins in leaves[J]. Journal of Biomedicine and Biotechnology, 2004, 5: 314–320.
[15] Lee D W, Lowry J B, Stone B C. Abaxial anthocyanin layer in leaves of tropical rainforest plants: enhancer of light capture in deep shade[J]. Biotropica, 1979, 11: 70–77.
[16] Gould K S, Vogelmann T C, Han T, et al. Profiles of photosynthesis within red and green leaves of Quintinia serrata A.Cunn[J]. Physiologia Plantarum, 2002, 116, 127–133.
[17] Kyparissis A, Grammatikopoulos G, Manetas Y. Leaf morphological and physiological adjustments to the spectrallyselective shade imposed by anthocyanins in Prunus cerasifera[J].Tree Physiology, 2007,27, 849–857.
[18] 张会慧,张秀丽,胡彦波,等.碱性盐胁迫下桑树幼苗叶片叶绿素荧光特性和激发能分配[J].经济林研究,2011,29(1):6-12.
[19] 张会慧,赵 莉,许 楠,等.间作模式下桑树和大豆叶片光合日变化特点[J].经济林研究,2011,29(1):21-26.
[20] 张会慧, 张秀丽, 朱文旭, 等. 桑树叶片光系统Ⅱ对NaCl和Na2CO3胁迫的响应[J]. 北京林业大学学报, 2011, 33(6): 15-20.
Functional role of anthocyanin to photosynthetic apparatus in young leaves of Syringa
ZHANG Hui-hui, ZHANG Xiu-li, LI Xin, WANG Liang-zai, HU Ju-wei, SUN Guang-yu
(College of Life Science, Northeast Forest University, Harbin 150040, Heilongjiang, China)
By taking Syringa oblata leaves (be rich in anthocyanin) and Syringa oblata var. alba leaves (with lower content of anthocyanin) as the tested materials, the effects of anthocyanin in new, semi-expansion and expanded leaves on photosynthetic apparatus have been investigated. The results show that the young leaves of S. oblata had a lower chlorophyll content, while had a higher anthocyanin content, S. oblata’s anthocyanin content was 17.3 times of S. oblata var. alba’s; S. oblata’s absorption flux per reaction center (ABS/RC) was lower than S. oblata var. alba’s by 20.17﹪; the proportion of absorbed light energy that was used to transfer electron and the proportion of ETo/RC were significantly lower than that of the latter; S. oblata’s photochemical efficiency and electron transport rate were obviously lower the latter, respectively. S. oblata’s Anthocyanin decreased PSⅡ’s absorption of light energy, and inhibited the conversion efficiency of PSⅡ’s light energy and the rate of primal process of photosynthesis, therefore, the excitation energy produced by S. oblata new leaves was lower that that of S. oblata var. alba’s. Syringa oblata var. alba had a higher chlorophyll content, a lower anthocyanin content, so had a stronger ability in light energy absorption than S. oblate; S. oblata var. alba’s new leaves had more reaction centers with activity and the reaction centers had high activity, so its utilization ability of light energy was higher than S.oblata; S. oblata var. alba’s non-photochemical quenching (NPQ), NPQ’s maximal quantum yields and the energy that was dissipated by unit reaction center were obviously higher than that of S. oblata’s. Hence, it can be concluded that the anthocyanin changed the absorption and utilization way of light energy as well as the excitation energy dissipation in Syringa oblata and Syringa oblata var. alba young leaves.
Syringa; anthocyanin; photosynthetic apparatus; photo-protection
2012-02-03
国家自然科学基金面上项目(30771746, 31070307);国家科技支撑项目(2011BAD08B02-3);黑龙江省自然科学基金重点项目(ZD201105);国家林业局科技推广项目(2010-29, 2011-32)
张会慧(1986—),男,内蒙古赤峰人,博士研究生,主要从事植物生理生态学研究;E-mail:xtwfwf@126.com
孙广玉(1963—),男,黑龙江巴彦人,教授,博士生导师,主要从事植物生理生态学研究;E-mail:sungy@vip.sina.com
S792; Q945.79
A
1673-923X (2012)07-0093-07
[本文编校:吴 毅]

