牛蒡子苷元对高糖刺激大鼠系膜细胞转化生长因子β1表达的影响*
赵 辉 袁 莉 贾 莉 王卫华 李 琳
(菏泽医学专科学校,山东 菏泽 274000)
糖尿病肾病(diabetic nephropathy, DN)是糖尿病(diabetes mellitus,DM)最严重的微血管并发症和致死原因。研究表明,转化生长因子β1(transforming growth factor-beta1, TGF-β1)在DN以及肾小球硬化症的发展过程中发挥重要作用[1]。在DN的发病过程中,TGF-β1可引起肾小球系膜基质增厚以及肾小球基底膜增厚,是导致DM患者肾小球硬化的主要因素[2]。近年来研究表明牛蒡子具有降血糖活性,牛蒡子主要成分为牛蒡子苷(ARC)、牛蒡子苷元(ARC-G)等,其中起降血糖作用的主要活性成分为ARC-G[3-4]。前期研究显示ARC-G可以减轻糖尿病大鼠肾损害,而对肾脏系膜细胞(GMCs)的影响却没有报道。本研究初步观察ARC-G对高糖刺激GMCs TGF-β1表达的影响,为更好的开发利用牛蒡子的药用价值提供理论与实验依据。
1 材料和方法
1.1材料 GMCs,武汉大学中国典型细胞培养物保藏中心;RPMI 1640,GIBCO公司; RNA提取、逆转录及PCR试剂盒,上海生物工程有限公司;引物,上海博尚。
1.2方法
1.2.1细胞培养 将GMCs接种于RPM I-1640培养液中(含10%胎牛血清、100 U/ml青霉素和100 U /ml链霉素),于37℃,5%CO2培养箱中培养。2~3 d传代后,取生长对数期细胞用于实验。
1.2.2GMCs中TGF-β1 mRNA表达检测 取对数生长期GMCs,消化后按1×106/ml/孔接种于6孔板,分为:正常对照组(10%FCS, 含葡萄糖5.4 mmol/L)、高糖组(10%FCS, 含葡萄糖30.0 mmol/L)、ARC-G组(3 μmol/L 、30 μmol/L),用药组均用高糖培养基培养。各组细胞干预48 h后,收集细胞,按照试剂盒提取细胞总RNA,并测定总RNA含量。按逆转录反应体系10 μl中加RNA 0.5 μg计算,取RNA 0.5 μg逆转录成cDNA。以cDNA为模板,GAPDH为内参,用实时定量PCR的方法进行PCR扩增。TGF-β1:上游引物5’-GCCTGTGTGGCTGTCTTTTGA-3’,下游引物5’-GAAGCGAAAGCCTTGTATTCC-3’,产物243 bp;GAPDH:上游引物5’-TCCTAGCACCATGAAGATG-3’,下游引物5’-AAACGCAGCTCAGTAACAC -3’,产物180 bp。采用实时荧光定量PCR定量分析方法处理各组目的基因mRNA的相对表达量。△△Ct= [Ct(实验组基因)- CtGAPDH(实验组基因)]- [Ct(对照组基因)- CtGAPDH(对照组基因)]。

2 结 果
结果见表1。与对照组比较,高糖刺激后,GMCs TGF-β1 mRNA的表达增加(P<0.05),经ARC-G作用后,TGF-β1 mRNA的表达下降(P<0.05),且呈现一定的剂量依赖性。
表1 各组GMCs TGF-β1 mRNA水平比较
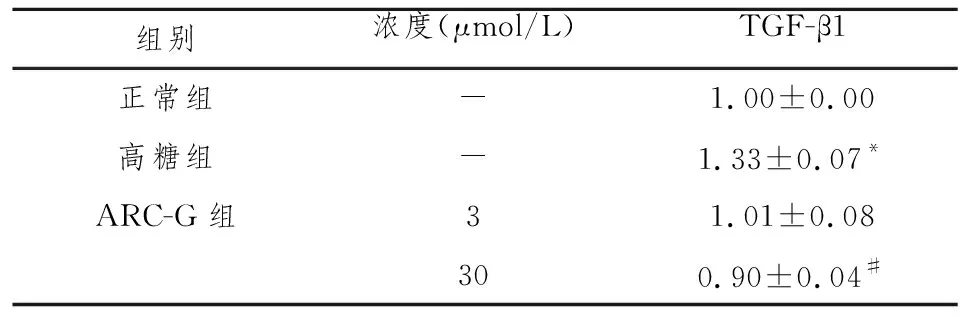
组别浓度(μmol/L)TGF-β1正常组-1.00±0.00高糖组-1.33±0.07*ARC-G组31.01±0.08300.90±0.04#
注:与对照组比较,*P<0.05;与HG组比较,#P< 0.05。
3 讨 论
DN是DM最严重的微血管并发症和致死原因。它主要以蛋白尿及进行性肾功能不全为临床特点。DN发病机制极为复杂,早期表现为肾小球内高血压、高灌注、高滤过,进而出现肾小球毛细血管基底膜增厚和系膜基质增多,最终发展为肾小球硬化[5]。GMCs是肾小球中功能最活跃的细胞,具有许多功能,在肾小球疾病的发生发展中处于重要地位。正常情况下,GMCs不增殖,但在多种因素作用下,GMCs可发生异常增殖,同时伴有系膜基质增多,最终发展为肾小球硬化[6-7]。
在DN发病过程中, TGF-β1等细胞因子起着非常重要的作用。TGF-β1属于TGF-β超家族,是由两条二硫键组成的二聚体,是一种由许多细胞分泌的具有许多生物学活性的多肽生长因子,广泛存在于各种正常或病变组织中,参与细胞的增殖、分化和凋亡等过程[8]。TGF-β1在肾脏表达广泛,是最主要的促纤维化生长因子。TGF-β1以旁分泌和自分泌的方式刺激成纤维细胞、肾小管上皮细胞、GMCs等肾脏固有细胞活化增殖,分泌大量Ⅰ、Ⅲ、Ⅳ型胶原、纤维连接蛋白(FN)、层粘蛋白(LN)等细胞外基质(ECM)成分,以及基质蛋白降解酶的抑制物。TGF-β1既可以促进ECM成分沉积,又可以抑制其降解。因此,TGF-β1已被公认为导致ECM积聚的重要生长因子,与肾小球硬化密切相关[9]。
牛蒡子是从菊科(Compositae)两年生草本植物牛蒡属牛蒡(Arctium lappa L.)的干燥成熟果实牛蒡子中提取分离而来的木脂素化合物,牛蒡叶中也有少量存在。牛蒡子苷元(arctigenin,ARC-G)为牛蒡子分解后的产物,此外尚有牛蒡子酚A、B、C、D、E、F、H、罗汉松酯素以及数十种2,3-二苄基丁内酯木脂素等[10]。现代药理学证明牛蒡子具有抗病毒、抗肿瘤、抗炎及免疫调节、降血糖等多重功效。本研究显示,高糖刺激后,GMCs TGF-β1 mRNA的表达增加;经ARC-G干预后,TGF-β1 mRNA的表达下降。其中的机制可能为ARG通过抑制TGF-β1的表达,发挥其肾脏保护作用。
[1] Di Paolo S, Gesualdo L, Ranieri E, et al. High glucose concentration induces the overexpression of transforming growth factor-beta through the activation of a platelet-derived growth factor loop in human mesangial cells[J]. Am J Pathol, 1996, 149(6): 2095-2106.
[2] Xia L, Wang H, Munk S, et al. High glucose activates PKC-zeta and NADPH oxidase through autocrine TGF-beta1 signaling in mesangial cells[J]. Am J Physiol Renal Physiol, 2008, 295 (6): F1705-1714.
[3] Matsumoto T, Hosono- Nishiyama K, Yamada H. Antiproliferativeand apoptotic effects of butyrolactone lignans from Arctium lappa on leukemic cells[J]. Planta Med, 2006, 72: 276-278.
[4] Takasaki M, Konoshima T, Komatsu K, et al. Antitumor-promoting activity of lignans from the aerial part of Saus sureamedusa[J]. Cancer Lett, 2000, 158(1):29.
[5] 尤莉, 陆福明, 杨海春, 等. 血管紧张素Ⅱ对大鼠系膜细胞葡萄糖转运蛋白 1 表达的影响[J]. 复旦学报:医学版, 2002, 29(6): 433-436.
[6] Miyata T. Novel mechanisms and therapeutic options in diabetic nephropathy[J]. Pol Arch Med Wewn, 2009, 119(4): 261-264.
[7] Kim SK, Jung KH, Lee BC. Protective effect of Tanshinone IIA on the early stage of experimental diabetic nephropathy[J]. Biol Pharm Bull, 2009, 32(2): 220-224.
[8] 谭燕, 杨永年. TGF-β在糖尿病肾病发病机制中的作用及意义[J]. 中国糖尿病杂志, 2000, 8(3): 178-180.
[9] 成秀梅, 常风云, 孙灵娇, 等. 糖尿病肾病模型大鼠肾脏细胞TGF-β1、 PDGF-B的变化[J]. 重庆医科大学学报, 2009, 34(8): 1135-1136.
[10] 徐朝晖,李婷,邓毅, 等.牛蒡子提取物的降血糖作用[J]. 中草药,2005,36(7):1043-1045.

