制氯技术对比与氧化制氯技术展望
王大壮,刘国桢
(沈阳化工集团有限公司,辽宁 沈阳110002)
随着氯碱工业的发展,氯的应用领域逐步扩大,特别是大量应用于合成材料和农业制剂的生产,生产过程也时常副产大量的含氯副产品,因此,现代化工对氯的循环利用提出了更高的要求。 随着对产氯能耗和生产过程环境影响要求的提高, 采用就近、廉价且环境友好方法生产氯成为必然,最好同时可以消耗副产的含氯化合物, 氧化制氯技术恰好是解决这一问题的较好办法,因此,得到广泛的关注和逐步深入的研究。
典型的工业生产情况是在有机氯化以及MDI、TDI 生产过程中需要消耗大量的氯气原料, 同时也副产大量氯化氢气体。 如果将氯化氢直接转化成氯加以利用, 实现氯元素在工业体系中的循环利用和反应过程的零排放,不仅能解决氯化氢污染问题,还会在一定程度上满足工业上对氯不断增长的需求,带来巨大的经济效益, 符合当代资源循环型社会发展的要求。
1 制氯方法的比较
制氯有多种方法,早期采用氧化制氯,后期主要依靠食盐水电解制氯。 将氯使用过程中副产的氯化氢制成氯循环使用,有多种方法,主要有氯化氢电解法、直接氧化法和催化氧化法3 种工艺。
氯化氢电解法分为隔膜电解和氧阴极电解2种。 隔膜电解法要求氯化氢气体通过吸收使氯化氢变为盐酸, 盐酸经过精制除去杂质后在隔膜电解槽中电解,生产氢气和氯气。 反应方程如下:
2HCl=H2↑+Cl2↑
隔膜电解系统图见图1。
该方法技术成熟,吨氯耗电1 700 kW·h/t,电流密度为4.5 kA/m2,污染小,已经实现了商业化生产;缺点是必须以盐酸形态进行电解, 盐酸需要精制除去杂质,氯化氢的吸收和精制环节较繁杂,隔膜电解槽对材质要求高,投资大、能耗高,经济上不具优势。

图1 隔膜法盐酸电解制氯流程图
离子膜氧阴极电解方法(ODC)要求氯化氢气体通过吸收变为盐酸,盐酸经过深度精制除去杂质后,在离子膜电解槽中电解,阴极通入氧气,生产氯气和水,总反应方程如下:

采用离子膜电解槽和氧阴极系统, 电解系统简图见图2。
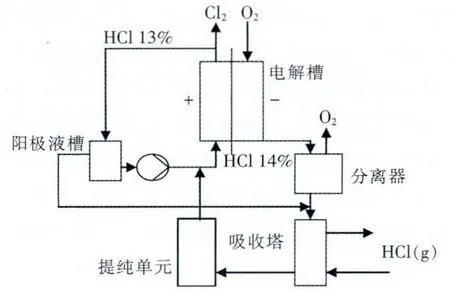
图2 ODC法盐酸电解制氯流程图
该方法技术接近成熟,吨氯耗电为1 100 kW·h/t,电流密度为4.5 kA/m2,污染小,已经实现了工业化生产;缺点是必须以深度精制盐酸再进行电解,氯化氢的吸收和精制环节较繁杂, 离子膜电解槽对材质要求高,氧阴极结构复杂,要求有纯氧供应,离子膜对杂质敏感,投资大、能耗高,经济成本上不具优势。几种制氯方法的能耗对比见图3。
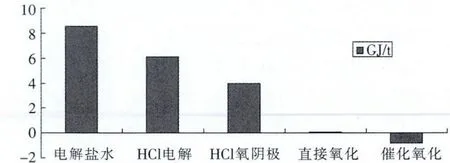
图3 各种制氯方法能耗对比图
从图3 可以清晰地得出结论, 氧化制氯法在能耗方面最具竞争优势,因此,越来越受到现代工业重视,随着不断加大研究投入和进行不同方法的尝试,使氧化制氯在工业化方面取得了显著进展。
2 氧化制氯方法发展历史
氧化制氯是一种氧化含氯化合物制取氯气的方法。正是应用这种方法人类制取了氯,该方法也是早期氯气生产的唯一方法, 其在实验室制氯等方面也一直发挥着重要作用。
氯气的生产方法经历了漫长的发展过程。1774年,瑞典化学家舍勒用软锰矿(含有二氧化锰)和浓盐酸作用,首先制得了氯气:
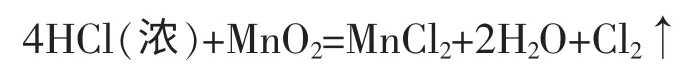
然而,由于当时还不能够大量制得盐酸,故这种方法只限于实验室内制取氯气。后来,法国化学家贝托雷把氯化钠、 软锰矿和浓硫酸的混合物装入铅蒸馏器中,经过加热制得了氯气。
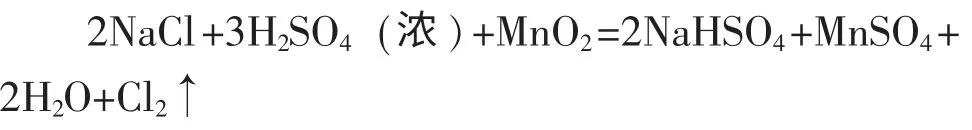
因为此法原料易得,所以自1774 年舍勒制得氯气到1836 年止,一直沿用贝托雷发明的方法来生产氯气。1836 年,古萨格发明了一种焦化塔,用来吸收路布蓝法生产纯碱(Na2CO3)过程中排出的氯化氢气体(以前这种含氯化氢的气体被认为是一种废气,从古萨格开始,才得到了充分利用)得到盐酸,从此盐酸才成为一种比较便宜的酸,可以广为利用。舍勒发明的生产氯气的方法,经过改进,到此时才成为大规模生产氯气的方法。 1868 年,狄肯(Deacon)和洪特发现用氯化铜作催化剂,在加热时,用空气中的氧气来氧化氯化氢气体制取氯气的方法, 这种方法被称为狄肯法。
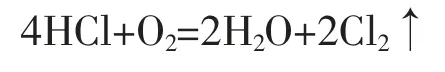
上述生产氯气的方法, 虽然在历史上都起过一定的作用,但是与电解食盐水生产氯气法相比,无论从经济效益还是从生产规模上都大为逊色。 当电解法在付诸生产实际时, 上述的方法在工业上就逐渐被电解法取代。
3 实验的氧化制氯方法
实验室通常用氧化浓盐酸的方法来制取氯气,常见的氧化剂有MnO2、K2Cr2O7、KMnO4、Ca(ClO)2。
MnO2氧化法的反应是:
4HCl+MnO2=MnCl2+Cl2↑+2H2O
最好用稀盐酸,浓盐酸会造成浪费,且反应速率过快。
K2Cr2O7氧化法的反应是:
14HCl+K2Cr2O7=2KCl+2CrCl3+7H2O+3Cl2↑
如此反应用的盐酸浓度比较低,微热即可反应。
KMnO4氧化法的反应是:
16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑
如此反应用的盐酸浓度比较低,微热即可反应。
Ca(ClO)2[漂白粉]氧化法的反应是:

此反应需要的盐酸浓度很低,1 mol/L 便可以剧烈反应。
如不用盐酸,也可用NaCl(固体)与浓硫酸来代替:

实验室的制氯方法都围绕着一个核心: 氧化制氯,氯离子+氧化剂+酸性环境,当氧化剂的氧化性不强时,需不同程度地加热。氧化制氯在实验室和教学中具有重要作用。
4 催化氧化法是氧化制氯的发展方向
直接氧化制氯的工业化方法,是利用NO2、SO3、NOHSO4和混合酸HNO3/H2SO4等无机氧化剂直接氧化氯化氢制备Cl2的一种方法,反应在液相进行,典型的有Weldson 法、KCl-Chlor 过程等, 这些方法比较突出的缺点是设备复杂、 反应过程中产生腐蚀性物质、氯化氢转化不完全、产物分离困难、废液难以处理,同时,需要加入大量氧化剂,能耗也较大,因而,不能得到广泛应用。
催化氧化法是在催化剂存在下以空气或氧气作为氧化剂氧化氯化氢生成氯的方法, 其化学方程式可表述为:
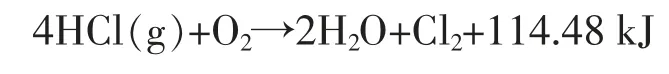
该反应过程是一个放热的可逆过程, 很多人对其反应平衡常数Ke进行了研究计算,Amold 等给出了较好的平衡表达式:

结合以下平衡常数分压表达式:
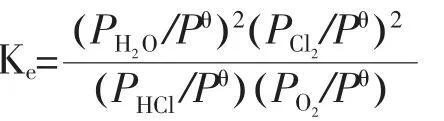
可以得到不同温度和HCl/O2摩尔进料比下的氯化氢平衡转化率,见图4。

图4 温度和HCl/O2摩尔比对氯化氢转化率的影响
对于可逆放热反应, 升高温度不利于反应平衡向右移动,因此,图4 中氯化氢平衡转化率随着温度的升高而下降,随着进料摩尔比的降低而升高。
催化氧化法具有能耗低、操作简单等优点,是目前最容易实现工业化的方法, 具有代表性的催化氧化法主要有Deacon 过程、MT–Chlor 过程和Shell-Chlor 过程等[2]。
Deacon 过程于1874 年Henry Deacon 首先提出。传统Deacon 过程在一段反应器中进行,以CuCl2为催化剂,反应温度为430~475 ℃,在实际应用中,该方法受平衡的限制, 氯化氢转化率不高, 达不到80%,产品中有氯化氢和水同时存在,形成的盐酸可严重腐蚀设备,水又可使催化剂黏度提高,降低了催化剂的流化特性, 反应的温度环境可使催化剂活性组分CuCl2易挥发流失,使早期的Deacon 法竞争不过电解法。
MT–Chlor 过程由日本三井东亚公司(Mitsui Toatau Chemicals)提出,以负载在SiO2或硅胶上的Cr2O3作为催化剂,采用一段反应形式,反应器可采用固定床或流化床。 载体要求孔径为2~30 nm,含Cr2O320%~90%,含Na、Fe 不高于0.5%,催化剂通过载体浸渍在含Cr2O3、铬盐的溶液中,经过450~700 ℃热处理制得,反应温度为350~430 ℃。该过程的不足是催化剂造价较高,对Fe、Ni、Ti 污染敏感,反应器必须由含铁低于1%的材料制作,设备造价高。
Shell-Chlor 过程由Quant 等提出, 所用催化剂为在SiO2载体上等分子浸渍的CuCl2和KCl, 催化剂中还含有稀土金属盐, 较好的催化剂成分中含Cu5%、Di5%、SiO286.9%、K3.1%, 其中,Di 是从独居石砂(Monazite)中分离Ce 后得到的一种相对便宜的稀土混合物。 Shell-Chlor 过程反应过程采用流化床反应器,温度为350~365 ℃,压力为0.1~0.2 MPa,催化剂活性较好,能使反应进行到接近平衡。
5 催化氧化制氯方法的改进
现代氧化制氯的技术的进步集中在催化氧化的催化剂改进和反应过程改进2 个方面, 目标是解决平衡制约、腐蚀问题和催化剂流失问题。
催化剂在高温下挥发流失是传统催化氧化法的重要缺陷, 从20 世纪早期人们就努力改进催化剂,提高其在高温下的稳定性,研究表明,在不同的铜盐中加入少量的低挥发性金属元素(如V、Be、Mg、Bi、Sb 等)的氯化物或氧化物作为助催化剂,可提高催化剂的高温稳定性[2]。 Benson 过程的催化剂是在CuCl2中加入NaCl 或KCl 盐形成复盐,其挥发稳定性得到明显改善,Cr2O3和V2O5也被证明是有效的催化剂。 Abegawa 等将Ru 的氧氯化物烧结在Cr 氧化物载体上开发出新的Ru 系催化剂, 试验证明其具有较高活性并能降低反应温度。目前,研究重点是提高催化剂的热稳定性、极高活性和降低反应温度,以达到减少热挥发和延长催化剂寿命的目的。
改进催化剂可以达到降低反应温度减少流失,但并没有解决整体反应平衡限制问题, 依然会有氯化氢没有反应并与生成的水结合腐蚀设备管道。 为了打破平衡限制, 研究者在对传统催化氧化过程反应机理深入研究的基础上进行了重大改革,发展了二步反应法,将整个过程分为独立的氯化和氧化2 个过程,简化描述如下:
氯化反应:
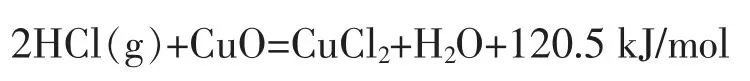
氧化反应:
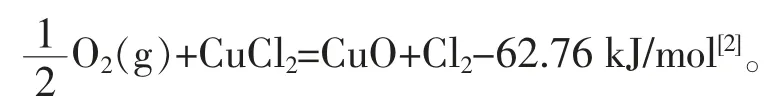
氯化反应为放热反应,适于在低温下反应;氧化反应为吸热反应,适于在高温下反应,以有利于平衡移动。二步法实际上打破了传统狄肯法的平衡障碍,把一步反应分成二步进行, 利用Cu 作为Cl 的转移载体使二步反应可以在不同条件下进行,同时,可以在氯化反应中不断提供CuO 和撤出CuCl2, 以打破平衡障碍,使氯化氢的反应转化率达到100%,在氧化反应中,又可不断提供CuCl2和不断撤出CuO,使氧得到充分利用, 而热量可以通过热交换的方式在放热反应向吸热反应转移, 实现不依赖外部热量的反应自平衡。
由于二步反应的特点使得反应机理得以简化,反应产物不含氯化氢, 只有氯和水蒸气以及原料中的惰性气体,因此,使后续分离过程变得简单高效,对设备抗腐蚀能力的要求也大为减低, 对降低生产成本和长周期稳定运行极为有利。
在二步法中, 催化剂的成分变化使其类同于石油裂解过程的催化剂反应再生,因此,反应器形式也与反应再生系统类似, 小规模装置可采用2 台固定床反应器, 一台用于氯化反应; 另一台用于再生反应,待反应一段时间后,切换反应器使之交互反应,得到产品氯气。 催化氧化二步法固化床反应流程图见图5(1、2)。
这种反应形式的反应器结构简单,易于实现,催化剂磨损少,属于催化剂固定、气体流向变化形式,但切换操作繁琐,不适合大规模生产。二步法实现的另一种方式是采用双流化床反应器,气体流向不变,催化剂进行交换实现连续二步法反应: 双流化床反应流程图见图6。
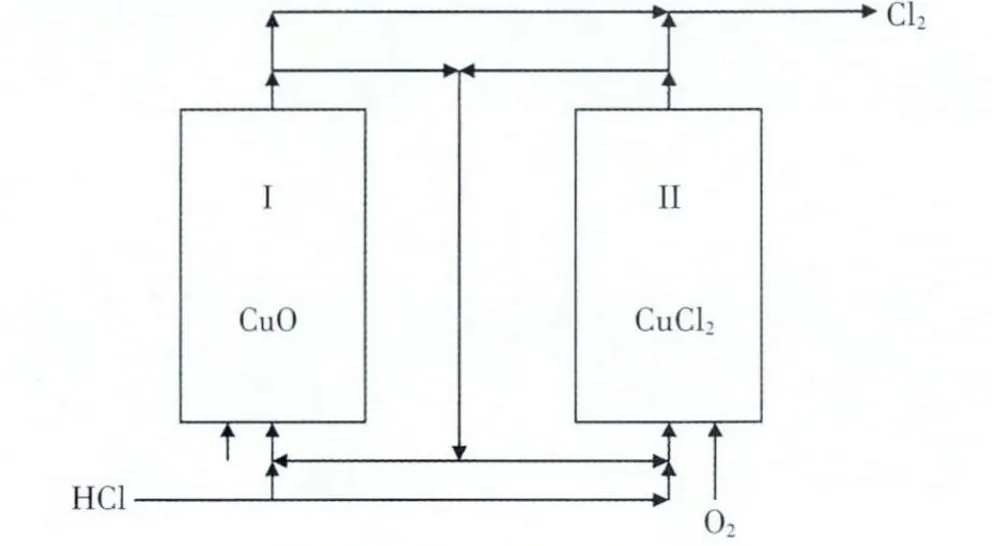
图5 催化氧化二步法固定床反应流程(1)
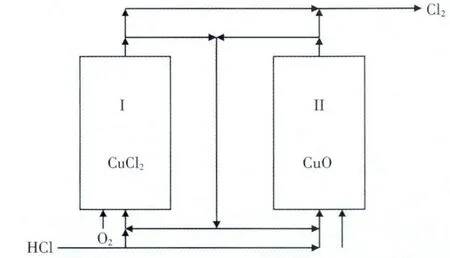
图5 催化氧化二步法固定床反应流程(2)
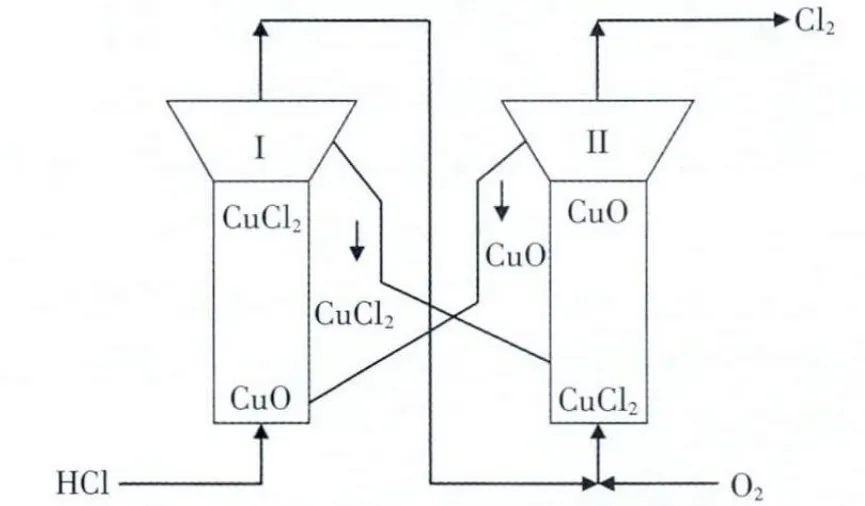
图6 催化氧化两步法双流化床反应流程
该流程的特点是2 个反应器间有交互的催化剂交换管,使催化剂在2 反应器间循环转化,很好地实现了气体流向固定的分区反应, 可以分别控制每一步的反应温度和催化剂新鲜度, 反应转化率得以控制。但在放热反应与吸热反应之间的热交换困难,热损失大。 为进一步减少能耗,Benson 过程将氯化反应改为氧氯化反应,控制氯化度达到80%,使氧化反应有氯化反应参与,这样,在氧化反应中不需补充热量,2 个反应器可完全靠自身放热维持运行。
改进的双流化床反应流程示意图见图7。
Benson 又开发出在二步反应前增加一段一步反应流化床反应器,即引入第三反应器,实现先混合反应,最大限度利用热能,再分步反应,提高转化率[2]。 二步法三流化床反应流程示意图见图8。

图7 改进Benson催化氧化二步法双流化床反应流程

图8 Benson催化氧化二步法三流化床反应流程
引入第三反应器后,设计混合反应器III 的催化剂不参与交换,保证主反应的相对稳定,后二个反应器保证反应转化率, 并采用III 反应器向II 反应器交换热的方法达到热平衡,节省能量。
Benson 工艺解决了反应平衡限制问题和腐蚀问题,可以方便地控制反应是富余氧或氯化氢,可根据要求进行流程安排。
清华大学在Benson 工艺的基础上,开发了单塔二段流化床催化氧化工艺, 特点是催化剂的转移靠气流推动和重力完成,反应器结构新颖操作稳定,其结构见图9[2]。
在该反应器中, 在流化床提升管中设置气固分布板形成二段流化床反应器, 流化床下段为混合反应区,上段为氧化反应区,以保证出口氯气中不含氯化氢气体,产品中除含有氯气外,还含有氧气和水蒸汽以及少量的惰性气体。
分步催化氧化的难点在于后续产品的分离,去除水分可以采用冷却、 过滤与硫酸干燥结合工艺;去除氧气和惰性气体可以采用氯气液化-蒸发工艺精制氯气;而如果含有氯化氢气体,则可以使用水洗吸收的办法,但会产生大量的稀盐酸,提高了处理难度。 因此,反应过程应尽可能控制和确保不产生过量氯化氢,反应器应确保有充足的CuO 催化剂存在。
6 氧化制氯的发展方向
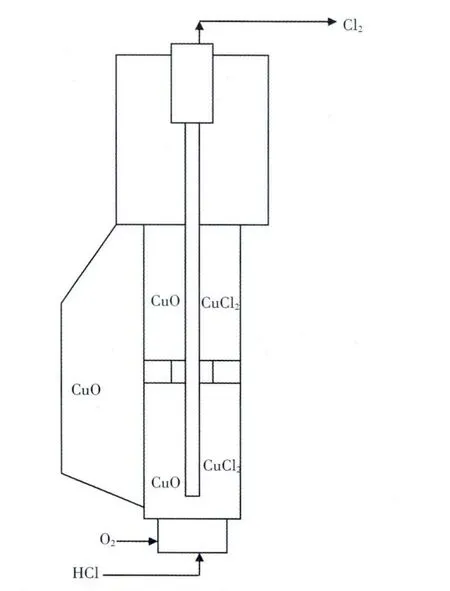
图9 清华大学催化氧化二步法单流化床反应器结构
从过程机理和能耗对比可以看出, 采用氯化氢为原料催化氧化法制取氯气是最有前景的工艺过程,必将在不远的将来在化学工业中发挥重要作用,代替氯化氢隔膜电解法和氧阴极电解法。 但要从目前的工业试验阶段实现商业化运行, 还需解决好如下问题。
(1)优化和改进催化剂。主要提高催化剂的机械强度和高温化学稳定性,提高催化剂寿命,通过不断改进配方,提高催化剂的活性和转化率,同时,降低催化剂的成本。
(2)改进和完善催化过程。实现自动化和连续稳定的运行,反应器设计需合理、选材适宜、控制可靠等共同配合实现。
可以预见不远的将来, 国内外对催化氧化法制取氯气研究开发投入会得到加强, 催化氧化制氯从理论研究到工艺过程开发都会更加深入和成果丰富,使其成为重要的制氯方法,与电解制氯相互补充在化工领域占有重要地位, 国内氯碱企业也会更加关注该技术的不断完善和进步, 有关企业可以联合研究机构和大学共同开发, 实现氯的循环经济模式的优化和完善。
[1]陈 献,乔 旭,王 永,汤吉海,崔咪芬.氯化氢氧化反应-脱水耦合制氯工艺。 过程工程学报,2007,10(7-5):939-943.
[2]吴玉龙,魏 飞,韩明汉,金 庸.回收利用副产氯化氢制氯气的研究进展.过程工程学报,2004,6(4-3):269-274.

