RICTOR对类风湿关节炎成纤维样滑膜细胞活力的影响*
郭 欣, 胡爱玲, 方霖楷, 刘 岩, 潘云峰△
(中山大学附属第三医院1风湿免疫科,2护理部,广东 广州510630)
类风湿关节炎 (rheumatoid arthritis,RA)是一种病因尚未明了的慢性全身性炎症性疾病,世界上约0.5%~1%的人群患有RA。滑膜炎症细胞浸润以及衬里层增生是其典型病理表现。衬里层增生的滑膜细胞可分为巨噬样滑膜细胞和成纤维样滑膜细胞(fibroblast-like synoviocyte,FLS)。其中 RA-FLS 具有增殖程度增高、侵袭等类肿瘤特性,并发现多个与肿瘤发生密切相关的信号转导系统,如丝裂原激活的蛋白激酶(mitogen-activated protein kinases,MAPK)通路、Wnt/β-catenin通路、核因子 κB(nuclear factorkappa B,NF-κB)通路与磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB/Akt)通路等,都与 RA的发病、关节破坏和疾病的进程有着密切关系[1-3]。但目前有关其生物学特性及变化机制尚未清楚。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶,可整合营养、能量及生长因子等多种细胞外信号,参与细胞存活、增殖、分化等。mTOR共有mTORC1和mTORC2两种复合物。mTORC2可磷酸化Akt的Ser473位点,是Akt激活的必要条件,并且与多种肿瘤细胞的幸存、增殖、迁移有关。已有学者发现Akt通路在RA-FLS可被多种细胞因子激活,并参与减弱滑膜细胞对Fas引起的凋亡的敏感性[4]。而作为Akt激活的必要条件,目前尚未见mTORC2与RA的相关报道。RICTOR(rapamycin-insensitive companion of mTOR)为mTORC2特异性的组成蛋白,并是其发挥生物学作用的必不可少的组成部分[5]。本研究通过siRNA介导的RNA干扰技术沉默RAFLS中RICTOR的表达,观察mTORC2对细胞存活的影响。
材料和方法
1 标本采集
类风湿关节炎患者滑膜组织来自2010年3月至2012年6月中山大学附属第三医院行滑膜清理术或关节置换术,共7例,其中5个取自膝关节、2个取自髋关节。年龄25~62岁,平均40.1岁,其中6名女性。所有RA患者诊断均符合1987年美国风湿病学会(American Rheumatism Association,ARA)类风湿关节炎分类标准。
2 主要试剂
胎牛血清(fetal bovine serum,FBS)及高糖DMEM无血清培养基购自Thermo scientific;RNAiso Plus(总RNA提取试剂)、SYBR® Premix Ex TaqTMII(Perfect Real Time)及 PrimeScript® RT reagent Kit(Perfect Real Time)均购自TaKaRa宝生物工程(大连)公司;总蛋白提取试剂盒购自北京天根生化科技有限公司;靶I抗:兔抗人抗RICTOR多克隆抗体购自Cell Signaling;兔抗人抗磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)多克隆抗体购自Bioworld;辣根过氧化物酶(horseradish peroxidase,HRP)标记 II抗购自 Immunology Consultants Laboratory;噻唑蓝(四甲基偶氮唑盐)购自MP Biomedicals;无血清培养基 Opti-MEM I、脂质体 Lipofectamine® RNAiMAX均为 Invitrogen产品。所需siRNA由上海吉玛制药技术有限公司设计并化学合成,RICTOR的siRNA序列:正义链5'-GCGGUUAGCUUUAUUAAAUTT-3',反义链 5'-AUUUAAUAAAGCUAACCGCTT-3';非特异siRNA(阴性对照)序列:正义链5'-UUCUCCGAACGUGUCACGUTT-3',反义链5'-ACGUGACACGUUCGGAGAATT-3'。
3 方法
3.1 细胞培养与鉴定 滑膜组织经无菌条件下处理后,向滑膜组织滴加PBS缓冲液,将其锐性剪碎至约1 mm×1 mm×1 mm大小,将组织块移至培养瓶中,加入适量10%FBS培养液,置于5%CO2、37℃培养箱中培养。根据细胞的生长情况及培养液的变化,每2~3 d更换培养液1次。当细胞生长至覆盖底面>80%时,可进行消化传代培养。经消化传代后获得较纯成纤维样滑膜细胞。鉴定包括光学相差显微镜下观察细胞生长形态和流式细胞术检测CD55阳性细胞率。本实验使用第3~5代滑膜细胞。
3.2 siRNA转染 转染前24 h用不含抗生素的10%FBS培养基消化接种细胞培养板,以每孔2×105个细胞接种于6孔板,以每孔2×104个细胞接种于96孔培养板,使细胞融合度达50% ~80%时开始转染。先用适量无血清培养基Opti-MEM I分别稀释脂质体及siRNA,并轻轻混合,室温孵育10~20 min。将siRNA-脂质体复合物加入细胞培养基中,轻轻前后摇动培养板混合,置于5%CO2、37℃培养箱中孵育5 h,予10%FBS培养基换液,后继续培养箱中孵育 19、43 和 67 h。
3.3 荧光定量PCR法检测RICTOR mRNA的表达转染24 h后6孔板细胞每孔加入RNAiso Plus 1 mL,抽提细胞总RNA并溶于20 μL RNase-free H2O,取2 μL总RNA样品于紫外分光光度计检测A260/A280。按PrimeScript® RT reagent Kit试剂盒说明书进行反转录,反转录反应条件如下:37℃ 15 min,85℃ 5 s。反转录反应产物cDNA依照SYBR® Premix Ex TaqTM试剂盒说明书,行荧光定量 PCR反应。
RICTOR上游引物序列5'-GCTAGGTGCATTGACATACAACA-3',下 游 引 物 序 列 5'-AGTGCTAGTTCA-CAGATAATGGC-3';GAPDH上游引物序列5'-AAGGTGAAGGTCGGAGTCAAC-3',下 游 引 物 序 列 5'-GGGGTCATTGATGGCAACAATA-3'。反应体系总体积为 20 μL,含 cDNA 模板 1.8 μL,SYBR® Premix Ex TaqTM10 μL,上下游引物、ROX Reference Dye 各0.4 μL,ddH2O 7 μL。使用 ABI PRISM® 7000,设置反应程序:95℃ 30 s后,以95℃ 5 s,60℃ 31 s循环40次,95℃ 5 s,60℃ 31 s;反应结束后分析各样本Ct值,并计算 2-ΔΔCt值。
3.4 Western blotting分析 RICTOR的蛋白表达转染48 h、72 h后收集RA-FLS,用总蛋白提取试剂盒提取胞浆总蛋白,BCA法检测蛋白浓度后,用Western blotting检测其胞浆中RICTOR蛋白表达的变化,即取30 μL总蛋白,经8%SDS-PAGE电泳分离,电转印到PVDF膜,封闭后加入Ⅰ抗(抗RICTOR 1∶500,抗 GAPDH 1∶5 000,取抗体稀释液稀释),4 ℃摇床孵育过夜,加HRP标记Ⅱ抗(1∶5 000,取抗体稀释液稀释)孵育1 h,最后用增强化学发光(enhanced chemiluminescence,ECL)化学发光液,于暗室显影后冲洗胶片。用Quantity One软件进行分析,读取吸光度(absorbance,A)及A×mm2值,计算各样本中RICTOR与内参照GAPDH的吸光度值比较,以观察特异性RICTOR siRNA转染组与阴性对照组RICTOR蛋白表达量的变化。
3.5 四甲基偶氮唑盐(MTT)比色法 实验分4组:①无细胞组:仅加培养液;②空白对照组:加培养液与RA-FLS;③阴性对照组:RA-FLS转染非特异性siRNA;④特异性RICTOR siRNA组:RA-FLS转染特异性RICTOR siRNA。处理24 h、48 h、72 h后向96孔板每孔细胞加入MTT溶液(5 g/L)20 μL,37℃继续孵育4 h,终止培养,小心吸弃孔内培养液,每孔加入150 μL二甲基亚砜(DMSO)液振荡使结晶充分溶解。选择490 nm波长,用酶联免疫检测仪测定各孔A值,记录结果,计算各样本与无细胞组A值的差值(ΔA),比较转染非特异性siRNA与特异性RICTOR siRNA后RA-FLS细胞活力(阴性对照或特异性RICTOR siRNA组ΔA/空白对照组ΔA)。
4 统计学处理
用SPSS 17.0软件进行数据处理,计量资料用均数±标准差(mean±SD)表示,两组间差异比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 FLS培养的鉴定
光学显微镜下观察可见细胞呈细长纺锤形,胞核边界清楚,卵圆形,居中,核仁明显,与成纤维细胞形似,鉴定细胞形态与FLS相符,见图1。流式细胞术检测培养的第3代细胞显示CD55表达阳性率达96.8%,见图2,提示所培养的细胞大部分为FLS。

Figure 1.Morphology of RA-FLS observed under optical microscope(×100).Cells were slender and fibroblastlike,while nuclei were clear,ovoid and center.图1 镜下观察第3代RA-FLS形态
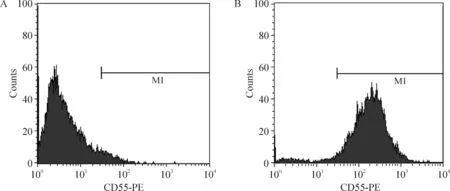
Figure 2.CD55 expression of passage 3 RA-FLS detected by flow cytometry.A:blank control;B:CD55 positive.CD55 expression in this case was 96.8%.图2 流式细胞术检测第3代RA-FLS CD55阳性细胞率结果
2 转染siRNAs后对RA-FLS RICTOR mRNA表达的影响
荧光定量PCR技术检测细胞内RICTOR mRNA表达,Ct值经过GAPDH标准化后,特异性RICTOR siRNA转染24 h后,对mRNA干扰效率为(78.36±3.71)%,与阴性对照组比差异有统计学意义(P<0.01)。
3 转染siRNAs后对RA-FLS RICTOR蛋白表达的影响
Western blotting检测结果显示,转染 RICTOR siRNA 48 h、72 h后,RICTOR蛋白表达较阴性对照组明显下降,沉默效率分别为(92.48±6.14)%、(98.57 ±1.40)%(n=7,P <0.01),见图3。
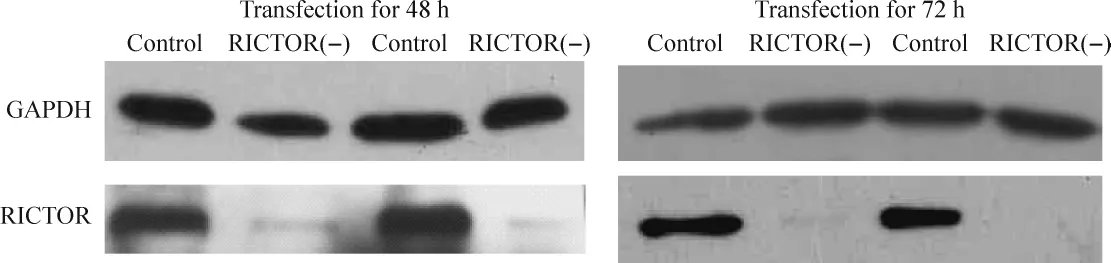
Figure 3.Expression of RICTOR protein in cytoplasm examined by Western blotting after transfection of RICTOR siRNA[RICTOR(-)]for 48 h and 72 h.Compared with control group,the expression of RICTOR was significantly decreased in RICTOR siRNA group.图3 转染siRNA 48 h及72 h后RICTOR的蛋白表达
4 MTT法检测转染siRNA对RA-FLS活力的影响
转染对RA-FLS活力呈时间依赖性,转染24和48 h后,RICTOR siRNA转染组与阴性对照组差异无统计学意义,但转染72 h后,RICTOR siRNA组的细胞活力为(90.14±1.90)%,显著低于阴性对照组(P<0.01),见表1。
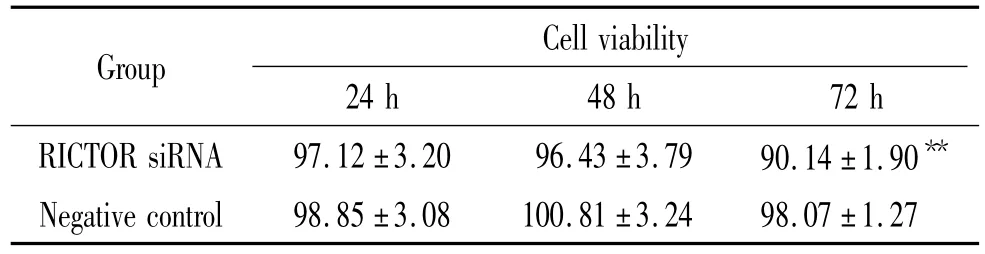
表1 siRNA转染不同时间后RA-FLS细胞存活力Table 1.The viability of RA-FLS after RICTOR siRNA transfection(%.Mean±SD.n=7)
讨 论
mTOR存在于两种多蛋白复合体—— mTORC1和mTORC2。mTORC1(哺乳动物雷帕霉素靶蛋白复合物1)由mTOR、RAPTOR、mLST8和PRAS40组成,是PI3K/Akt/mTOR通路的重要组成,参与营养平衡、胰岛素作用和细胞生存的调控。而mTORC2,即雷帕霉素不敏感复合体,由 RICTOR、mTOR、mSIN1和mLST8组成。其中,RICTOR是mTORC2的特异性成分,构成mTORC2的支架蛋白。尚有学者发现,用多等位基因打靶敲除的方法降低RICTOR在成纤维细胞中的表达后,可以导致成纤维细胞的增殖率下降,并降低了蛋白激酶Akt的活性和细胞的代谢能力[5],提示 RICTOR还是 mTORC2发挥生物学作用必不可少的组成部分。目前认为,mTORC2主要作用机制是参与了Akt/PKB第473位丝氨酸磷酸化,而通过降低RICTOR蛋白表达可影响mTORC2功能的发挥和Akt的磷酸化[6]。
Akt又称PKB,即蛋白激酶B,是一种丝氨酸/苏氨酸蛋白激酶,通过磷酸化一系列蛋白成分,抑制细胞凋亡,在细胞存活和凋亡中起重要作用。其在人恶性肿瘤中通常高度激活,Akt异常激活意味着肿瘤细胞对凋亡诱导的耐受、细胞增殖生长代谢的异常增加,是目前癌症研究的重要靶标。已有研究发现,磷酸化的Akt及Akt酶活性在RA-FLS中表达升高,并可抑制 TNF-α引起的凋亡反应[7];且Akt也参与了 TGF-β、fractalkine、lymphotoxin α 等细胞因子对RA-FLS促炎、增殖与抗凋亡的作用[8-10]。此外,Akt还被发现与RA软骨破坏有关[11],并在巨噬细胞介导的固有免疫中有着关键地位[12]。以上均提示Akt的磷酸化在RA发病机制中起着重要作用,而安全有效的Akt通路抑制剂将可能成为RA治疗研究的新方向。
如今对mTORC2的研究是肿瘤领域的焦点,但其信号通路的功能仍尚待研究。已有学者发现,mTORC2参与了MMP-9活化并可通过PKC途径影响细胞骨架参与神经胶质瘤细胞侵袭,并激活Akt通路促进细胞增殖,抑制凋亡[13]。另外,也有发现阻断mTORC2通路,可促进多发性骨髓瘤、结肠癌肿瘤细胞凋亡、抑制增殖及转移种植[14];而该通路也被证实参与了乳腺癌细胞骨架变化,影响其趋化和转移能力[15]。RA-FLS是滑膜中特殊的细胞群,RA发病后,其发生了肿瘤样改变,表现为具有逃脱接触抑制的能力,自主增殖程度增高,有侵袭的内在特性。mTORC2是否也参与了RA-FLS的生长异常,目前尚未有相关报道。
本课题利用siRNA介导的RNA干扰技术沉默RA-FLS中mTORC2的特异组成蛋白RICTOR的表达后,可显著降低RA-FLS存活率,推测mTORC2可能参与了 RA-FLS的异常增殖或抗凋亡机制,为mTORC2信号通路在RA-FLS中作用机制的进一步研究提供线索。此外,实验结果显示,转染24 h后,siRNA已开始影响mRNA翻译,并在48 h后明显抑制RICTOR蛋白表达。但RA-FLS细胞存活率在72 h后才出现显著下降,考虑原因是:RICTOR的敲除并非直接抑制RA-FLS生长,它通过减少mTORC2复合物形成,影响下游信号转导通路,从而引起细胞凋亡或增殖减少,这可能与其抑制Akt磷酸化有关,但其下游通路仍有待进一步实验探索及证实。本实验通过沉默mTORC2可抑制RA-FLS生长的发现,为RA发病机制的研究和治疗提供了新思路。
[1]Choy E.Understanding the dynamics:pathways involved in the pathogenesis of rheumatoid arthritis[J].Rheumatology(Oxford),2012,51(Suppl 5):v3-v11.
[2]肖楚吟,潘云峰,郭兴华,等.氯化锂对人滑膜成纤维细胞增殖影响[J].中国病理生理杂志,2010,26(8):1640-1642.
[3]郭兴华,潘云峰,宋泽蓉,等.Fractalkine对类风湿关节炎患者成纤维样滑膜细胞中 NF-κB活化及内源性fractalkine mRNA表达的影响[J].中国病理生理杂志,2011,27(10):1967-1971.
[4]García S,Liz M,Gómez-Reino JJ,et al.Akt activity protects rheumatoid synovial fibroblasts from Fas-induced apoptosis by inhibition of Bid cleavage[J].Arthritis Res Ther,2010,12(1):R33.
[5]Shiota C,Woo JT,Lindner J,et al.Multiallelic disruption of the rector gene in mice reveals that mTOR complex 2 is essential for fetal growth and viability[J].Dev Cell,2006,11(4):583-589.
[6]Sarbassov DD,Guertin DA,Ali SM,et al.Phosphorylation and regulation of Akt/PKB by the Rictor-mTOR complex[J].Science,2005,307(5712):1098-1101.
[7]Zhang HG,Wang Y,Xie JF,et al.Regulation of tumor necrosis factor α-mediated apoptosis of rheumatoid arthritis synovial fibroblasts by the protein kinase Akt[J].Arthritis Rheum,2001,44(7):1555-1567.
[8]Kim G,Jun JB,Elkon KB.Necessary role of phosphatidylinositol 3-kinase in transforming growth factor β-mediated activation of Akt in normal and rheumatoid arthritis synovial fibroblasts[J].Arthritis Rheum,2002,46(6):1504-1511.
[9]Volin MV,Huynh N,Klosowska K,et al.Fractalkine is a novel chemoattractant for rheumatoid arthritis fibroblastlike synoviocyte signaling through MAP kinases and Akt[J].Arthritis Rheum,2007,56(8):2512-2522.
[10]Calmon-Hamaty F,Combe B,Hahne M,et al.Lymphotoxin α stimulates proliferation and pro-inflammatory cytokine secretion of rheumatoid arthritis synovial fibroblasts[J].Cytokine,2011,53(2):207-214.
[11]Hayer S,Pundt N,Peters MA,et al.PI3Kγ regulates cartilage damage in chronic inflammatory arthritis[J].FASEB J,2009,23(12):4288-4298.
[12]Lee YG,Lee J,Byeon SE,et al.Functional role of Akt in macrophage-mediated innate immunity[J].Front Biosci,2011,16:517-530.
[13]Hoang B,Frost P,Shi Y,et al.Targeting TORC2 in multiple myeloma with a new mTOR kinase inhibitor[J].Blood,2010,116(22):4560-4568.
[14]Roulin D,Cerantola Y,Dormond-Meuwly A,et al.Targeting mTORC2 inhibits colon cancer cell proliferation in vitro and tumor formation in vivo[J].Mol Cancer,2010,9:57.
[15]Zhang F,Zhang X,Li M,et al.mTOR complex component Rictor interacts with PKCζ and regulates cancer cell metastasis[J].Cancer Res,2010,70(22):9360-9370.

