免疫磁珠富集结合酶联免疫吸附法检测酱油中黄曲霉毒素B1
谢 芳,赖卫华,*,史爱武,邓省亮,熊勇华,余扬帆
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.无锡中德伯尔生物技术有限公司,江苏 无锡 214000;3.江西省科学院微生物研究所,江西 南昌 330029)
黄曲霉毒素是真菌的次级代谢产物,主要由黄曲霉(Aspergillus flavus)、寄生曲霉(Aspergillus parasiticus)和特曲霉(Aspergillus nomius)产生[1-2]。黄曲霉毒素主要存在于土壤、动植物、各种坚果、特别是花生和核桃中。在大豆、稻谷、玉米、通心粉、调味品、牛奶及奶制品、酱油、食用油等制品中也经常发现黄曲霉毒素[3-6]。在所有的真菌毒素中,黄曲霉毒素Bl(aflatoxin B1,AFB1)的毒性、致癌性、致突变性、致畸性均居首位[7-10]。AFB1是目前化学致癌物中最强的一种致癌诱变剂,其毒性比氰化钾强10倍,比砒霜强68倍;其致癌性比二甲基亚硝胺强75倍,比二甲基偶氮苯强900倍。1993年黄曲霉毒素被世界卫生组织(WHO)的癌症研究机构划定为Ⅰ类致癌物[11]。1966年WHO/FAO首次规定了食品中黄曲霉毒素最高允许量,明确规定谷物中AFB1的含量不得超过20μg/kg,否则将禁止投放市场[12]。AFB1污染遍布世界各地,在热带和亚热带地区尤为严重,而且热稳定性较强,一般的烹调温度对其破坏很少[13]。
目前食品中AFB1的主要提取方法包括有机溶剂萃取法、免疫亲和层析法等。有机溶剂萃取法是目前最普遍的提取方法,但有机溶剂的萃取存在过程复杂、毒性大、所需时间长等缺点,而且由于最终提取物中可能存在其他荧光物质、色素、结构类似物,从而对检测结果产生干扰[14]。免疫亲和层析提高了试样的净化效果,同时可显著减少有毒有害试剂的使用,但样品前处理较复杂,价格昂贵。
免疫磁珠分离技术可将分离与富集结为一体,因此具有高效、快速和操作简便等优点。免疫磁珠的富集净化包括吸附和洗脱两个过程,吸附是免疫磁珠和样品中的待测物之间的特异性结合,而洗脱是用有机溶剂将吸附在免疫磁珠上的待测物洗下来,与磁珠分离[15-16]。免疫磁珠富集净化作为一种前处理手段可避免传统方法的缺点,它不仅可以减少有毒有害试剂的使用,提高试样的净化效果,而且所需设备简单,操作简便。目前国内外尚未见以免疫磁珠富集净化结合酶联免疫吸附法检测酱油基质中的AFB1的报道。本实验拟建立以免疫磁珠富集净化结合酶联免疫吸附法检测酱油基质中的AFB1的方法,以期为检测酱油基质中的AFB1提供一种有效的新途径。
1 材料与方法
1.1 材料与试剂
AFB1美国Sigma公司;PM3-020(粒径180nm)、SM3-P100(粒径1150nm)羧基化磁珠 上海奥润微纳新材料科技有限公司;特级金标酱油 佛山海天调味食品股份有限公司;AFB1酶联免疫试剂盒 无锡中德伯尔生物技术有限公司;Micro BCATMProtein Assay Kit 美国Pierce生物技术有限公司;三氯甲烷、甲醇、无水硫酸钠(AR级) 国药集团上海化学试剂有限公司。
1.2 仪器与设备
6102电子精密天平 余姚市纪铭称重校验设备有限公司;DK-S22数显恒温水浴锅 上海精宏实验设备有限公司;ZDP-A2160恒温培养箱 上海智诚分析仪器制造有限公司;DNM-9602酶标测定仪 北京普朗新技术有限公司;BHC-1300ⅡA/B3生物安全柜 苏州苏净集团安泰公司;H-7500型透射电子显微镜 日本日立公司。
1.3 方法
1.3.1 磁珠的表征
利用透射电子显微镜对所用的磁珠粒子进行形貌和分散性分析。
1.3.2 磁珠与抗体的偶联
1.3.2.1 偶联步骤
1)清洗:分别取5mg羧基化磁珠于5mL离心管中,2mL PB(0.02mol/L,pH6.0)洗2次,洗涤后用2mL MES(0.05mol/L,pH6.0)重悬;2)活化:超声使磁珠分散,再分别加入1mg EDC,1mg NHSS(用0.05mol/L、pH6.0的MES溶解),25℃活化2h,15r/min旋转保持悬浮状态;3)偶联:磁分离,吸去上清液,2mL PB(0.02mol/L,pH7.4)洗涤一次并转移至新的离心管,3mL PB(0.02mol/L,pH7.4)重悬,超声使磁珠分散。再分别将275μg辛酸-硫酸铵法[17]纯化的抗AFB1单克隆抗体加入到已活化磁珠中,25℃偶联3h,15r/min旋转保持悬浮状态;4)封闭:磁分离,取出上清液(上清液中的蛋白含量待检),加入1mg/mL乙醇胺及1mg/mL BSA封闭(用0.02mol/L、pH7.4的PB溶解,并调节pH值至中性),25℃封闭2h,15r/min旋转保持悬浮状态;5)保存:0.01mol/L PBS洗涤磁珠2次,磁分离,去上清液,用3mL pH7.4 PB(0.02mol/L,含0.02%NaN3和0.5%BSA)重悬,存于4℃。
1.3.2.2 免疫磁珠偶联率的分析
通过Micro BCATMProtein Assay Kit测量562nm波长处的OD值,制定标准曲线,检测偶联后上清液中剩余的抗体量,间接计算出偶联到磁珠表面的抗体量,然后根据公式计算抗体偶联率。
1.3.2.3 抗体与磁珠偶联条件的优化
1)偶联液的优化:取已活化的180nm磁珠2mg,加入单克隆抗体150μg,分别以去离子水(pH8.0)、PB(0.02mol/L,pH8.0)、PBS(0.01mol/L,pH8.0)、碳酸盐缓冲液(0.05mol/L,pH8.0)作为偶联反应体系,比较抗体偶联率。
2)偶联缓冲液pH值的优化:取已活化的180nm磁珠2mg,加入单克隆抗体150μg,以3种不同pH值的缓冲液作为偶联反应液,分别为pH7.4、8.4、9.6的0.02mol/L PB,比较抗体偶联率。
3)抗体加入量的优化:取已活化的180nm磁珠2mg,分别加入35、50、65、80、95、110、125、140、155、170μg单克隆抗体,在最佳的缓冲体系中进行偶联,比较抗体偶联量。
1.3.3 免疫磁珠富集AFB1
1.3.3.1 免疫磁珠富集AFB1步骤
1)上样:取0.5mg免疫磁珠,磁力架分离,用0.01mol/L、pH7.4 PBS洗涤2次,加入适量AFB1,并使最终体积为3mL,甲醇含量为20%,25℃反应1h,15r/min旋转保持悬浮状态;2)洗涤:磁力架分离,1mL 20%甲醇溶液洗涤1次,收集上清液与洗涤液,存放于4℃,以备酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)检测;3)洗脱:用400μL纯甲醇洗脱2次(200μL/次,3min/次),收集洗脱液,存放于4℃,以备ELISA检测。
1.3.3.2 免疫磁珠富集AFB1条件的优化
AFB1难溶于水,易溶于甲醇等有机溶剂,但甲醇等有机溶剂会对免疫磁珠表面的抗体活性造成影响。本实验对免疫磁珠富集AFB1的反应条件进行了优化,选择含10%、15%、20%、25%甲醇的0.01mol/L PBS作为富集反应体系,采用0.5mg的免疫磁珠,对5ng的AFB1进行富集实验,比较各体系对AFB1的回收率。
1.3.3.3 免疫磁珠的最佳使用量
采用1g酱油作为食品基质,添加5ng的AFB1(依据GB 2761—2011《食品中真菌毒素限量》)。为了选择最佳免疫磁珠的用量,本实验对免疫磁珠的用量进行了优化,选择0.3、0.4、0.5、0.6、0.7mg的免疫磁珠在含20%甲醇的PBS中富集5ng的AFB1,比较其对AFB1的回收率。
1.3.3.4 不同粒径的免疫磁珠对AFB1富集效果的比较
180nm和1150nm羧基化超顺磁珠通过EDC,NHSS活化后,与抗AFB1单克隆抗体偶联得到AFB1免疫磁珠。分别取0.5mg大小粒径的免疫磁珠富集5ng的AFB1,通过偶联率及回收率来比较富集效果。
1.3.4 在酱油中的应用
1.3.4.1 不同稀释度酱油中AFB1富集效果的比较
鉴于酱油中盐离子浓度对免疫磁珠活性的干扰,对酱油进行了简单的前处理,用蒸馏水和甲醇分别将1g阴性酱油稀释成含20%甲醇的1、1.5、3mL体系。采用0.5mg免疫磁珠对5ng的AFB1进行富集净化实验,比较其对AFB1的回收率。
1.3.4.2 0.5mg免疫磁珠富集不同AFB1含量的酱油
取适量AFB1阴性酱油,分别添加AFB1标准品使其最终质量浓度达1、3、5、7μg/kg。均采用0.5mg免疫磁珠,按照已优化的方法进行富集实验,比较对AFB1的回收率。
1.3.5 酱油样品中前处理方式的比较
取适量AFB1阴性酱油,添加AFB1标准品使其最终质量浓度达5μg/kg。分别按照本实验已优化的免疫磁珠富集法和GB/T 5009.22—2003《食品中黄曲霉毒素Bl的测定》的方法进行AFB1的提取,再用AFB1酶联免疫吸附法检测,比较方法的优越性
1.3.5.1 免疫磁珠富集法
根据GB 2761—2011添加AFB1标准品:上样:称取1.00g阴性酱油于5mL离心管中,加入5ng AFB1标准品稀释液,使最终体积为3mL,甲醇含量为20%,振荡混匀。同时将制备好的0.5mg免疫磁珠用0.01mol/L pH7.4 PBS洗涤2次,将已稀释好的酱油加入到免疫磁珠中;洗涤:磁力架分离,1mL 20%甲醇溶液洗涤1次,收集上清液与洗涤液,存放于4℃,以备ELISA检测;洗脱:用400μL纯甲醇洗脱2次(200μL/次,3min/次),收集洗脱液,存放于4℃,以备ELISA检测。
1.3.5.2 GB/T 5009.22—2003方法测定
根据GB 2761—2011添加AFB1标准品,按照GB/T 5009.22—2003对10.00g酱油进行有机溶剂提取。
1.3.6 AFB1酶联免疫试剂盒检测
加样:每孔加入标准品溶液或提取完成的待检样品50μL,然后每孔分别加入AFB1标记HRP溶液50μL;温育:轻轻振荡混匀,用封板膜封板后置于37℃避光静置30min;洗涤:小心揭开封板膜,将孔内液体甩干,加入1×洗涤液250μL/孔,充分洗涤3次,用吸水纸拍干;显色:底物溶液A和底物溶液B按体积比1∶1混合,轻轻振荡混匀,每孔加入混合后的底物溶液100μL,37℃避光显色15min;测定:每孔加入终止液50μL,轻轻振荡混匀,5min内测定450nm波长处的吸光度。
2 结果与分析
2.1 超顺磁珠的表征
将购买的1150nm和180nm粒径的羧基化超顺磁珠在透射电子显微镜下观察,1150nm和180nm磁珠电镜图的比例分别是1∶8000及1∶35000,由图1可知,大小粒径的磁珠粒子均呈圆形,单分散性较好。
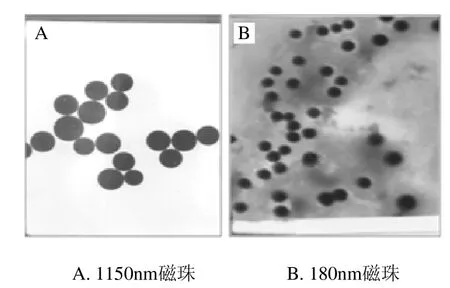
图1 FFee3O4磁珠的电镜图Fig.1 TEM micrograph of Fe3O4 magnetic beads
2.2 抗体与磁珠偶联条件的优化
2.2.1 偶联液的优化
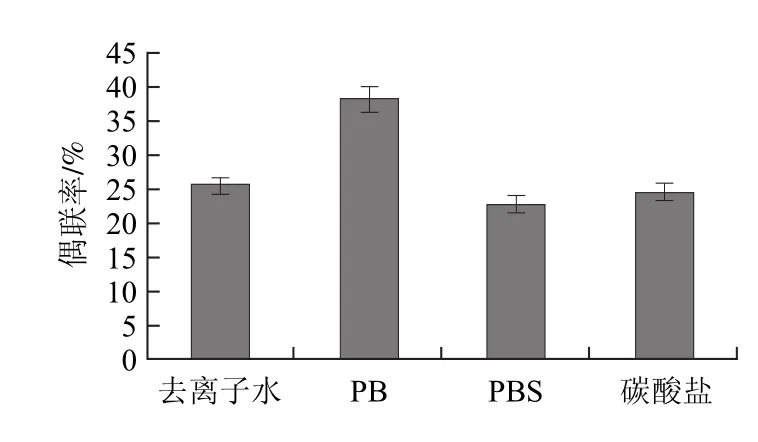
图2 不同反应液的抗体偶联率Fig.2 Antibody-coupling efficiency in different buffers
不同反应体系的抗体偶联率如图2所示,PB缓冲液的偶联效果最好,所以选0.02mol/L PB作为偶联反应液。
2.2.2 偶联缓冲液pH值的优化
由图3可知,pH7.4的PB缓冲液偶联效果最好,所以选pH7.4 0.02mol/L PB作为偶联缓冲液。
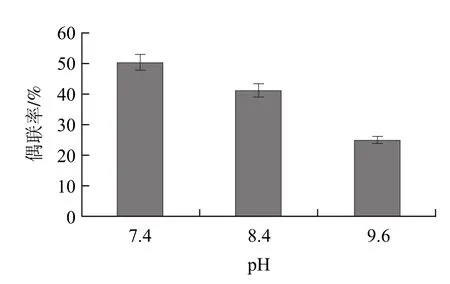
图3 不同pH值缓冲液的抗体偶联率Fig.3 Antibody-coupling efficiency in PB buffer at different pH values
2.2.3 抗体加入量的优化
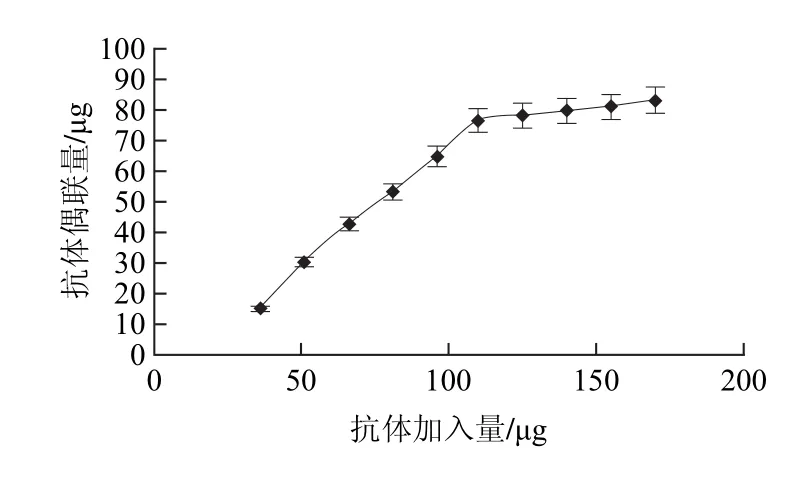
图4 抗体加入量对偶联效果的影响Fig.4 Effect of antibody amount on conjugation efficiency
由图4可知,当抗体量加入在35~110μg之间时,偶联上的抗体量逐渐增加,当加入的抗体量大于110μg时,偶联上的抗体量趋向饱和,所以2mg磁珠的最佳抗体加入量为110μg,偶联上的抗体量为76.7μg。
2.3 免疫磁珠富集AFB1条件的优化
在不同甲醇体积分数的富集条件下,对AFB1回收率如图5所示,甲醇体积分数在20%左右时富集效果最好,所以在本实验中采用含20%甲醇的富集体系。

图5 甲醇体积分数对富集AFB1的影响Fig.5 Effect of methanol concentration on aflatoxin B1 enrichment
2.4 免疫磁珠的最佳使用量
不同磁珠用量对AFB1的回收率如图6所示,当免疫磁珠的加入量为0.3~0.5mg时,AFB1的回收率逐步上升,能达到98.2%,当加入的免疫磁珠用量大于0.5mg时,回收率基本趋于饱和。所以选择免疫磁珠0.5mg为最佳使用量。
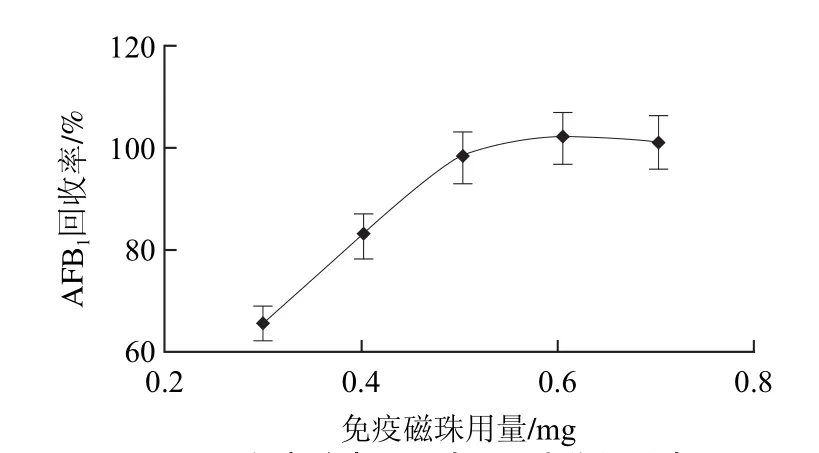
图6 免疫磁珠用量对AFB1富集的影响Fig.6 Effect of IMB (immunomagnetic bead) amount on aflatoxin B1 enrichment
2.5 不同粒径的免疫磁珠对AFB1富集效果的比较
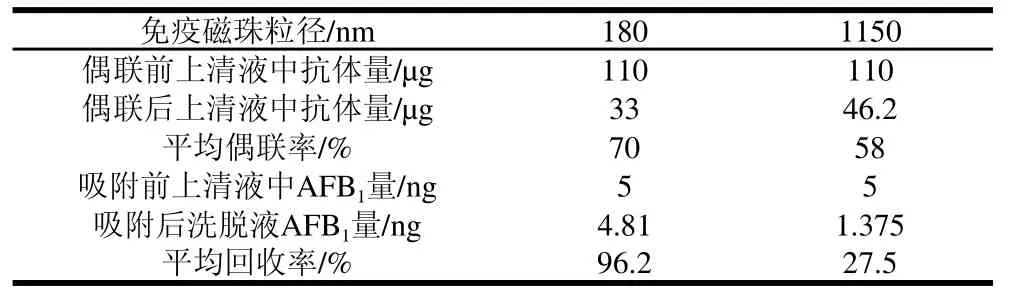
表1 免疫磁珠的抗体偶联率及对AFB1的回收率Table 1 Antibody-coupling efficiency of IMBs of different sizes and average recovery rate of aflatoxin B1
由表1可知,虽然两种免疫磁珠的抗体偶联率相差不大,但180nm的免疫磁珠对AFB1的富集效果远高于1150nm的免疫磁珠。可能原因是小粒径磁珠的比表面积更大,所能结合反应的位点更多。所以本实验选择180nm的磁珠。
2.6 不同稀释度酱油中AFB1富集效果的比较
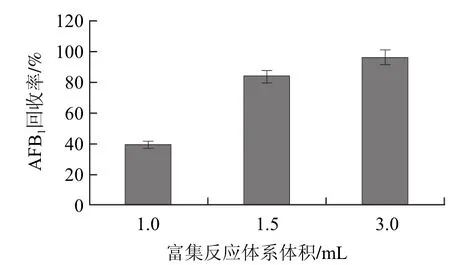
图7 不同稀释度对富集酱油中AFB1的影响Fig.7 Effect of different dilution ratios on aflatoxin B1 enrichment
由图7可知,3种体系中3mL体系的富集效果最好,所以在酱油中选用含20%甲醇的3mL体系。
2.7 0.5mg免疫磁珠富集不同AFB1含量的酱油
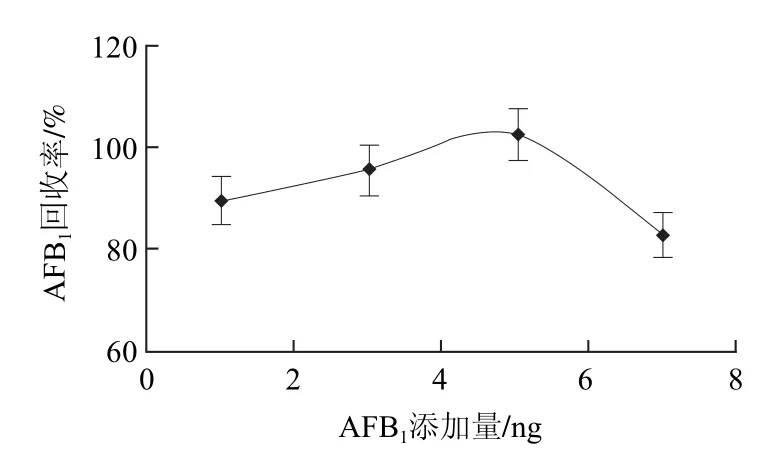
图8 免疫磁珠富集AFB1的回收率Fig.8 Recovery rates of AFB1 by IMBs
由图8可知,其平均加标回收率分别为90%、96%、104%、83.6%,计算出相对标准偏差分别为7.2%、9.4%、12.8%、13.7%。由实验结果并综合考虑,0.5mg的免疫磁珠富集AFB1的柱容量为5ng左右。
2.8 酱油中两种不同前处理方式的比较
2.8.1 免疫磁珠富集法
按照已优化的实验方法进行测定,得其平均加标回收率为104%,相对标准偏差为12.8%。
2.8.2 GB/T 5009.22—2003的方法
得其平均加标回收率为49%,相对标准偏差为14.8%。实验结果表明,以ELISA作为检测方法,免疫磁珠的富集净化方法优于GB/T 5009.22—2003的有机溶剂提取的方法。
2.9 酶联免疫吸附法的标准曲线
将质量浓度为0、0.05、0.15、0.3、0.9、2.7ng/mL的AFB1标准溶液加到酶标板的孔中,测定吸光度。百分吸光度按下式计算:
百分吸光度/%=B/B0×100
式中:B为所测得的标准液吸光度的平均值;B0为第1个标准液的吸光度。
以AFB1标准品质量浓度为X轴,对应的百分吸光度为Y轴,如图9所示。该曲线在0.05~0.3μg/kg范围内具有良好的线性关系,相关系数为0.9842,同时该检测方法的灵敏度较高,为0.05μg/kg,可满足实际检测需要。
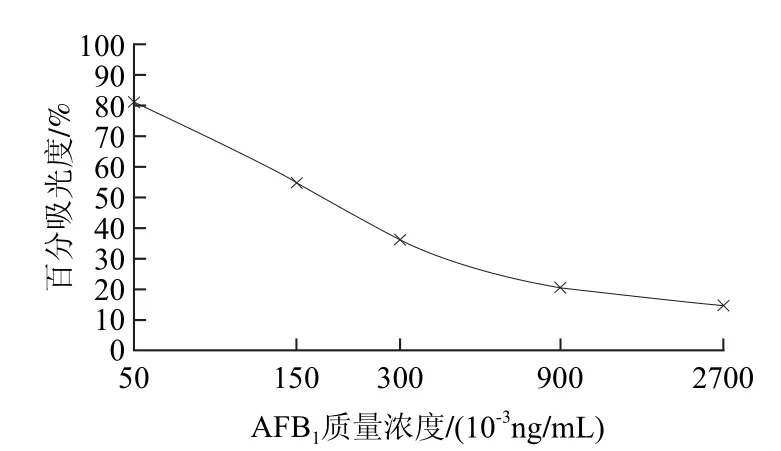
图9 AFB1酶联免疫吸附法的标准曲线Fig.9 Calibration curve of AFB1 ELISA Kit
3 讨论与结论
目前在大豆酿造酱油及各种酱油制品中均存在不同程度的AFB1污染。孙秀兰等[18]对我国5个省中203个酱油样品中的AFB1含量进行了检测,数据分析发现AFB1普遍存在于酱油产品中,少数样品中AFB1含量较高,已接近欧盟标准2μg/kg。徐丹等[19]对酿造酱油生产过程中AFB1的动态变化进行了研究,结果发现酱油中AFB1有50%是由生产原料带来的,剩下50%是在制曲过程中产生的污染,虽然蒸煮、制曲、发酵、淋油4阶段均对AFB1有一定的去除作用,但生产结束后仍有52.04%的AFB1转移到成品酱油中。这种污染在传统发酵产品中很常见,所以在酱油中建立一种快速检测AFB1的方法具有重要意义。
针对目前酱油中AFB1的含量及检测现状,本实验初步建立了以免疫磁珠富集净化,联合酶联免疫试吸附法检测酱油基质中的AFB1的方法。该方法具有操作简便、设备简单、灵敏度高、准确性好等优点,加标回收率为83.6%~104%,所需时间在2.5h以内,可很好地应用于酱油中AFB1的快速检测,结果表明该方法优于GB/T 5009.22—2003中有机溶剂提取的方法,而且减少了有机溶剂的使用。刘伟伟等[20]利用免疫磁珠体系对植物油中的AFB1进行了检测的研究,平均回收率可达96%。
通过不同粒径的免疫磁珠富集效果的比较,发现小粒径磁珠的富集效果远远高于大粒径磁珠,其可能原因是小粒径磁珠的比表面积更大,所能结合的位点更多,这使得小粒径磁珠的应用将具有更大的潜能。通过实验也发现,含20%甲醇的反应液作为吸附体系具有很好的富集效果,这与AFB1本身的属性和免疫磁珠的活性有关,AFB1难溶于水,易溶于甲醇等有机溶剂,但有机溶剂对免疫磁珠表面的抗体活性影响很大,从实验结果可知,20%的甲醇既能让AFB1充分溶解,保持原有的分子结构,同时也不会让免疫磁珠表面的抗体活性受到很大的影响。在实验过程中发现,磁珠在操作过程中容易产生聚集现象,这对其反应活性产生了很大的影响,使部分磁珠的活性不能得到充分的利用,本实验所采用的方法是适当超声,可以使磁珠粒子得到很好的分散。酱油中的盐离子浓度较高,对实验的影响很大,本实验通过稀释来减少基质的干扰,使富集效果得到改善。
[1]LEONTOPOULOS D, SIAFAKA A, MARKAKI P. Black olives as substrate forAspergillus parasiticusgrowth and aflatoxin B1production[J]. Food Microbiology, 2003, 20(1)∶ 119-126.
[2]YU J, BHATNAGAR D, CLEVELAND T E. Completed sequence of aflatoxin pathway gene cluster inAspergillus parasiticus[J]. Federation of European Biochemical Societies, 2004, 564(1/2)∶ 126-130.
[3]徐洲, 谭书明, 焦彦朝, 等. 酶联免疫法测定干辣椒中的黄曲霉毒素B1[J]. 食品科学, 2009, 30(10)∶ 245-247.
[4]江湖, 熊勇华, 许杨, 等. EDC法制备黄曲霉毒素B1人工抗原的研究[J]. 食品科学, 2005, 26(7)∶ 125-128.
[5]王艳霞. 基于磁性微粒的黄曲霉毒素样本净化及层析试纸条研究[D]. 西安∶ 西北大学,2012.
[6]吴丹. 黄曲霉毒素在粮食和食品中的危害及防治[J]. 粮食加工,2007, 32(3)∶ 91-94.
[7]孙武长, 刘桂华, 杨红, 等. 粮食中真菌及真菌毒素污染调查[J]. 中国公共卫生, 2005, 21(12)∶ 1532.
[8]PETZINGER E, WEIDENBACH A. Mycotoxins in the food chain∶ the role of ochratoxins[J]. Livestock Production Science, 2002, 76(3)∶ 245-250.
[9]PETZINGER E, ZIEGLER K. Ochratoxin A from a toxicological perspective[J]. Vet Pharmacol, 2000, 23(2)∶ 91-98..
[10]STUDER-ROHR I, DIETRICH D R, SCHLATTER J, et al. The occurrence of ochratoxin in coffee[J]. Food Chem Toxicol, 1995,33(5)∶ 341-355.
[11]ELISABETE Y S. Evaluation of fumonisin-aflatoxin co-occurrence in Brazilian corn hybrids by ELISA[J]. Food Additives and Contaminants, 2001, 18(8)∶ 719-729.
[12]王彩云, 王政纲, 云战友. 酶联免疫法测定食品和饲料中的黄曲霉毒素[J]. 食品工程, 2007(4)∶ 58-60.
[13]邓省亮. 黄曲霉毒素B1胶体金免疫层析快速检测方法的研究[D]. 南昌∶ 南昌大学, 2006.
[14]孙秀兰, 赵晓联, 汤坚. 大米中黄曲霉毒素B1的提取方法优化[J]. 食品科学, 2004, 25(7)∶ 128-131.
[15]喻伟. 免疫磁珠的制备及其初步应用[D]. 武汉∶ 华中农业大学, 2010.
[16]余晓峰, 张萍, 宗凯, 等. 免疫磁珠法检测脱水蒜制品中沙门氏菌[J].食品科学, 2012, 33(24)∶ 257-259.
[17]陈丹, 孙广瑞, 柳增善. 辛酸-硫酸铵联合沉淀法在单克隆抗体纯化中的应用[J]. 安徽农业科学, 2007, 35(26)∶ 8105-8108.
[18]孙秀兰, 晏丽, 徐丹, 等. 酱油中黄曲霉毒素B1的风险评估[J]. 中国微生态学杂志, 2010, 22(8)∶ 748-753.
[19]徐丹, 王洪新, 张银志. 低盐固态酿造酱油生产过程中黄曲霉毒素B1和微生物的动态变化[J]. 食品与生物技术学报, 2011, 30 (6)∶ 905-910.
[20]刘伟伟, 孙秀兰, 张银志. 超顺磁性免疫磁珠体系应用于植物油中黄曲霉毒素B1的检测研究[J]. 分析测试学报, 2011, 30(12)∶ 1345-1350.

