黑龙江省西瓜细菌性果斑病发生初报
王文博 刘 东 张艳菊
(东北农业大学农学院,黑 龙江哈尔滨 150030)
近年来,黑龙江省西瓜种植面积稳定在21.5 万hm2,总产量450 万t,总产值30 亿元左右(王喜庆,2008)。随着优质高产品种的引进,生产上出现一种新的病害,侵染初期,果皮上出现直径几毫米的水浸状凹陷斑点,随后迅速扩展为直径几厘米不规则的大型病斑,发病中后期,果肉变成水浸状,果皮龟裂,溢出粘稠、透明的琥珀色菌脓。该病害一旦发生难以控制,不但降低西瓜品质,而且影响其经济价值,果实只要发病就失去了商品价值,对黑龙江省西瓜生产构成严重威胁,给瓜农造成了巨大的经济损 失。2010年笔者在发生上述症状的黑龙江省哈尔滨市和双城市西瓜田采集病样,进行了病原菌的分离、鉴定,以期明确病害发生原因,为病害的防治提供理论依据。
1 材料与方法
1.1 病原菌的采集及分离、纯化
2010年7月在黑龙江省哈尔滨市阿城区、双城市西瓜田采集发病果皮及种子,进行分离检测。在NA 培养基上采用平板划线法进行分离和纯化(方中达,1997),30℃培养48~72 h。获得纯化培养的菌株4个。
1.2 病原菌的致病性测定
将获得的菌株在30℃培养48 h,制成108cfu·mL-1的菌悬液,采用针刺法(金岩 等,2004)将配好的菌悬液接种到西瓜果实上,以接种清水为对照。28℃保湿72 h后观察发病情况。出现病症后,从病斑上再分离病菌,按柯赫氏法则进行鉴定。
1.3 病原菌的鉴定
1.3.1 病原菌的形态观察及染色 对有致病性的菌株,用结晶紫草酸胺染色法(方中达,1997)进行革兰氏染色。采用透射电镜的负染技术观察病原菌的鞭毛着生位置及数目、菌体形态,测量菌体大小。
1.3.2 病原菌的生理生化性状测定 各菌株在NA 培养基上培养48 h后,参照Schaad 等(2001)的方法对病原菌的耐盐性、对碳源的利用等生理生化性状进行测定。
1.3.3 细菌16S rDNA 序列分析 采用CATB 法提取待测细菌基因组DNA(Ausubelm et al.,1998)。以提取的DNA 为模板,采用细菌的16S rDNA 通用引物进行PCR 扩增(滕齐辉 等,2006)。引物序列为:上游引物F:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物R:5′-CGGCTACCTTGTTACGAC-3′,引物由生工生物工程(上海)股份有限公司合成。
PCR 反应体系:2.0 μL dNTP(2 mmol·L-1),引物F(10 μmol·L-1)、引物R(10 μmol·L-1)各1 μL,1 μLTaq酶(1U·μL-1),2.5 μL Buffer(10×),2 μL MgCl2(25 mmol·L-1),双蒸水14.5 μL,模板DNA 1 μL。
反应程序:94℃预变性 4 min;94℃变性 50 s,55℃退火 45 s,72℃延伸110 s,循环 30次;72℃保持10 min,最后在4℃下保存。扩增产物回收后,送生工生物工程(上海)股份有限公司测序部(北京)测序。测序结果与GenBank 中的核酸序列进行比对分析。
2 结果与分析
2.1 田间发病症状
田间发病症状主要表现在向阳面的西瓜果实表面,发病初期在果皮上出现直径几毫米的暗绿色水渍状凹陷斑点,后扩展为不规则的直径几厘米的大型病斑,果肉变成水浸状,果皮龟裂,常溢出粘稠、透明的琥珀色菌脓(图1)。
2.2 病原菌致病性测定
从发病果实上分离得到4个菌株,经致病性测定,H1(分离自哈尔滨市)和S1(分离自双城市)2个菌株对西瓜果实有致病性,在果皮上形成大的暗绿色水渍状病斑,最后果实腐烂,与田间发病症状一致。将接种后发病的果皮再次进行分离培养及接种鉴定,得到与最初分离相同的原病菌及症状。说明这2个菌株均为致病菌。

图1 田间发病症状
2.3 病原菌的鉴定
2.3.1 病原菌形态及染色反应 具有致病性的2个菌株在NA 平板上30℃生长1 d后均形成圆形、隆起、光滑、不透明的乳白色菌落,菌落直径可达2~3 mm,无明显色素产生。2个菌株革兰氏染色反应均为阴性,菌体呈短杆状,直或稍弯,大小为(1~2)μm×(0.5~1.0)μm;鞭毛极生、单根,长4~5 μm(图2)。

图2 病原菌的电镜照片
2.3.2 生理生化性状 供试H1 和S1 2个菌株的生理生化特性表现一致。生长最适温度为30℃,最低10℃,最高42℃,致死温度为51℃15 min。在碳源利用方面,可利用葡萄糖、蔗糖、乳糖和山梨醇,但不能利用D-木糖、D-甘露糖、D-阿拉伯糖、麦芽糖、鼠李糖、肌醇、奎尼酸和甜菜碱。能使明胶液化,但不能产生果聚糖,不能产生吲哚,不能使淀粉水解,过氧化氢酶、氧化酶和硝酸盐还原试验呈阳性,能利用吐温80,MR 试验(甲基红试验)和V-P试验(产生3-羟基丁酮试验)呈阴性,马铃薯软腐试验呈阴性,3%耐盐性试验呈阳性(表1)。

表1 待测菌株生理生化测定结果
2.3.3 细菌16S rRNA 序列分析 用细菌16S rRNA 通用引物扩增待测菌株H1 和S1 的16S rDNA,均得到1条1 400 bp 左右的条带(图3),扩增产物送生工生物工程(上海)股份有限公司测序,将所得到的序列结果与GenBank中的核酸序列进行比对分析。结果表明,H1 与GenBank 中的燕麦嗜酸菌西瓜亚种Acidovorax avenaesubsp.citrulli(登录号分别为FJ447560.1、FJ447558.1、FJ447559.1、AM850114.1)的同源性为100%,S1 菌株与上述几个菌株和AF078761.1 的同源性为89%~99%(表2)。
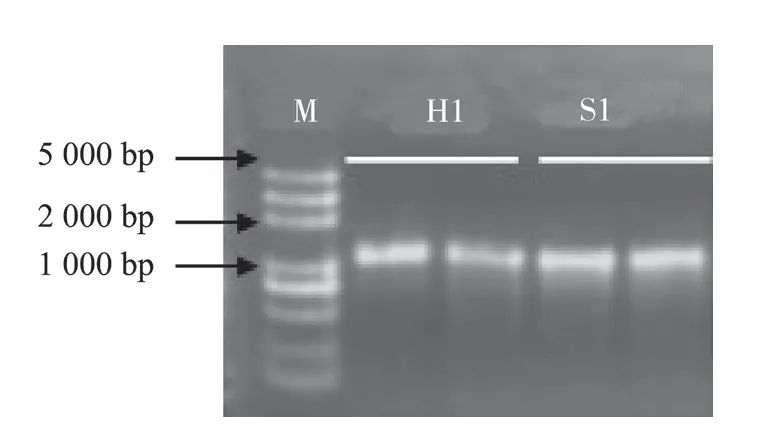
图3 菌株H1、S1 的PCR 扩增结果

表2 GenBank 中与供试菌株H1、S1 的16S rDNA 序列同源性最高的菌株
3 结论与讨论
有关西瓜细菌性果斑病的报道多集中在国外,最早于1969年在美国弗罗里达州由Crall 和Schenck(1969)报道。1978年在《植物病害手册》上描述了昆士兰、澳大利亚发生的细菌性果斑病在果实上的典型症状并认为其病原菌是假单胞菌(Pseudomonas)(Vock & Hampson,1978)。1988年Wall 和Santos(1988)报道在关岛有西瓜细菌性果斑病的发生,并首次将其病原菌鉴定为类产碱假单胞菌西瓜亚种(Pseudomonas pseudoalcaligenessubsp.citrulli)。1989年该病在美国各州暴发,对西瓜造成严重危害后,Wall(1989)才把病瓜和病苗联系起来,从而知道果斑病菌对幼苗和果实均能侵染。此后该病在土耳其、韩国等地相继出现并有报道(Hopkins,1989;Jec,1990;Latin & Rane,1990;Evans & Mulrooney,1991;Jacobs et al.,1992;Black et al.,1994;Demir,1996;Hamm et al.,1997)。直到1992年Willems 等(1992)根据西瓜果斑病病原菌的rRNA-DNA 和DNA-DNA 分子杂交研究结果,将其更名为Aciuovorax avenaesubsp.citrulli。国内1987年李明远(1987)报道了该病在北京的发生,张荣意等(1998)对在海南省乐东和东方两县采集的3个菌株进行了鉴定,将其病原菌鉴定为Acidovorax avenasubsp.citrulli。许瑛玲等(2000)报道了1997年以来在台湾的甜瓜种植区发生的细菌性果斑病,并将其病原鉴定为Acidovorax avenaesubsp.citrulli。张昕等(2001)报道了在新疆哈密瓜上发现了细菌性果斑病菌(Acidovorax avenaesubsp.citrulli)。同年,赵廷昌等(2001)报道了在内蒙古和新疆的哈密瓜上有细菌性果斑病的发生。金岩等(2004)在吉林、蔡学清等(2005)在福建、赵廷昌等(2009)在山东省寿光市和昌乐县均发现并报道了该病。
本试验对采自黑龙江省哈尔滨市阿城区和双城市病瓜上的细菌进行分离纯化、致病性测定、形态观察、染色反应、生理生化测定和16S rDNA 的序列分析,确定在黑龙江省阿城、双城地区西瓜上的病害为由Acidovorax avenaesubsp.citrulli引起的西瓜细菌性果斑病。本试验是首次报道黑龙江省西瓜细菌性果斑病的发生,对指导黑龙江省西瓜细菌性果斑病的检疫和防治具有重要意义。
蔡学清,黄月英,杨建珍,陈军,蔡国隆,胡方平.2005.福建省西瓜细菌性果斑病的病原鉴定.福建农林大学学报,4(4):434-437.
方中达.1997.植病研究法.3版.北京:中国农业出版社:156-211.
金岩,张俊杰,吴燕华,高洁.2004.西瓜细菌性果斑病的发生与病原菌鉴定.吉林农业大学学报,26(3):263-266.
李明远.1987.北京蔬菜病情志.1版.北京:科技出版社:84.
滕齐辉,曹慧,崔中利,王英,孙波,郝红涛,李顺鹏.2006.太湖地区典型菜地土壤微生物16S rDNA 的PCR-RFLP 分析.生物多样性,14(4):345-351.
王喜庆.2008.黑龙江省西瓜甜瓜生产现状、存在的问题和对策.中国瓜菜,(2):53-54.
许瑛玲,王惠亮,郑安秀.2000.甜瓜对细菌性果斑病菌之感受性及果斑病之防治.植物病理学会刊(台湾省),9(4):151-156.
张荣意,谭志琼,文衍堂.1998.西瓜细菌性果斑病症状描述和病原菌鉴定.热带农业学报,19(1):70-75.
张昕,李国英,金潜.2001.新疆哈密瓜细菌性斑点病病原的鉴定.石河子大学学报:自然科学版,5(1):245-247.
赵廷昌,孙福在,王兵万,回文广.2001.哈密瓜细菌性果斑病病原菌鉴定.植物病理学报,31(4):357-364.
赵廷昌,赵洪海,王怀松.2009.山东省西瓜、甜瓜发生瓜类细菌性果斑病.植物保护,35(5):170-171.
Ausubelm F,Brent R,Kingston R E.1998.精编分子生物学实验指南.颜子颖,王海林,译.北京:科学出版社:39.
Black M C,Isakeit T,Barnes L W,Kucharek T A,Hoover R T,Hodge N C.1994.First report of bacterial fruit blotch of watermelon in Texas.Plant Disease,78(8):831.
Crall J M,Schenck N C.1969.Bacterial fruit rot of watermelon in Florida.Plant Disease Report,53:74-75.
Demir G A.1996.Disease and pest outbreaks Turkey.A new bacterial disease of watermelon in Turkey:bacterial fruit blotch of watermelon Arab and Near East.Plant Protection Newsletter:23-33.
Evans T A,Mulrooney R P.1991.First report of watermelon fruit blotch in Delaware.Plant Disease,75(10):1074.
Hamm P B,Spink D S,Clovgh G H,Mohan K S.1997.First report of bacterial fruit blotch of watermelon in Oregon.Plant Disease,81(1):113.
Hopkins D L.1989.Bacterial fruit blotch of watermelon:a new disease in the Eastern USA.Proc Cucurbitaceae:74-75.
Jacobs D L,Damicone J P,Mecraw B D.1992.First report of bacterial fruit blotch of watermelon in Oklahoma(Abstr).Plant Disease,76(11):1185.
Jec H I.1990.Bacterial spot caused byPseudomonassp.of watermelon.Korean Journal of Plant Pathology,6(2):237-244.
Latin R X,Rane K K.1990.Bacterial fruit blotch of watermelon in Indiana.Plant Disease,74(4):331.
Schaad N W,Jones J B,Chun W.2001.Laboratory guide for identification of plant pathogenic bacteria.St Paul:APS Press.
Vock N T,Hampson S R.1978.A handbook of plant disease in colour.Vol1.Fruit and vegetables.Govemment Printer Queensland Australia:59-62.
Wall G C,Santos V M.1988.A new bacterial disease of watermelon in the Mariana Islands(Abstr).Phytopathology,78(12):1605.
Wall G C.1989.Control of watermelon fruit blotch by seed heat-treatment.Phytopathology,79(10):1191.
Willems A,Goor M,Thielemans S,Gillis M,Kersters K,de Ley J.1992.Transfer of several phytopathogenicpseudoumonasspecies toAcidovoraxasAcidovorax avenaesubsp.avenaesubsp.nov.,comb.nov.,Acidovorax avenaesubsp.citrulli,Acidovorax avenaesubsp.cattleyae,andAcidovorax konjaci.International Journal of Systematic Bacteriology,42:107-119.

