乙草胺在酸化黑土中的吸附行为1)
张 妤 王 帅 王玉军
(吉林农业大学,长春,130118)
近年来,由于人为和自然环境一些因素的影响,土壤酸化的现象越来越严重。土壤酸化导致土壤中Ca、Mg、P 等营养元素的缺乏,土壤贫瘠化,从而影响植物的生长。土壤酸化问题逐渐被人们所重视[1]。我国作为农业大国,农药的使用量是非常大的。我国农药的有效利用率较低(20% ~30%),其余未充分利用的农药残留在土壤,加之农药的化学性质非常稳定且不易去除,残留在土壤中的农药对土壤环境及地表水、地下水造成了严重的污染[2]。研究农药对酸化土壤的环境行为有着重要的实际意义。
乙草胺[3]是一种芽前选择性内吸性酰胺类除草剂,化学名称为2-氯代-2-乙基-6-甲基-N-(乙氧甲基)乙酰替苯胺,纯品为透明液体,熔点0 ℃,沸点200 ℃,微溶于水,溶于丙酮等有机溶剂。主要用于防除果园、豆科以及十字花科等作物间的杂草。作为我国使用最广泛的除草剂之一,具有去除杂草能力强、半衰期较短等特点,大范围应用农田除草。国内外对于乙草胺在土壤中的吸附行为及机理报道的很多[4-5],但是对于乙草胺在酸化黑土中的吸附行为的研究很少。
通过研究乙草胺在酸化黑土中的吸附行为以及添加EDTA 和NaCl 后乙草胺在酸化黑土中的环境行为,能够全面地了解乙草胺在酸化黑土的迁移规律,对研究酸化黑土对农药迁移的影响有着重要意义,研究结果可以为农药的污染控制与有效防治等提供理论依据。
1 材料与方法
1.1 供试土壤
试验所用的酸化黑土采自吉林省长春市净月区的表层土(0 ~20 cm)。土壤在通风处经自然风干后,去除样品中的砂粒及秸秆碎片等杂物,过2 mm筛待用。经测定,试验用酸化黑土的pH 值为5.40,有机质质量分数为3.86%,含水率为5.50%,密度为1.2 g·cm-3,阳离子交换质量摩尔浓度为15.91 mol·kg-1。
1.2 试剂与仪器
试剂:92%乙草胺原药(山东滨农科技有限公司)、乙二胺四乙酸二钠、石油醚(分析纯)、丙酮(分析纯)、氯化钠、无水硫酸钠。
仪器:6890N 气相色谱仪(美国Agilent 公司)配备μ-ECD 检测器、TDL-40B 台式高速离心机、Electronic BALANCE 电子天平、SPY50 双层培养摇床。
1.3 乙草胺的吸附试验设计
1.3.1 乙草胺溶液的配制
乙草胺贮备液:称取乙草胺原药0.216 9 g,用丙酮溶解,定容至100 mL,得到2 000 mg·L-1乙草胺贮备液,供配制不同质量浓度乙草胺水溶液使用。
乙草胺水溶液:分别取2 000 mg·L-1的乙草胺贮备液0、0.25、0.50、1.00、2.00、3.00、4.00 mL,均用丙酮补充至10 mL,加水定容至100 mL,得到质量浓度分别为0、5、10、20、40、60、80 mg·L-1乙草胺水溶液,供试验使用。
1.3.2 乙草胺的吸附试验
吸附动力学试验:采取振荡平衡法[6],在温度为25 ℃下,分别称取1.000 0 g 酸化黑土(准确至0.000 1 g),置于8 个250 mL 具塞磨口玻璃瓶中,分别加入20 mL 乙草胺溶液(40 mg·L-1),置于振荡器上25 ℃恒温振荡,振荡时间设置为0、0.5、1、2、4、8、12、24、48 h。待振荡结束后,将振荡液分别转移至离心管中,高速离心(4 000 r·min-1),取上清液用石油醚萃取后,分别用气相色谱测定乙草胺在液相中的平衡质量浓度。
吸附热力学试验:分别称取1.000 g 酸化黑土(准确至0.000 1 g),置于6 个250 mL 具塞磨口玻璃瓶中,分别加入20 mL 乙草胺溶液(质量浓度依次为5、10、20、40、60、80 mg·L-1)。重复操作一次上述步骤后,分别置于振荡器上25 ℃和45 ℃恒温振荡(振荡时间为吸附动力学试验所确定的吸附平衡时间)。待振荡结束后,将振荡液分别全部转移至离心管中,高速离心(4 000 r·min-1),取上清液用石油醚萃取后,分别用气相色谱测定乙草胺的质量浓度。
EDTA 对乙草胺在酸化黑土中的影响:在25 ℃条件下,分别称取1.000 0 g 酸化黑土(准确至0.000 1 g),置于6 个具塞磨口玻璃瓶中,分别加入0.050 0 g EDTA 二钠和20 mL 乙草胺溶液(5、10、20、40、60、80 mg·L-1),置于振荡器上25 ℃恒温振荡(振荡时间为吸附动力学试验所确定的吸附平衡时间)。待振荡结束后,将振荡液分别转移至离心管中,高速离心(4 000 r·min-1),取上清液用石油醚萃取后,分别用气相色谱测定乙草胺的质量浓度。
NaCl 对乙草胺在酸化黑土中的影响:在25 ℃条件下,分别称取1.000 0 g 酸化黑土(准确至0.000 1 g),置于6 个具塞磨口玻璃瓶中,分别加入0.013 0 g NaCl 和20 mL 乙草胺溶液(5、10、20、40、60、80 mg·L-1),置于振荡器上25 ℃恒温振荡(振荡时间为吸附动力学试验所确定的吸附平衡时间)。待振荡结束后,将振荡液分别转移至离心管中,高速离心(4 000 r·min-1),取上清液用石油醚萃取后,分别用气相色谱测定乙草胺的质量浓度。
1.4 气相色谱仪工作条件
色谱柱:HP5 柱(30. 00 m×0. 32 mm×0. 25 μm);以高纯氮气为载气,进样口温度为220 ℃,检测器温度为300 ℃;分流比为10 ∶1;流速为1.0 mL·min-1;进样量1 μL。
色谱柱程序升温:柱温从100 ℃以15 ℃·min-1的速度升温到158 ℃(保持1 min),再以3 ℃·min-1的速度升温到178 ℃(保持2 min)。
1.5 吸附反应的表观热力学参数计算
按照公式(1)、(2)、(3)计算吸附反应的表观热力学参数[7]。
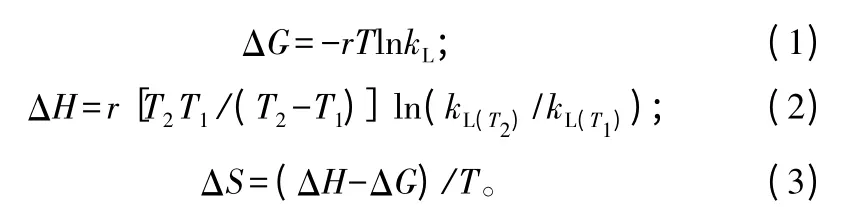
式中,ΔG、ΔH、ΔS 分别为表观自由能变(kJ·mol-1)、表观焓变(kJ·mol-1)、表观熵变(J·mol-1·K-1);r为气体常数(8.314 J·K-1·mol-1);T 为绝对温度(K);kL为Langmuri 方程中的平衡常数(L·mol-1)。
2 结果与分析
2.1 乙草胺的吸附动力学特征
研究乙草胺在酸化黑土中的吸附动力学特征,确定吸附等温试验的平衡时间。吸附动力学试验结果表明(图1):0 ~8 h 酸化黑土对乙草胺的吸附质量分数迅速增加;8 ~12 h 酸化黑土对乙草胺的吸附质量分数增加缓慢;12 h 后酸化黑土对乙草胺的吸附质量分数变化不明显,即酸化黑土对乙草胺的吸附达到平衡状态,因此,本试验的平衡吸附时间为12 h。
2.2 乙草胺的吸附等温线及吸附热力学特征
2.2.1 乙草胺的吸附等温线
从图2中可以看出,在温度为25 ℃,乙草胺初始质量浓度为0 ~80 mg·L-1时,酸化黑土对乙草胺的吸附质量分数从0 增至586.74 mg·kg-1。随着溶液中乙草胺质量浓度的不断增加,酸化黑土对乙草胺的吸附质量分数逐渐增加,在高质量浓度区,已经出现吸附质量分数缓慢增加的趋势,但未出现饱和吸附点。当温度为45 ℃时,乙草胺初始质量浓度为0 ~80 mg·L-1时,酸化黑土对乙草胺的吸附规律与温度为25 ℃条件下的大体相同,但随着乙草胺质量浓度的继续增加,酸化黑土对乙草胺的吸附质量分数增加的较为缓慢,仍然未出现饱和吸附点。另外,高温条件下(45 ℃),乙草胺在酸化黑土中的吸附质量分数明显小于低温条件下(25 ℃)的吸附质量分数。
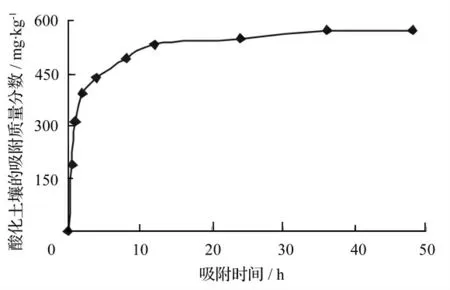
图1 乙草胺在酸化黑土中的吸附动力学曲线
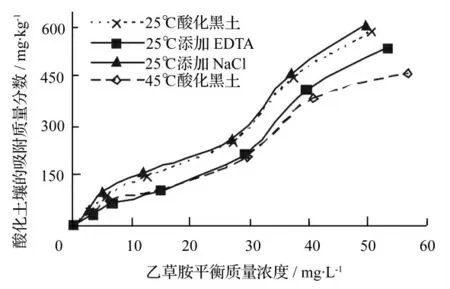
图2 不同条件下乙草胺在酸化黑土中的吸附等温线
在乙草胺质量浓度范围内(0 ~80 mg·L-1),酸化黑土对乙草胺的吸附质量分数逐渐增加但并未出现饱和吸附点,这主要是因为试验设计的初始质量浓度较低,若继续增加水相中乙草胺的质量浓度,酸化黑土还会增大对乙草胺的吸附质量分数。但是要得到较高初始质量浓度的乙草胺水溶液,就必须通过添加大量的有机溶剂助溶,这样就与土壤的实际环境相差较大,因而,乙草胺的初始质量浓度控制在本试验设计的范围内(0 ~80 mg·L-1)。温度的变化对乙草胺的吸附质量分数的大小造成了影响,主要是温度升高,乙草胺的水溶性会相应地提高,原本吸附于土壤的乙草胺会进入溶液中,因此,升高温度不利于乙草胺在酸化黑土中的吸附[8]。
2.2.2 乙草胺的吸附热力学
运用Freundlich[9]和Langmuir[10]方程对乙草胺在酸化黑土中的吸附等温线的拟合结果(表1)可见,Freundlich 方程和Langmuir 方程的拟合程度相差不大,但Langmuir 方程拟合的程度较好一些,可决系数R2均在0.970 以上,说明上述试验结果是可信的。Freundlich 方程参数n 反应了吸附动力的大小,kF值反应了吸附质量分数的大小,从表1可看出,kF值随着温度的升高而降低,表明酸化黑土对乙草胺的吸附为放热反应。而Langmuir 方程的特点就是可以根据其方程在y 轴上的截距计算出污染物在土壤中的饱和吸附质量分数。由于本试验未出现饱和吸附点,因此,运用Langmuir 方程还可以得出不同条件下乙草胺在酸化黑土中的饱和吸附质量分数。从表1中可以看出,25 ℃条件下的Langmuir方程的平衡常数kL值大于45 ℃条件下的kL值,但是最大吸附质量分数的大小顺序却相反。这说明低温条件下酸化黑土对乙草胺的吸附质量分数小但是吸附强度大。
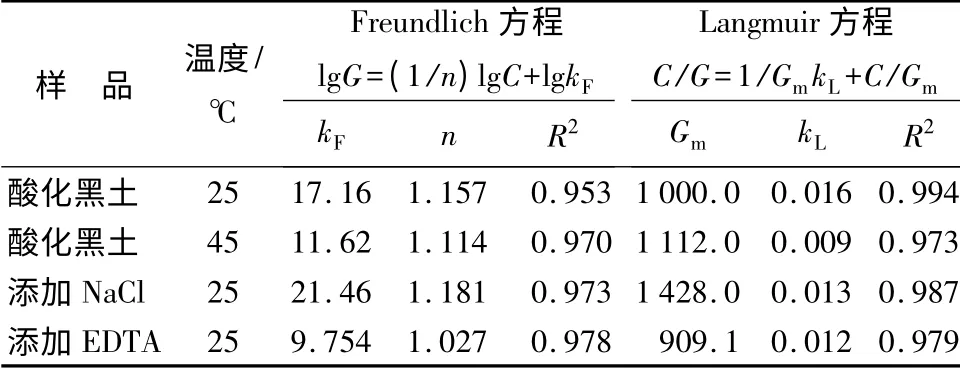
表1 乙草胺在酸化黑土中的吸附等温线参数
根据不同温度下Langmuir 方程的kL计算酸化黑土对乙草胺的表观热力学参数,结果见表2。ΔG>0,ΔH<0,ΔS<0,说明酸化黑土对乙草胺的吸附是非自发的、放热的和熵减少的过程。随着温度升高,ΔG 升高,说明增温不利于吸附的自发性,这一结果与上述Freundlich 方程和Langmuir 方程拟合的效果一致。另一方面,乙草胺在酸化黑土上的吸附自由能值ΔG<40 kJ·mol-1[11],表明乙草胺在酸化黑土上的吸附属于物理吸附。
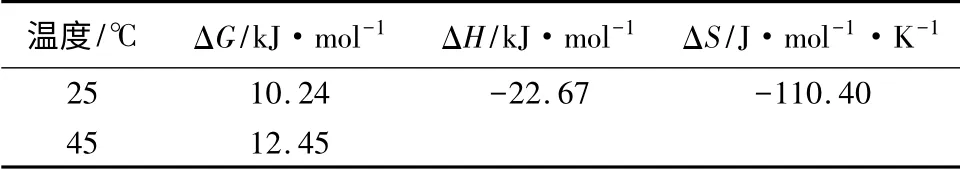
表2 酸化黑土吸附乙草胺热力学参数
2.3 EDTA 对乙草胺在酸化黑土中吸附的影响
从图2中可以看出,在乙草胺质量浓度范围内(0 ~80 mg·L-1),随着乙草胺质量浓度的不断增加,添加EDTA 后的酸化黑土对乙草胺的吸附质量分数不断增加,吸附曲线趋势与乙草胺的吸附等温线趋势大致相同。与未添加EDTA 处理相比,添加EDTA 后的酸化黑土对乙草胺的最大吸附质量分数值低于未添加EDTA 的酸化黑土的最大吸附质量分数值,酸化黑土对乙草胺的吸附质量分数减少。从表1可以看出,同一温度条件下,添加EDTA 后的酸化黑土的Langmuir 方程平衡常数kL值降低,并且最大吸附质量分数也降低,说明添加EDTA 的酸化黑土降低了对乙草胺的吸附质量分数,也降低了对乙草胺的吸附强度。
试验表明,酸化黑土对乙草胺的吸附质量分数与EDTA 的含量均呈现负相关性,因此,EDTA 的添加不利于供试土壤对乙草胺的吸附。导致这种现象的原因可能是多个方面因素共同作用的。首先,EDTA 的添加可能影响了土壤的一些理化性质,比如降低了土壤的孔隙度从而导致土壤的吸附能力下降,这与Wasay et al.[12]的研究相符合。其次,可能是由于EDTA 的络合性较好,与土壤中的乙草胺分子发生络合反应,使乙草胺分子从固相转移进入到水相之中,供试土壤对乙草胺的吸附能力减弱[13]。最后,EDTA 分子可能与土壤中的Al、Fe、Cu 等阳离子发生选择性的络合反应,占据了一些土壤颗粒的吸附位,与乙草胺分子产生竞争吸附,使得土壤对乙草胺的吸附质量分数减少,这与李松等[14]研究的结果相符合。
2.4 NaCl 对乙草胺在酸化黑土中吸附的影响
从图2中可以看出,在乙草胺质量浓度范围内(0 ~80 mg·L-1),随着乙草胺质量浓度的不断增加,添加NaCl 后的酸化黑土对乙草胺的吸附质量分数不断增加,吸附曲线趋势与乙草胺的吸附等温线趋势大致相同。与未添加NaCl 处理相比,添加NaCl 后的酸化黑土对乙草胺的最大吸附质量分数值高于未添加NaCl 的酸化黑土的最大吸附质量分数值,对乙草胺的吸附质量分数增加,但是增加值较小。由表1可知,同一温度条件下添加NaCl 后的酸化黑土的Langmuir 方程平衡常数kL值虽然降低了,但是最大吸附质量分数却升高了,说明添加NaCl 的酸化黑土虽然降低了对乙草胺的吸附强度,却增大了对乙草胺的最大吸附质量分数。
试验表明,酸化黑土对乙草胺的吸附质量分数与NaCl 的含量呈现微弱的正相关性,因此,NaCl 的添加有利于供试土壤对乙草胺的吸附,但是影响较小。影响其吸附的因素是比较复杂的,是许多因素共同作用产生的。首先,由于盐的加入[15],导致液相中的乙草胺的溶解量减少,转入到固相中去,溶解于水相中的乙草胺析出并附着在土壤颗粒表面上,固相中乙草胺的吸附量随之增加。其次,NaCl 也起着电解质的作用,溶液中电解质质量浓度的增加破坏了土壤颗粒原有的电解质平衡状态,这种状态造成原本与农药竞争吸附点位的带电粒子的活性下降,因此,土壤颗粒对乙草胺的吸附量增加,这与Ail et al.[16]所研究的理论相符合。
3 结束语
酸化黑土对乙草胺的吸附经历了快速、减速和平衡3 个阶段,并在12 h 达到吸附平衡。
在乙草胺质量浓度范围内(0 ~80 mg·L-1),酸化黑土对乙草胺的最大吸附质量分数为586.74 mg·kg-1,并未出现饱和吸附点,随着乙草胺质量浓度的升高,乙草胺的吸附质量分数还会继续增加。
Langmuir 方程对乙草胺的吸附情况拟合的程度较好。根据Langmuir 方程计算得到热力学参数ΔG>0,ΔH<0,ΔS<0,说明乙草胺在酸化黑土中的吸附属于非自发、放热、熵减少的过程。ΔG<40 kJ·mol-1,说明乙草胺在酸化黑土上的吸附属于物理吸附。高温条件下(45 ℃),乙草胺在酸化黑土中的吸附质量分数明显小于低温条件下(25 ℃)的吸附质量分数,说明温度的升高不利于乙草胺在酸化黑土中的吸附。
在乙草胺质量浓度范围内(0 ~80 mg·L-1),添加EDTA 对乙草胺在供试土壤中吸附具有一定的抑制作用,而添加NaCl 具有一定的促进作用。
[1] 范庆峰,张玉龙,陈重,等.保护地土壤酸度特征及酸化机制研究[J].土壤学报,2009,46(3):466-471.
[2] 何利文. 农药对地下水的污染影响与环境行为研究[D]. 南京:南京农业大学,2006.
[3] 郭柏栋.乙草胺在不同土壤中的吸附和微生物降解过程研究[D].福州:福建农林大学,2008.
[4] Nemeth-Konda L,Füleky Gy,Morovjan Gy,et al. Sorption behavirour of acetochlor,atrazine,carbendazim,diazinon,imidacloprid and isoproturon on hungarian agricultural soil[J]. Chemosphere,2002,48:545-552.
[5] 郭华,杨红.乙草胺及其它酰胺类除草剂在环境中的讲解与迁移[J].农药,2006,45(2):88-90.
[6] 王玉军,王宇,王鸿斌,等.土壤对硝基苯的吸附行为[J].东北林业大学学报,2007,35(10):48-50.
[7] 孟昭福,张一平.有机修饰改性土对镉离子的吸附及温度效应[J].土壤通报,2005,42(2):238-246.
[8] Ten Hulscher,Th E M,Cornelissen G. Effect of temperature on sorption equilibrium and sorption kinetics of organic micropollutants-a review[J]. Chemosphere,1996,32:609-626.
[9] Bellot J C,Condoret J S. Modelling of liquid chromatography equilibria[J]. Process Biochem,1993,28(2):365-376.
[10] Langmuir I. The Constitution and fundamental properties of solids and liquids[J]. Journal of American Chemical Society,1916,38(11):2221-2295.
[11] 刘萍,陈景文,边海涛,等. 酰胺类农药在白洋淀典型农田土壤上的吸附行为[J].湖南科技大学学报:自然科学版,2009,24(2):104-107.
[12] Wasay S A,Barrington S F,Tokunaga S. Organic acids for the insitu remediation of soils polluted by metals:soil flushing in columns[J]. Water Air and Soil Pollution,2001,127:301-314.
[13] 张玉亭,戴仲善.EDTA 对均匀胶体粒子形成的影响[J].物理化学学报,1993,9(6):728-733.
[14] 李松,刘波,汪琦,等.EDTA 对微电解体系降解对硝基苯酚的影响[J].环境化学,2009,28(6):783-787.
[15] 王艳娇,谭红,杨鸿波,等.NaCl 对Hg 在土壤中吸附规律及动力学的影响[J].安徽农业科学,2010,38(25):13750-13753.
[16] Ail M A,Dzombak D A. Effects of simple organic acids on sorption of Cu2+and Ca2+on goethite[J]. Geochimica,1996,60:291-304.

