响应面法优化桑白皮甾醇微波辅助提取工艺
徐艳阳,蔡森森,宋艳翎,李科静
(吉林大学生物与农业工程学院,吉林 长春 130022)
响应面法优化桑白皮甾醇微波辅助提取工艺
徐艳阳,蔡森森,宋艳翎,李科静
(吉林大学生物与农业工程学院,吉林 长春 130022)
为优化微波辅助提取桑白皮甾醇的工艺,分别考察微波功率、微波时间、液固比对桑白皮甾醇得率的影响;采用响应面法优化微波提取工艺,建立各因素与甾醇得率关系的回归方程。结果表明:最佳工艺条件为微波功率539W、微波时间41s、液固比35:1(mL/g),此时甾醇得率为(7.74±0.12)mg/g;实际值与理论值的相对误差为-4.21%,二者基本吻合。与溶剂法、超声波法相比,微波辅助法的甾醇得率分别提高了1.57%、19.07%,提取时间大大缩短。
桑白皮;植物甾醇;微波辅助提取;响应面;优化
桑白皮(Cortex Mori)为桑科桑属植物白桑(Morus alba L.)的干燥根皮,其外表面白色或淡黄白色,是我国卫生部于2002年公布的可用于保健食品的中药之一。其药理作用主要有利尿、降血压、镇咳、祛痰、平喘、抗炎和降糖等[1]。全世界共有12种桑科桑属植物,中国有9种,在全国各地均有栽培,主要分布于新疆、四川、河北、山东、云南、广东和东北三省等地。
植物甾醇是结构上类似于胆固醇的植物活性成分,具有降胆固醇、降血脂、抑制肿瘤和抗炎退热等功效[2-3]。目前经过鉴定的植物甾醇单体有250多种[4],最常见的5种成分是β-谷甾醇、菜油甾醇、豆甾醇、谷甾烷和菜油甾烷。2000年美国FDA批准添加植物甾醇的食品可采用“健康声称”标签[5]。2003年欧盟食品科学委员会(SCF)亦确证植物甾醇类食品的安全性[5]。然而我国对植物甾醇的开发研究很少,2009年国内粮油知名品牌金龙鱼率先将植物甾醇玉米油引入中国市场,2011年在上海成立的丰益•巴斯夫营养与健康联合研究院为植物甾醇的研究与运用提供国际性的研讨平台。因此植物甾醇的研究具有广阔的市场前景。
目前国内外学者对桑白皮的研究主要集中在黄酮[6-8]、生物碱[9]等的提取及抗氧化性[10-12]、降糖[13-14]和平喘[15]等方面。对桑白皮甾醇的研究报道很少,仅有Piao Shujuan[16]、胡叶梅[17-19]等学者采用色谱法测定了桑白皮甾醇的含量。微波辅助提取是近年来发展较快的一种新型提取技术,与传统提取方法相比,具有快速、方便、易操作的优点。因此本实验采用响应面法对桑白皮甾醇的微波提取工艺进行研究,为桑白皮甾醇的应用开发提供科学依据。
1 材料与方法
1.1 材料与试剂
桑白皮购于吉林省长春市同仁堂药店。
β-谷甾醇(分析标准品,纯度>95%) 阿拉丁试剂(中国)有限公司。
1.2 仪器与设备
KQ-250DB型超声波清洗仪 江苏省昆山市超声仪器有限公司;FW177型中草药粉碎机 天津市泰斯特仪器有限公司;MM721AAU-PW微波炉 美的微波电器制造有限公司;LD4-2A型低速离心机 北京市雷勃尔离心机有限公司;AL104型电子分析天平 梅特勒-托利多仪器有限公司;T22N紫外-可见分光光度计 上海精密科学仪器有限公司。
1.3 方法
1.3.1 桑白皮微波提取工艺流程
桑白皮→粉碎→加入0.5mol/L KOH-乙醇溶液→微波辅助提取1次→离心→得到上清液→调pH值至中性→离心→得到乙醇提取液→测定甾醇含量
1.3.2 甾醇含量的测定
参照文献[20]的硫磷铁法测定桑白皮甾醇得率。配制1.0mg/mL β-谷甾醇标准溶液,使用时稀释10倍。分别取0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0mL 0.1mg/mL β-谷甾醇溶液,用无水乙醇定容至4.0mL,加入硫磷铁显色剂2.0mL,摇匀;15min后在波长530nm处测定其吸光度。以β-谷甾醇溶液质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。
取1.0mL样液,用无水乙醇定容至10.0mL,摇匀;从中取2.0mL置于试管中,加入2.0mL无水乙醇,再加2.0mL硫磷铁显色剂,摇匀;静置15min后在波长530nm处测定其吸光度,根据标准曲线查出相应的β-谷甾醇溶液质量浓度,按下式计算样品中甾醇得率。
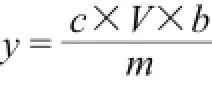
式中:y为桑白皮甾醇得率/(mg/g);c为提取液吸光度对应β-谷甾醇标准溶液质量浓度/(mg/mL);V为乙醇提取液体积/mL;b为稀释倍数;m为桑白皮质量/g。
1.3.3 单因素试验
选择微波功率、微波时间、液固比作为试验的单因素。称取1.0g桑白皮,加入0.5mol/L KOH-乙醇溶液(95%乙醇作溶剂)进行微波提取,为防止乙醇过度损失,每次微波10s,间歇10s。4000r/min离心5min,得到上清液,调pH值至中性,再次4000r/min离心5min得到上清液,采用硫磷铁法测定甾醇含量。各个因素的水平分别为:微波功率119、231、385、539、700W;微波时间10、20、30、40、50s;液固比15:1、20:1、25:1、30:1、35:1(mL/g)。在进行单因素试验时,其他固定条件分别为微波功率539W、微波时间40s、液固比25:1(mL/g)。
1.3.4 响应面试验
选择微波功率(x1)、微波时间(x2)、液固比(x3)作为考察因素,以甾醇得率作为响应值Y,采用中心组合响应面试验(CCD)进行优化。对自然因素水平进行编码(表1)。理论计算得到微波功率最高值和最低值分别为644、126W,而实际微波炉最高和最低输出功率分别为700、119W。因此结合仪器的实际条件并参考有关文献[21],选择因素水平编码如表1所示。

表1 CCD试验因素水平编码表Table1 Coded levels for independent variables used in central composite design (CCD)
1.3.5 对比实验
溶剂法:称取1.0g桑白皮,按液固比35:1加入0.5mol/L KOH-乙醇溶液,采用90℃条件水浴浸提60min,4000r/min离心5min,得到上清液,调pH值至中性,再次4000r/min离心5min得到上清液,采用硫磷铁法测定甾醇含量。
超声法:称取1.0g桑白皮,按液固比35:1加入0.5mol/L KOH-乙醇溶液,采用超声功率250W提取60min,检测步骤同上。
微波法:称取1.0g桑白皮,按液固比35:1加入0.5mol/L KOH-乙醇溶液,采用微波功率539W提取41s,检测步骤同上。
1.4 数据分析
每次实验重复3次,采用Excel 2003软件计算,取平均值±标准偏差。应用Design Expert 8.0.5软件进行中心组合响应面试验设计(central composite design,CCD),并进行数据分析。
2 结果与分析
2.1 β-谷甾醇标准曲线的建立
采用硫磷铁法进行测定,建立β-谷甾醇溶液标准曲线,得到回归方程A=5.467ρ+0.004,式中:A为吸光度;ρ为β-谷甾醇溶液质量浓度/(mg/mL);该方程相关系数R2=0.9986,说明β-谷甾醇溶液质量浓度在0.0125~0.1000mg/mL范围内线性关系良好,可以用于定量分析。
2.2 单因素试验及分析
2.2.1 微波功率对甾醇得率的影响
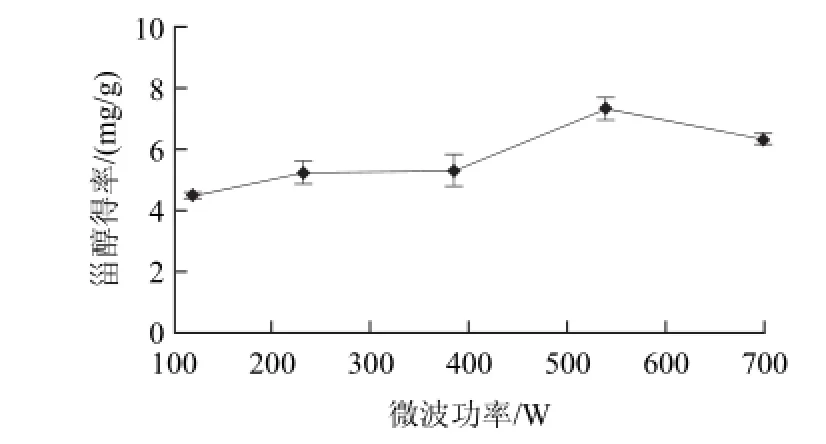
图1 微波功率对甾醇得率的影响Fig.1 Effect of microwave output power on the yield of phytosterol
由图1可知,当微波功率从119~539W,甾醇得率随微波功率的增大而增加;超过539W后,甾醇得率逐渐下降,原因可能是电磁波将能量直接传到桑白皮内部,在瞬时加热的过程中,高温导致甾醇活性成分破坏。因此选择微波功率为539W。
2.2.2 微波时间对甾醇得率的影响
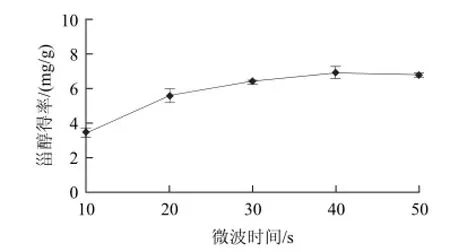
图2 微波时间对甾醇得率的影响Fig.2 Effect of microwave irradiation time on the yield of phytosterol
2.3 CCD响应面法优化微波提取工艺
2.3.1 CCD试验及其结果分析
根据单因素试验结果,选择微波功率(x1)、微波时间(x2)、液固比(x3)作为考察因素,以甾醇得率作为响应值Y,采用CCD进行优化试验。CCD试验方案的设计及结果见表2,方差分析结果见表3。由图2可知,微波时间在10~40s内,甾醇得率随微波时间的延长而增加;超过40s以后,甾醇得率增加的幅度不大。因此选择微波时间为40s。
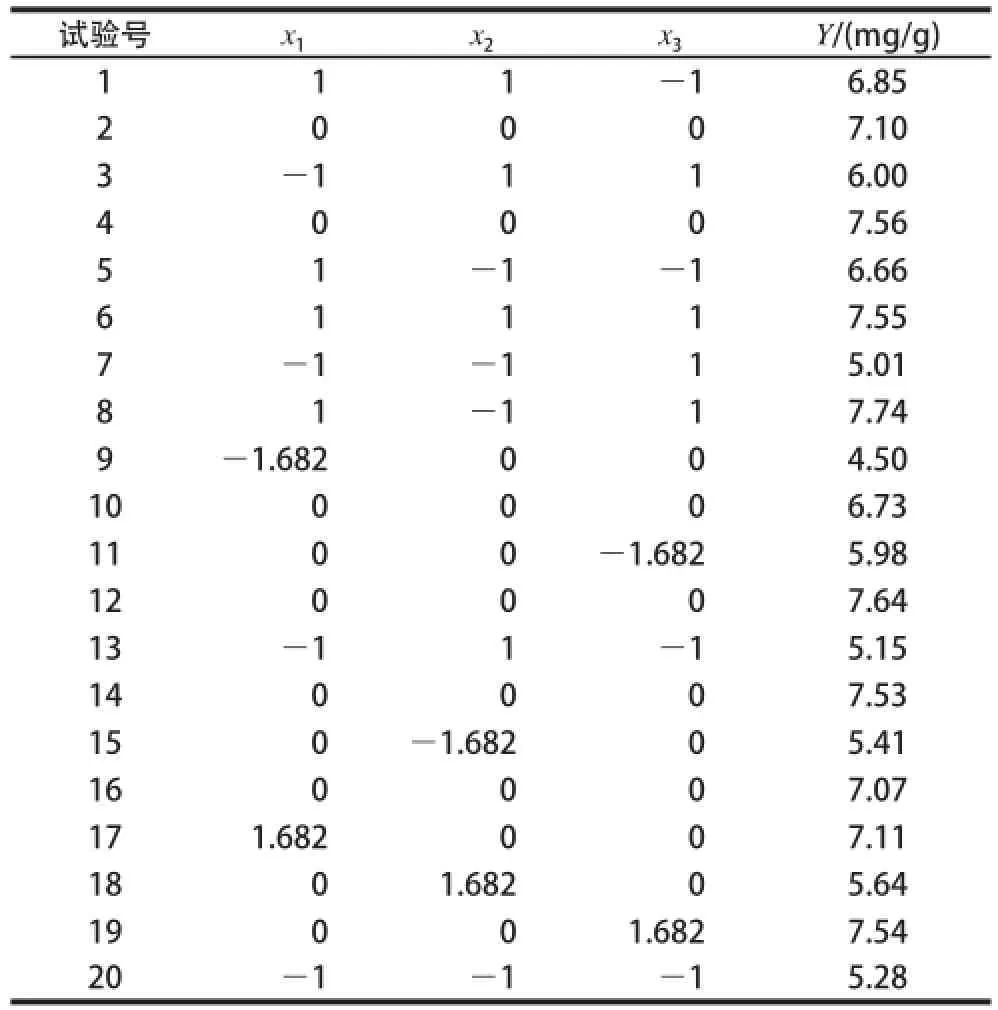
表2 CCD试验方案设计及结果Table2 CCD scheme and results
2.2.3 液固比对甾醇得率的影响
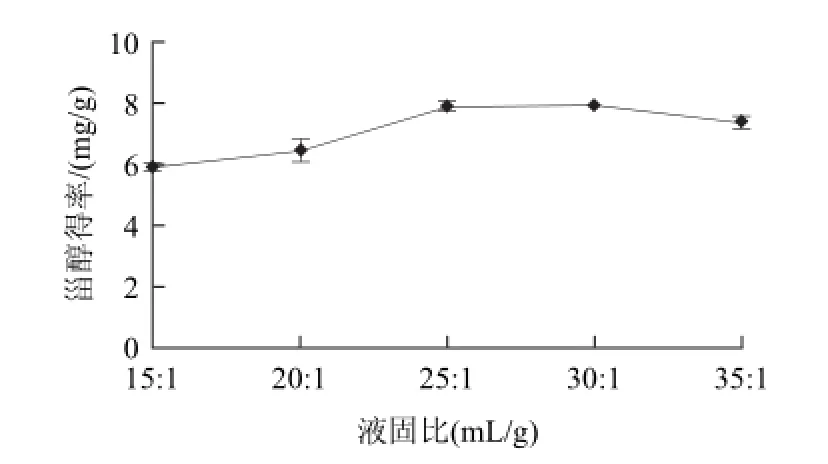
图3 液固比对甾醇得率的影响Fig.3 Effect of solvent-to-solid ratio on the yield of phytosterol
由图3可知,当液固比在15:1~30:1(mL/g)时甾醇得率逐渐增加;液固比在30:1~35:1(mL/g)时甾醇得率趋于平缓。因此选择液固比30:1(mL/g)。
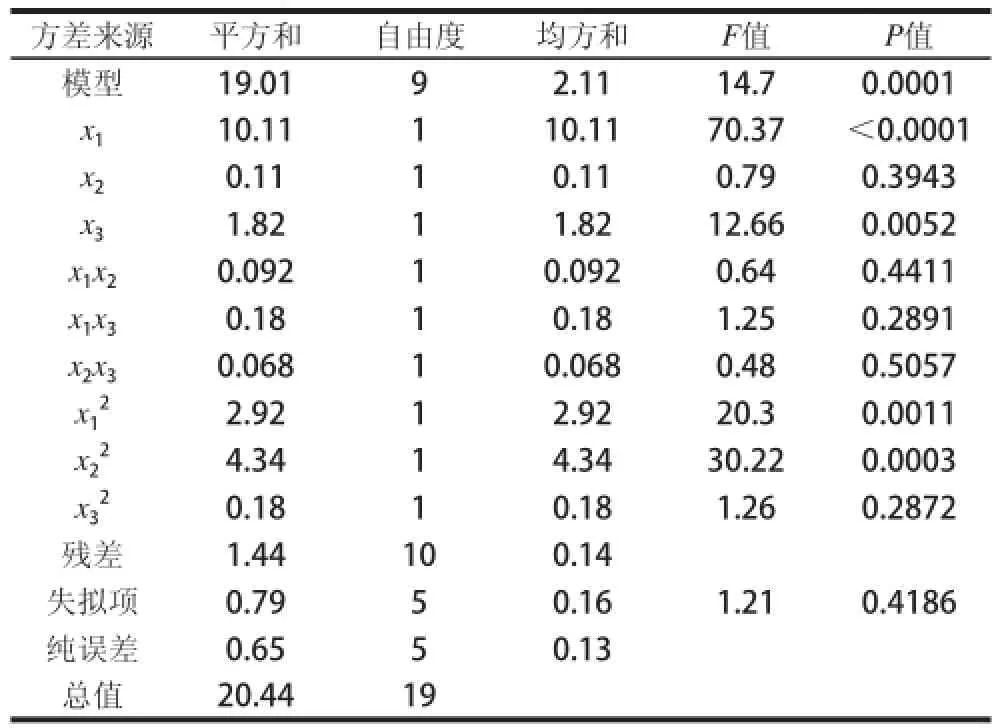
表3 CCD响应面二次模型的方差分析Table3 Analysis of variance for the response surface model
通过响应面分析可以得到桑白皮甾醇微波提取工艺的回归方程为:Y=7.26+0.86x1+0.091x2+0.36x3-
由表3可知,P值为0.0001,决定系数R2=0.9297,说明该回归方程的显著性较好。失拟项P>0.05,说明该回归方程不失拟。可以应用于桑白皮甾醇的微波提取工艺研究。
2.3.2 CCD响应曲面图及其分析

图4 各两因素交互作用对甾醇得率影响的响应面图Fig.4 Response surface graphs showing the interactive effect of three extraction conditions on the yield of phytosterol
对回归方程采用Design Expert 8.0.5软件分析,获得因素交互作用的响应曲面图。由图4可知,最优的微波功率范围应在0~1水平(实际值为385~539W),最优的微波时间范围在-1~1水平(实际值为30~50s),最优的液固比范围应在1~r水平(实际值为35:1~38:1(mL/g))。通过响应面分析,当微波功率为539W、微波时间为41s、液固比为35:1(mL/g)时,甾醇得率预测值为8.08mg/g。
2.4 验证实验
根据2.3.2节的最优工艺参数微波功率539W、微波时间41s、液固比35:1(mL/g),实际测得甾醇得率为(7.74±0.12)mg/g,与理论值(8.08mg/g)相比,相对误差为-4.21%,表明采用响应面法优化的工艺参数是可靠的。2.5 对比实验
采用溶剂法(0.5mol/L KOH-乙醇溶液、液固比35:1(mL/g)、90℃条件水浴)浸提60min,得到甾醇得率为(7.62±0.33)mg/g;采用250W超声提取20min(0.5mol/L KOH-乙醇溶液、液固比35:1(mL/g)),得到甾醇得率为(6.50±0.05)mg/g。
与溶剂法、超声辅助法相比,微波辅助法的甾醇得率分别提高了1.57%、19.07%,采用微波辅助法不仅甾醇得率高,而且提取时间短。
3 结 论
3.1 以微波功率、微波时间、液固比为考察因素,以甾醇得率为试验指标,通过三因素五水平CCD响应面优化试验建立了桑白皮甾醇微波辅助提取的回归方程(R2=0.9297):Y=7.26+0.86x1+0.091x2+0.36x3-0.11x1x2+0.15x1x3+0.093x2x3-0.45x12-0.55x22-0.11x32。
3.2 通过响应面法优化得到桑白皮甾醇微波辅助提取的最佳工艺条件:微波功率539W、微波时间41s、液固比35:1(mL/g),此时甾醇得率为(7.74±0.12)mg/g;实际测定值与理论预测值的相对误差为-4.21%,实际值与理论值基本吻合。
3.3 与溶剂法、超声辅助法相比,微波辅助法的甾醇得率分别提高了1.57%、19.07%,且提取时间大大缩短。因此微波辅助法是桑白皮甾醇提取的较佳方法。
[1] 冯冰虹, 赵宇红, 黄建华. 桑白皮的有效成分筛选及其药理学研究[J]. 中药材, 2004, 27(3): 204-205.
[2] 唐传核. 植物生物活性物质[M]. 北京: 化学工业出版社, 2005: 136-169.
[3] TIKKANEN M J. Plant sterols and stanols[J]. Handbook of Experimental Pharmacology, 2005, 170: 215-230.
[4] 杨振强, 谢文磊, 李海涛, 等. 植物甾醇的开发与应用研究进展[J].粮油加工, 2006(1): 53-56.
[5] SUN S, 翟鹏贵, 彭启辉, 等. 新资源食品原料植物甾醇和植物甾醇酯的安全与应用[J]. 中国卫生监督杂志, 2011, 18(1): 51-55.
[6] 李红娟, 孙居锋, 代现平, 等. 桑白皮总黄酮超声波提取法研究[J].安徽农业科学, 2009, 37(3): 1188-1189.
[7] 张国刚, 黎琼红, 李乐道, 等. 桑白皮中总黄酮提取工艺研究[J]. 中草药, 2005, 36(11): 1662; 1727.
[8] JIA Zhishen, TANG Mengcheng, WU Jianming. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry, 1999, 64(4): 555-559.
[9] 杨文宇. 中药桑枝和桑白皮的品种、品质与药效的研究[D]. 成都:成都中医药大学, 2008.
[10] HESHAM A, BESHBISHY E, ABDEL N B, et al. Hypolipidemic and antioxidant effects of Morus alba L. (Egyptian mulberry) root barkfractions supplementation in cholesterol-fed rats[J]. Life Sciences, 2006, 78(23): 2724-2733.
[11] CHANG L W, JUANG L J, WANG B S, et al. Antioxidant and antityrosinase activity of mulberry (Morus alba L.) twigs and root bark[J]. Food and Chemical Toxicology, 2011, 49(4): 785-790.
[12] DOMINIK K, J☒ZEF K, MAGDALENA R, et al. β-Sitosterol and campesterol stabilisation by natural and synthetic antioxidants during heating[J]. Food Chemistry, 2011, 128(4): 937-942.
[13] MA Songtao, ZHANG Xiaoke, WANG Qiulin. Experimental study on the preventive and treat-ment function of Cortex Mori for peripheral ner-vous lesion at the early stage of diabetes rats[J]. Chinese Journal of Applied Physiology, 2008, 24(2): 201-204.
[14] 周峰. 桑白皮总黄酮的提取及其对糖尿病动物作用的初步研究[D].重庆: 重庆医科大学, 2010.
[15] KIM H J, LEE H J, JEONG S J, et al. Cortex Mori Radicis extract exerts antiasth-matic effects via enhancement of CD4+CD25+Foxp3+regulatory T cells and inhibition of Th2 cytokines in a mouse asthma model[J]. Journal of Ethnopharmacology, 2011, 138(1): 40-46.
[16] PIAO Shujuan, CHEN Lixia, KANG Ning, et al. Simultaneous determination of five charact-eristic stilbene glycosides in root bark of Morus albus L. (Cortex Mori) using high-performance liquid chromatography[J]. Phytochemical Analysis, 2011, 22(3): 230-235.
[17] 胡叶梅, 韩军花, 王素芳, 等. 68种保健食品常用原料植物甾醇含量研究[J]. 中国食品卫生杂志, 2010, 22(6): 486-489.
[18] 胡叶梅. 我国保健食品常用原料植物甾醇分析方法的建立及应用研究[D]. 合肥: 安徽医科大学, 2011.
[19] 胡叶梅, 韩军花, 王素芳, 等. 中药降血脂类有效成分: 植物甾醇的含量及分布研究[J]. 卫生研究, 2011, 40(3): 388-390.
[20] 刘蕾, 陈星, 李晓丽, 等. 分光光度法测定大豆总甾醇含量的研究[J].中国油脂, 2005, 30(4): 45-46.
[21] 李冠楠. 黑木耳多糖的提取及工业技术研究[D]. 长春: 吉林大学, 2011.
Optimization of Microwave-Assisted Extraction of Phytosterol from Mulberry Root Bark by Response Surface Methodology
XU Yan-yang,CAI Sen-sen,SONG Yan-ling,LI Ke-jing
(College of Biological and Agricultural Engineering, Jilin University, Changchun 130022, China)
This study was undertaken to optimize the microwave-assisted extraction of phytosterol from the root bark of mulberry (Morus alba L.) by response surface methodology. The yield of phytosterol was investigated with respect to three variables including microwave output power, irradiation time and solvent-to-solid ratio. As a result, a regression equation was fitted. The optimal conditions for phytosterol extraction were a solvent-to-solid ratio of 35:1 (mL/g) and microwave irradiation for 41 s with an output power of 539 W. The yield of phytosterol under the optimized conditions was (7.74 ± 0.12) mg/g, showing a relative error of -4.21% compared with the predicted value and increases of 1.57% and 19.07% over those obtained by solvent extraction and ultrasonic-assisted extraction. Moreover, the extraction time was considerably shortened by using microwave-assisted extraction in comparison with the other two methods.
mulberry root bark;phytosterol;microwave-assisted extraction;response surface methodology;optimization
TS201.1
A
1002-6630(2013)18-0065-05
10.7506/spkx1002-6630-201318014
2012-09-07
吉林省科技发展计划项目(20120717);吉林大学基本科研业务费项目(450060487500;200903263)
徐艳阳(1972—),女,副教授,博士,研究方向为食品营养与安全。E-mail:xuyy@jlu.edu.cn

