响应曲面法优化叶绿素铜的制备工艺
纪平雄,黎洁玲,曾荣光
(华南农业大学理学院生物材料研究所,广东 广州 510642)
响应曲面法优化叶绿素铜的制备工艺
纪平雄,黎洁玲,曾荣光
(华南农业大学理学院生物材料研究所,广东 广州 510642)
以竹叶为原料提取叶绿素,叶绿素再经过铜代、脱脂等步骤制备油溶性叶绿素铜。对影响产品质量指标的铜代关键工艺过程,在单因素试验的基础上,利用Box-Behnken Design试验设计原理,选择三因素三水平进行铜代工艺条件响应面法分析优化。结果表明:铜代过程最佳条件为加铜量为理论值的2.2倍、反应温度60℃、反应时间75min。在此条件下,油溶性叶绿素铜得率4.051mg/g,检验结果主要指标符合食品添加剂的规定。
竹叶;叶绿素;叶绿素铜;制备工艺;响应面分析
竹子是禾本科(Poaceae)竹亚科(Bambusoidea)多年生常绿植物,对不同环境的适应性很强,生长速度很快。我国竹林资源丰富,占世界竹林面积的25%[1]。竹叶中含有许多具有人体生理生化活性的物质,竹叶提取物有效成分包括叶绿素、胡萝卜素、叶黄素、维生素、黄酮、内酯、多糖、氨基酸、微量元素等,这些物质具有优良的抗自由基、抗氧化、抗衰老、抗疲劳、降血脂、预防心脑血管疾病和保护肝脏[2-3]、扩张毛细血管、疏通微循环、活化大脑、促进记忆、改善睡眠、美化肌肤等功效[4-5]。所以,对竹叶的综合利用研究具有实际意义。
随着科学技术的发展和大众认识水平的提高,长期用作食品添加剂的合成色素被天然色素取代已是大势所趋,开发安全可靠的天然色素对保障人民身体健康具有重要意义。竹叶是易于收集、来源丰富、富含叶绿素的原材料。天然的叶绿素对光和热不稳定,但以铜离子取代其镁离子得到的叶绿素衍生物稳定性大大提高,是目前使用最多的绿色色素,广泛应用于食品、日用和医药等行业。有关水溶性铜代叶绿素的研究报道很多,而油溶性铜代叶绿素却鲜见报道[6]。
本研究以乙醇为溶剂从竹叶提取叶绿素,进一步制备油溶性叶绿素铜,并利用 Box-Behnken Design(BBD)试验设计原理[7],探讨关键步骤的最佳工艺条件组合,旨在为今后竹叶叶绿素成分的实际开发提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
毛竹(Phyllostachys heterocycla cv. Pubescens)叶采集于本校校园内,在室外风干后,剪碎,储存于阴凉干燥处;氯化铜、浓盐酸、石油醚、95%乙醇均为分析纯;其他试剂均为国产分析纯。
UV2550紫外-可见分光光度计 日本岛津公司;JJ300精密电子天平 常熟双杰测试仪器厂;PHS-3C精密pH计 上海雷磁仪器厂;数显恒温水浴锅 江苏省金坛市江南仪器厂;RE-20000旋转蒸发器 上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器有限责任公司。
1.2 方法
1.2.1 叶绿素的提取
称取10g毛竹叶,加体积分数85%的乙醇溶液150mL,在加热温度60℃、搅拌条件下提取3.5h。回收溶剂,得到油状叶绿素[8-9]。叶绿素得率的测定参照文献[10]等方法进行,以紫外-可见分光光度计分别在645nm和663nm波长处测定吸光度,按公式(1)计算叶绿素的含量:

式中:Ca、Cb、Ct分别为叶绿素a、叶绿素b及叶绿素总质量浓度/(mg/L)。
式中:V为提取液体积/mL;m为竹叶质量/g。
1.2.2 叶绿素铜的制备
将油状叶绿素以20倍体积的石油醚溶解,加入5%的CuCl2乙醇液,用体积比1:1的盐酸溶液调节溶液pH值,在恒温水浴锅中加热回流,反应完成后回收溶剂,得到油状叶绿素铜。质量指标检定按凌关庭等[11]的方法进行。叶绿素铜得率测定时则无需回收溶剂,加入质量分数5%的NaOH乙醇溶液,继续加热回流。之后将反应液移入分液漏斗,加等体积蒸馏水分层两次。参照GB 26406—2011《食品添加剂叶绿素铜钠盐》规定方法,水相部分于容量瓶中用磷酸盐缓冲液定容,以磷酸盐缓冲液作参比,测定其吸光度。按公式(3)计算叶绿素铜(以测定的叶绿素铜钠得率表示)的得率[12]:

式中:A405nm为405nm波长处测定的吸光度;568为特殊消光值;m为竹叶质量/g。
1.2.3 叶绿素铜代步骤的单因素试验
考察加铜量(即实际加铜量对理论加铜量的倍数)、反应温度、反应时间、pH值对叶绿素铜得率的影响,因素和水平设置见表1。

表1 单因素试验因素与水平Table1 Variables and levels used in single factor design
1.2.4 叶绿素铜代步骤的响应面试验
通过竹叶制备叶绿素铜的铜代步骤的单因素试验,选取加铜量(A)、反应温度(B)和反应时间(C)设计三因素三水平进行Box-Behnken响应面试验分析优化,以叶绿素铜得率为响应值,确定竹叶制备叶绿素铜的铜代关键步骤的最佳工艺条件。响应面试验因素与水平编码表见表2。试验共设17个试验组,其中12组为析因组,5组为重复的零点组,用作试验误差估计。利用Design Expert 8.0.5软件中的多元线性回归分析程序,拟合二阶多项式方程,建立各试验因素对响应值的函数模型。

表2 响应面试验因素与水平编码表Table2 Variables and levels used in response surface analysis
2 结果与分析
2.1 叶绿素铜代步骤的单因素试验
由于叶绿素铜钠含量测定的准确度和重复性较好,所以以叶绿素铜钠作为衡量竹叶制备油溶性叶绿素铜得率的标准[13]。
2.1.1 加铜量对叶绿素铜得率的影响
在反应温度60℃、反应时间70min、pH2.5条件下进行叶绿素的铜代反应,考察加铜量对叶绿素铜得率的影响,见图1。加铜量为理论值的2.25倍时叶绿素铜得率最高,而1.5倍时最低。加铜量对叶绿素铜得率的影响是随加铜量的增加明显提高,达到最大值后出现下降。这是因为竹叶叶绿素提取液中还含有许多其他组分,这些组分在加铜量太高或太低时对叶绿素的溶解和铜代反应有很大干扰,因此加铜量比一般反应要求的理论值(1.1~1.3倍)高得多,但有一个合适的范围,即2.0~2.3倍。
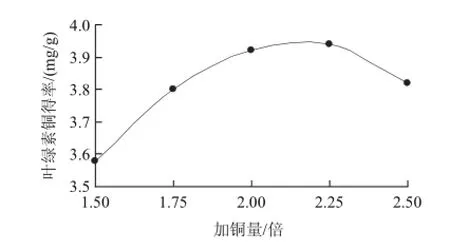
图1 加铜量对叶绿素铜得率的影响Fig.1 Effect of copper dosage on the yield of copper chlorophyllin
2.1.2 反应温度对叶绿素铜得率的影响
取加铜量为理论值的2.2倍、反应时间70min、pH2.5,在不同温度条件下进行叶绿素的铜代反应,考察反应温度对叶绿素铜得率的影响,见图2。叶绿素铜得率开始随着反应温度的升高而提高,50~60℃温度区间的叶绿素铜得率差别较大,说明在这个温度区间内叶绿素铜代反应效率增长较快。而在60~70℃的温度区间内,叶绿素铜得率呈现下降趋势,这可能是由于过高的反应温度导致叶绿素的氧化和分解,从而影响到铜代反应的进程。
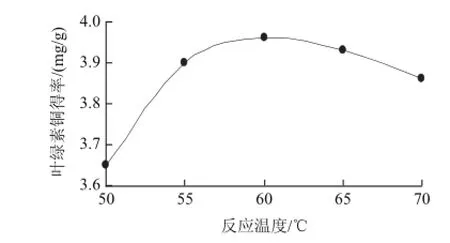
图2 反应温度对叶绿素铜得率的影响Fig.2 Effect of reaction temperature on the yield of copper chlorophyllin
2.1.3 反应时间对叶绿素铜得率的影响
取加铜量为理论值2.2倍、反应温度60℃、pH2.5,在不同时间条件下进行叶绿素的铜代反应,观察反应时间对叶绿素铜得率的影响,见图3。当反应时间为75min时,叶绿素铜得率最高,曲线反映出铜代反应的效率随着反应时间的延长而提高;但当反应时间超过75min时,铜代反应的效率开始下降,但下降的幅度较小,这是因为当铜代反应完成后,生成物继续处于高温环境,会引起生成的叶绿素铜由于受热破坏导致的结构改变。
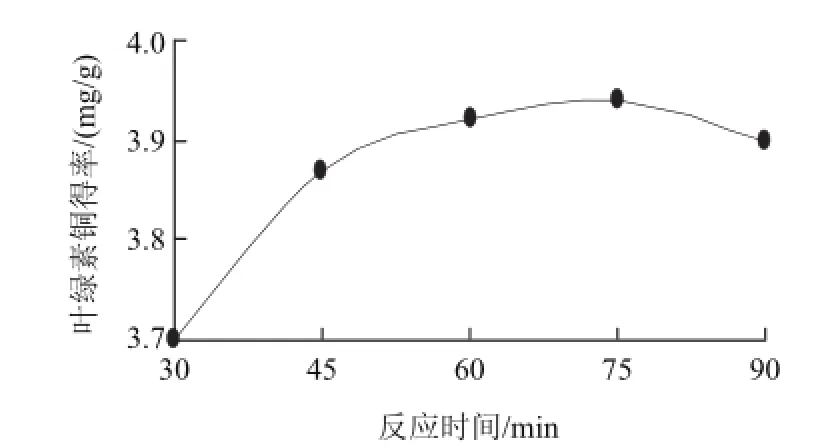
图3 反应时间对叶绿素铜得率的影响Fig.3 Effect of reaction time on the yield of copper chlorophyllin
2.1.4 pH值对叶绿素铜得率的影响
取加铜量为理论值2.2倍、反应温度60℃、反应时间75min,在不同pH值条件下进行叶绿素的铜代反应,观察pH值对叶绿素铜得率的影响,见图4。pH值的控制对铜代率的影响非常显著,这是由于铜代反应是在酸性条件下进行,pH值偏高会使叶绿素脱酯,影响其在石油醚中的溶解从而阻碍铜代反应的进行;在pH值偏低时叶绿素也容易脱镁而不易发生铜代反应。pH2~3是铜代反应必须严格控制的范围,在此pH值范围内才能确保铜代完全。

图4 pH值对叶绿素铜得率的影响Fig.4 Effect of pH on the yield of copper chlorophyllin
2.2 叶绿素铜代步骤的响应面试验
2.2.1 响应曲面试验结果和数据分析
按照响应面设计的因素和水平表,对自变量加铜量(A)、反应温度(B)、反应时间(C)与因变量即响应值叶绿素铜得率(Y)的关系进行响应面试验,设计方案及结果见表3。可看出实测值和预测值数据很接近。
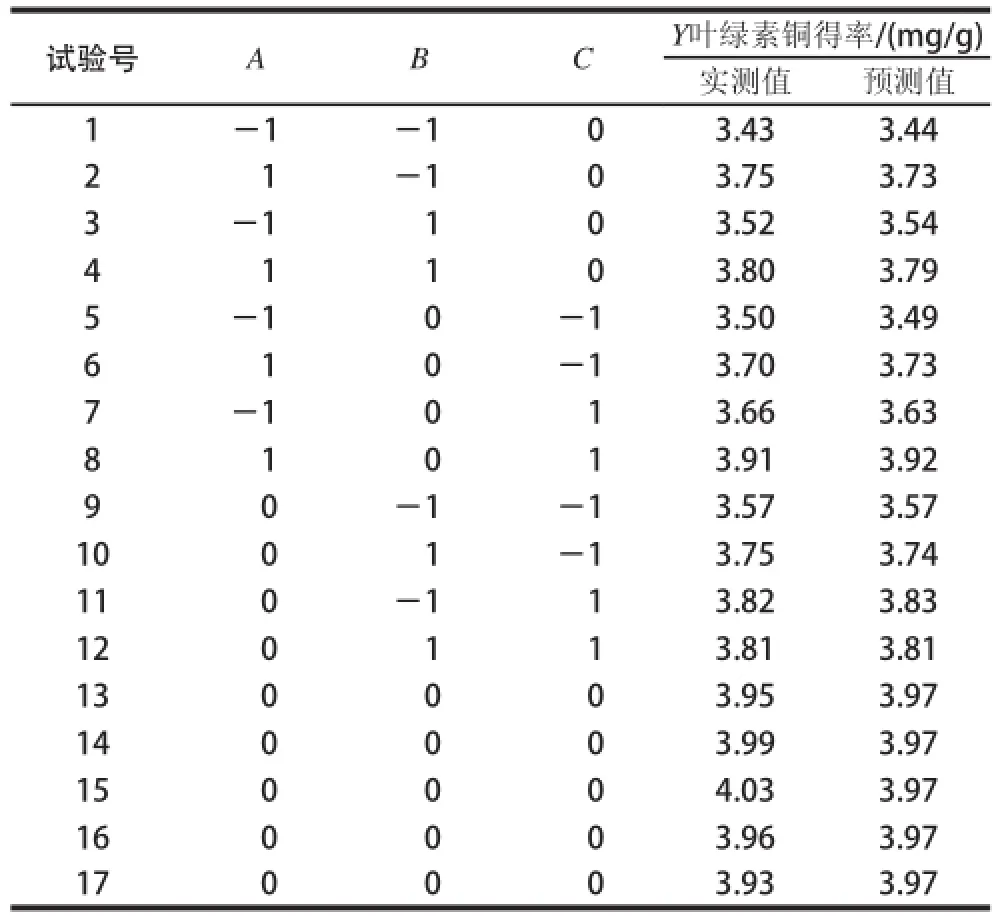
表3 叶绿素铜代工艺优化响应面试验设计及结果Table3 Experimental design and results for response surface analysis
图5是响应面模型实测值和预测值的拟合曲线,可以直观地看出拟合曲线几乎是一条直线,说明模型可以较好地描述各个自变量与因变量之间的相互关系。进一步由软件Design Expert对试验得到的响应值叶绿素铜得率进行回归分析,初步建立起模型的二次回归方程:
Y=-6.57150+3.46850A+0.19858B+0.021800C-2.00000×10-3AB+8.33333×10-4AC-1.58333×10-4BC-0.78400A2-1.51000B2-9.27778×10-5C2
表4是模型的方差分析及相关系数,可观察模型各个变量之间的拟合程度。可见模型F值43.93,P<0.0001,RSN=18.696,表明该模型出现噪音的机会只有0.01%。回归模型的决定系数R2为0.9826,说明98.26%的试验结果可以由这一模型来解释。调整决定系数为0.9606,预测决定系数为0.8832,两者之差在允许范围。由失拟性该项的方差分析可知,F值很小,P值很大,表明该项对模型影响很小,证明模型的拟合结果很好。另外,B、BC(P<0.05)对模型有显著影响,C、C2(P<0.01)有很显著影响,A、A2、B2(P<0.0001)有极显著影响。尽管AB和AC对模型没有显著影响,但模型若没有这两项,会导致模型方差及相关系数的较大变化,失去原有很好的拟合结果,因而初步建立的模型也是最优的模型[14]。

图5 响应曲面模型实测值和预测值的拟合曲线Fig.5 Good agreement between the experimental and model predicted yield of copper chlorophyllin
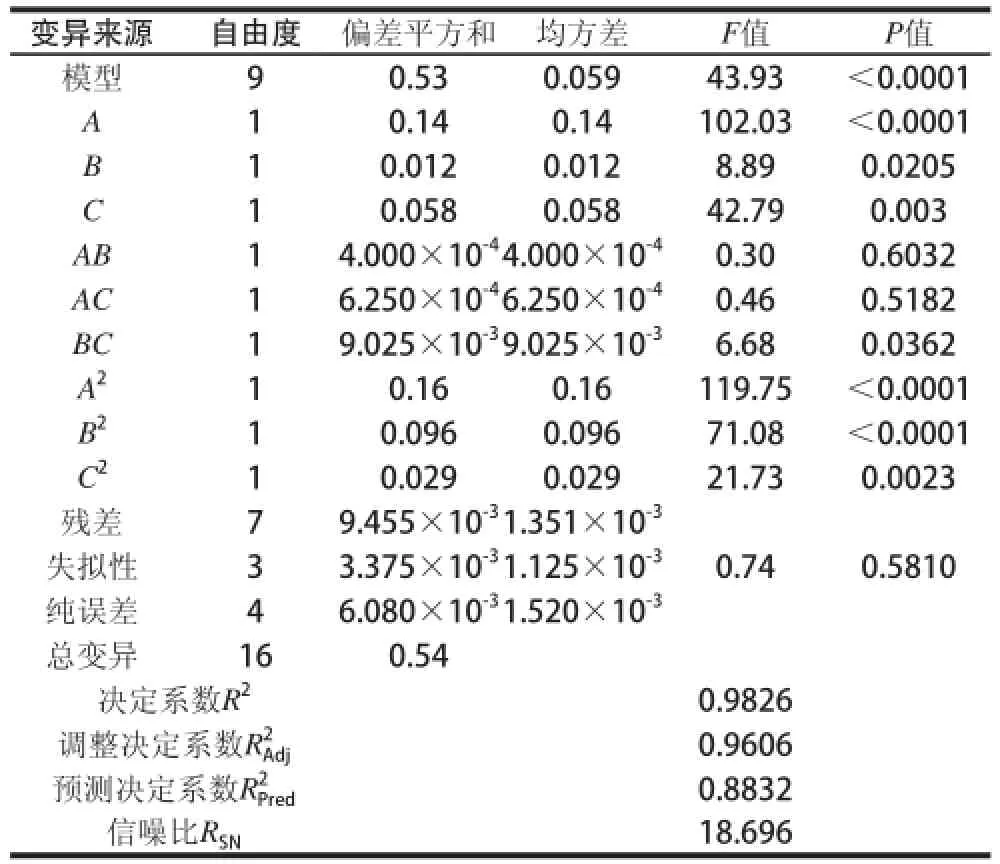
表4 叶绿素铜得率与试验因素关系的回归模型分析Table4 Analysis of variance for the fitted regression model
2.2.2 交互影响因素显著性分析
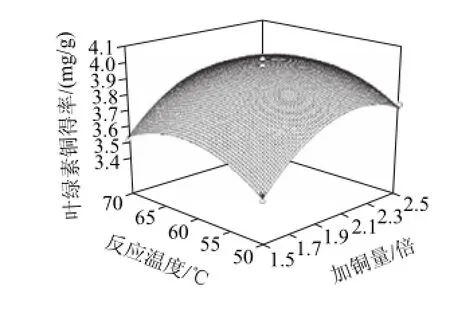
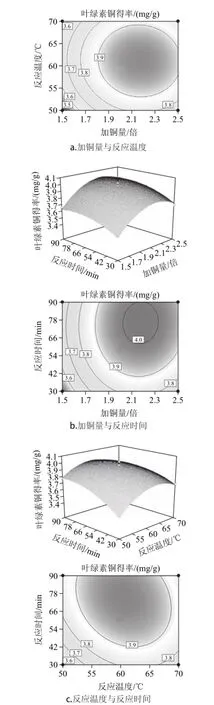
图6 各两因素交互作用对叶绿素铜得率影响的响应面图及等高线图Fig.6 Response surface plots showing the interaction effects of three reaction conditions on the yield of copper chlorophyllin
由图6a可知,当反应时间为60min时,反应温度在60~65℃之间,加铜量在2.15~2.30倍之间对增加叶绿素铜得率最有利。反映温度影响的曲线较平滑,这说明在试验温度范围,叶绿素及其他脂溶性物质溶解性都很好,只有铜离子达到一定浓度才能保证叶绿素铜代反应的完全进行。
由图6b可知,当反应温度为60℃时,延长反应时间,叶绿素铜得率提高,在反应时间为75~85min之间,加铜量为2.15~2.30之间的条件下,叶绿素铜得率最高。这是因为只有达到足够长的反应时间才能克服杂质的干扰,使叶绿素中心镁离子被铜离子取代。
由图6c可知,当加铜量为理论值的2.0倍时,反应温度和反应时间两者对竹叶叶绿素铜得率的交互影响显著,随反应温度的升高和反应时间的延长,叶绿素铜得率不断提高,反应温度60~65℃、反应时间75~85min是最优组合。
2.2.3 验证实验
由回归模型,求得最优工艺条件是实际加铜量为理论加铜量的2.18倍、反应温度60.34℃、反应时间75.75min,竹叶叶绿素铜得率的理论值为4.018mg/g。但这一最佳组合未包括在响应面试验设计组中,需做进一步实验验证。为了方便验证试验条件的控制,改为加铜量2.2倍、反应温度60℃、反应时间75min,由此得到叶绿素铜得率为4.051mg/g。表明在此反应条件下,叶绿素铜得率实测值与预测值相差不大,说明该模型方程与实际情况很好拟合,证明所建模型是正确的,可以肯定响应面法对竹叶叶绿素铜代过程工艺条件进行回归分析和参数优化的结果是可靠的。
2.3 精制油溶性叶绿素铜的质量检测

表5 油溶性叶绿素铜的质量指标及检测结果Table5 Quality indicators of crude and refined copper chlorophyllin
将未脱脂精制的铜代叶绿素进行质量检测,由表5可知,与食品添加剂规定的质量指标相比,检测值中只有消光比一项在规定的范围内,特殊消光值和含量这两项均不合格且相距较大。因此,需要经丙酮进一步脱脂精制,才可能得到合格的产品。进一步脱脂精制后的检测结果表明,脱脂精制处理是关乎叶绿素铜产品质量的重要纯化步骤。经处理后的铜代叶绿素的特殊消光值合格,且含量提高了差不多1倍,这是由于脱脂处理去除了脂溶性杂质使产物纯度提高。另一方面是一些氧化生成的、不能起铜代反应的叶绿素衍生物,由于极性较之叶绿素铜小,不易溶于丙酮而沉淀除去,这些杂质往往对叶绿素铜的消光值有消长作用,导致质量不合格[15-16]。
3 结 论
本实验以竹叶为原料、乙醇为溶剂提取叶绿素,叶绿素再经过铜代、脱脂等步骤制备油溶性叶绿素铜。对影响产品质量指标的铜代关键工艺过程,在单因素试验的基础上,利用Box-Behnken Design试验设计原理,选择三因素三水平进行铜代工艺条件响应面法分析优化,建立了实际加铜量(A)、反应温度(B)和反应时间(C)与油溶性叶绿素铜得率之间的二次多项回归模型:Y=-6.57150+3.46850A+0.19858B+0.021800C-2.00000×10-3A B+8.3 3 3 3 3×1 0-4A C-1.5 8 3 3 3×1 0-4BC-0.78400A2-1.51000B2-9.27778×10-5C2。从模型的方差分析及相关系数数据可证明模型对各个变量之间的拟合结果很好,各因素影响叶绿素铜得率的主次顺序为实际加铜量A>反应温度B>反应时间C,可应用于竹叶叶绿素铜代工艺过程条件控制。通过以模型的响应面对影响油溶性叶绿素铜得率的主要因素及其相互作用进行探讨,优化出竹叶叶绿素铜代工艺过程条件的最佳条件为实际加铜量为理论加铜量2.2倍、反应温度60℃、反应时间75min,叶绿素铜得率为实测值4.051mg/g、预测值4.018mg/g,两者相差不大,进一步证明所建模型是正确的,响应面法对竹叶叶绿素铜代过程工艺条件进行回归分析和参数优化的结果是可靠的[17-20]。此外,叶绿素铜代后得到的只是粗品,需要经过丙酮进一步脱脂精制,才可能得到合格的产品,脱脂精制处理是关乎油溶性叶绿素铜产品质量的重要纯化步骤。
[1] 何跃君, 岳永德. 竹叶提取物的有效成分及其应用研究进展[J]. 生物质化学工程, 2008, 42(3): 31-38.
[2] GOMES B B, BARROS S B M, ANDRADE-WARTHA E R S , et al. Bioavailability of dietary sodium copper chlorophyllin and its effect on antioxidant defence parameters of wistar rats[J]. Journal of the Science of Food and Agriculture, 2009, 89(12): 2003-2010.
[3] BOLOOR K K, KAMAT J P, DEVASAGAYAM T P. Chlorophyllin as a protector of mitochondrial membranes against γ-radiation and photosensitization[J]. Toxicology, 2000, 155(1/3): 63-71.
[4] FERRUZZI M G, BLAKESLEE J. Digestion, absorption, and cancer preventative activity of dietary chlorophyll derivatives[J]. Nutrition Research, 2007, 27(1): 1-12.
[5] SOOK K L. Antimicrobial activity of bamboo (Phyllostachys bambusoides) essential oil[J]. Journal of Food Hygience and Safety, 2000, 15(1): 55-59.
[6] 卢景顺, 吴贻群, 邓素英, 等. 水葫芦叶制取叶绿素铜钠的工艺研究[J]. 现代食品科技, 2006, 22(4): 173-174.
[7] 王立娟, 钱学仁. 竹叶叶绿素铁钠的制备及性质研究[J]. 林产化学与工业, 2005, 25(3): 89-92.
[8] 吕兆林, 李月琪, 秦娇, 等. 毛竹叶挥发油的提取方法[J]. 北京林业大学学报, 2008, 30(4): 135-140.
[9] 纪平雄,薛伟亮,骆玉媚. 竹叶叶绿体色素的分离与鉴定[J]. 广东农业科学, 2011, 38(15): 80-82.
[10] 喻薇, 欧阳宇, 吴泳麟,等. 蚕沙制备糊状叶绿素的工艺研究[J]. 广东化工, 2010, 37(3): 73-75.
[11] 凌关庭, 王亦芸, 唐述潮. 食品添加剂手册: 下册[M]. 北京: 化学工业出版社, 1993: 302.
[12] GB 26406—2011食品添加剂叶绿素铜钠盐[S].
[13] 凌敏, 李培尊, 李利明, 等. 蚕沙叶绿素钴钠盐的制备及其稳定性研究[J]. 食品科技, 2009, 34(8): 221-223.
[14] 张俊杰, 王淑霞, 张广文, 等. 响应面分析法优化米团花黄色素提取工艺研究[J]. 食品工业科技, 2010, 31(6): 259-262.
[15] 喻薇, 纪平雄. 铜氨法生产叶绿素铜钠盐工艺优化[J]. 食品科学, 2012, 33(12): 119-122.
[16] 纪平雄, 区志豪, 蔡英花, 等. 竹叶制备叶绿素铜钠盐的工艺优化研究[J]. 食品工业科技, 2012, 33(22): 323-326.
[17] 魏丽, 单春会. 响应面分析法优化乙醇提取向日葵壳红色素工艺研究[J]. 食品科学, 2010, 31(6): 122-126.
[18] 曾哲灵, 郝纯青, 吕伟, 等. 响应面法优化玫瑰茄红色素提取工艺[J].食品科学, 2010, 31(20): 47-51.
[19] 秦娇, 姚永红, 侯智, 等. 响应面分析法优化毛竹叶挥发油提取工艺[J]. 食品科学, 2010, 31(6): 1-5.
[20] 王淑霞, 李爱梅, 张俊杰, 等. 响应面分析法优化龙眼核中多酚物质提取工艺[J]. 食品科学, 2011, 32(10): 35-39.
Optimization of the Preparation of Oil-Soluble Copper Chlorophyllin from Bamboo Leaves
JI Ping-xiong,LI Jie-ling,ZENG Rong-guang
(Institute of Biomaterial, College of Science, South China Agricultural University, Guangzhou 510642, China)
Chlorophyllin was extracted from bamboo leaves and used to prepare oil-soluble copper chlorophyllin by copper replacement and degreasing. The procedure of copper replacement critical for the quality of copper chlorophyllin was optimized by response surface methodology based on a three-variable, three-level Box-Behnken design. The optimal conditions for copper replacement were established as follows: the amount of copper was 2.2-fold of the theoretical amount and the reaction was allowed to proceed for 75 min at 60 ℃. Under these conditions, the yield of copper chlorophyllin was 4.051 mg/g. The main quality indicators of the final product obtained met the requirements for use as a food additive.
bamboo leaves;chlorophyll;copper chlorophyllin;preparation;response surface methodology
TS201.1
A
1002-6630(2013)18-0087-05
10.7506/spkx1002-6630-201318018
2012-09-19
华南农业大学“211工程”三期重点建设项目(2009B010100001)
纪平雄(1956—),男,副教授,本科,研究方向为应用化学与生物资源利用。E-mail:xiongpj16591@163.com

