不同施氮水平下接种根瘤菌对苜蓿固氮效能及种子生产的影响
马霞,王丽丽,李卫军,宋江平,何媛,罗明*
(1.新疆农业大学农学院,新疆 乌鲁木齐830052;2.新疆农业大学草业与环境学院,新疆 乌鲁木齐830052)
苜蓿(Medicago)以其适应性强、产草量高、富含蛋白质等特点被称作“牧草之王”,同时还具有改土肥田、保持水土、改善生态环境的作用,是西部地区草地建设和荒漠化改造中首选的豆科牧草[1]。近年来随着农业种植结构的调整和西部地区“退耕还草”工程的实施,苜蓿种植面积的扩大,对苜蓿种子的需求量不断增加,采取一定的技术措施提升苜蓿种子的生产水平,建立高产、高效、优质的种子产业体系,是促进苜蓿产业健康可持续发展的关键。研究和生产实践证明,苜蓿接种根瘤菌可以促进苜蓿早结瘤、多结瘤和增加固氮量,是提高苜蓿产量和品质的重要措施[2,3]。研究表明,根瘤菌—苜蓿形成的高效共生体系能固定90~386kg/hm2的纯氮,可提供其生长期所需46%~92%的氮素[4]。美国约80%的苜蓿在播种前进行根瘤菌接种,在加拿大、澳大利亚等国家该技术也已被普遍接受[5,6]。
根瘤菌与苜蓿的共生固氮作用是一个非常复杂的相互作用过程。根瘤菌的固氮效率受根瘤菌基因组、宿主基因组和土壤环境因子等多方面因素的影响,其中土壤化合态氮素含量是严重影响结瘤和固氮功能的重要因子[7]。因此,在苜蓿种子生产中如何充分发挥根瘤菌的共生固氮作用,避免氮肥施用的盲目性,是一个尚待解决的科学问题。本研究利用15N自然丰度法测定不同施氮水平下接种根瘤菌对苜蓿的固氮效能、苜蓿生长和种子产量的影响,探明能充分发挥根瘤菌固氮作用,经济有效地施用氮肥量,为建立苜蓿种子高产、优质、高效的生产体系提供科学基础和技术支撑。
1 材料与方法
1.1 试验区概况
试验地设在呼图壁种牛场新疆农业大学草地生态试验站。试验站海拔446m,年平均温度7.5℃,年最高温度39.4℃,年最低温度-32.1℃,生长季平均温度17.9℃,无霜期178d,冬季有积雪,平均降水量150mm,年蒸发量2 300mm,潜水埋深平均1.8m。试验区为耕种多年的农田,有灌溉条件,土壤为轻度盐泽化的灰钙土。
1.2 试验材料
1.2.1 供试根瘤菌菌种 根瘤菌为苜蓿中华根瘤菌(Sinorhizobiummeliloti)ACCC17544,分离自新疆紫花苜蓿(M.sativa),由中国农业微生物菌种保藏管理中心提供。
1.2.2 供试苜蓿品种 新牧一号紫花苜蓿,由新疆农业大学草业与环境科学学院提供。
1.2.3 培养基及营养液 根瘤菌培养采用甘露醇酵母汁培养基(YMA)(g/L)[8]:甘露醇 10.0,NaC1 0.1,Mg2SO4·7H2O 0.2,酵母粉1.0,K2HPO40.5,蒸馏水1 000mL,pH 值7.0~7.2。
苜蓿沙培采用无氮营养液(g/L)[9]:KH2PO40.14,MgSO40.49,H3BO30.001,MnCl20.001,ZnSO40.001,CuSO40.000 1,钼酸钠0.001,Na2Fe EDTA 0.02。
1.3 试验方法
1.3.1 试验设计 2009-2010年设置采用田间小区试验。试验采用4×3二因素设计。因素一为:不同施氮水平。尿素施用量分别为:0(N0)kg/hm2、50(N50)kg/hm2、100(N100)kg/hm2、150(N150)kg/hm2;因素二为:根瘤菌接种处理,设秋播拌种、春季追施接种2个处理,同时设不接种为对照。共计12个处理,每个处理3次重复,共36个小区。小区面积3m×3m,随机区组排列。三料过磷酸钙(有效P2O5含量43%,300kg/hm2)作为基肥一次性施入。尿素分别在第2年苜蓿返青的苗期(1/3总施肥量)、现蕾期(1/3总施肥量)、花期(1/3总施肥量)以追肥施入,施肥后浇水。常规田间管理,适时浇水、除草、防病虫害,及时清除菟丝子。
1.3.2 根瘤菌接种液制备 接种液制备:活化根瘤菌菌种,接种至YMA液体培养基中,120r/min,30℃,摇瓶培养至菌液OD600值为0.5~0.8,备用。
1.3.3 接种与播种 采用2种方式接种:1)拌种:将苜蓿种子在菌液中浸泡15min后立即播种。2)沟施:于第2年苜蓿返青时在幼苗根部开沟追施根瘤菌液。均以无菌液体培养基拌种为对照。根瘤菌液浓度为2.14×108个/mL,苜蓿播种量为3kg/hm2,条播。
1.3.4 参比植物 在苜蓿田间小区试验行间种植黑麦草(Loliumperenne)作为不固氮对照植物[10]。
1.3.5 苜蓿沙培试验 通过沙培试验测定在外源氮素100% 源于大气的条件下苜蓿植株15N同位素丰度。将河沙反复清洗、干燥后定量装入营养钵内。种子经表面消毒后催芽。选取发芽均匀一致的种子,用根瘤菌液浸种15min后播种于装有河沙的营养钵中。苜蓿生长期间定期定量浇无氮营养液。同时以无菌YMA培养液浸种的处理作对照。
1.3.6 测定项目 苜蓿生长性状和种子产量:分别在苜蓿返青期、幼苗期、分枝期、成熟期从各处理小区用修枝剪随机采集20株地上部分植株,105℃杀青2h,65℃烘干4h至恒重,称量干重。当3/4的荚果变为黑褐色时人工收获,每个样方人工收获1m2植株,统计各处理植株有效分枝数、荚果数,干燥后脱荚、种子清选,称重获得小区净种子产量。
根瘤菌结瘤数、根瘤重量:分别在苜蓿返青期、幼苗期、分枝期从各处理小区随机取10株,每株按长×宽×深(30cm×30cm×30cm)挖取苜蓿根系。将苜蓿根系放在网筛上冲洗,将泥沙洗净后取出根瘤,用吸水纸吸干表面水分,计数有效根瘤数、称重根瘤鲜重。
苜蓿植株的生物固氮量:采用15N自然丰度法测定[11,12]。植株收获后,65℃烘干、粉碎。茎叶15N%用精密同位素质谱仪测定(测量精度为0.01‰),全氮用凯氏定氮法测定[13]。计算不同处理的根瘤菌固氮百分率、固氮量[14]。根瘤菌固氮百分率(Ndfa%)即苜蓿生物固氮量占其全部同化氮素量的百分比,通过下式计算:

式中,δ15Ns为非固氮参照植物(与苜蓿生长在同一试验小区的黑麦草)的15N 丰度,δ15Nf为试验小区苜蓿的15N丰度,δ15Na为生长于无氮培养基质上的苜蓿15N丰度。根瘤菌固氮量用下式计算:

式中,Ndfa为单位面积苜蓿的生物固氮量(kg/hm2),Ndfa%为苜蓿生物固氮所占比例,Mlb为单位面积苜蓿生物量(kg/hm2),Cnc为苜蓿植株全氮含量(kg/kg)。
1.3.7 数据统计分析 采用Excel 2003和DPS 7.05软件对试验数据进行统计分析。
2 结果与分析
2.1 不同处理对苜蓿结瘤数和根瘤重的影响
在苜蓿上接种根瘤菌能增加苜蓿单株根瘤数量和根瘤重量(图1和2)。与不接种处理相比,单株根瘤数平均增加(31.1±0.165)%,单株根瘤重平均增加(45.4±0.248)%。其中接种根瘤菌在低施氮(N50)水平下表现尤为突出,与不接种处理差异极显著(P<0.01),显著高于不施氮、N100和N150的施氮处理。超过N50的施氮量,随着施氮量的增加,单株根瘤数和根瘤重则呈现出下降的趋势,与不施氮处理无显著差异。试验结果表明,适量施用低浓度的氮肥可以提高苜蓿的根瘤数及重量,明显改善苜蓿的结瘤状况,但过多的氮肥则会抑制根瘤菌结瘤。同时,试验结果表明,接种方式对根瘤菌的侵染结瘤产生一定影响。秋播拌种有利于增加根瘤重量,春播追施更利于增加根瘤数量。
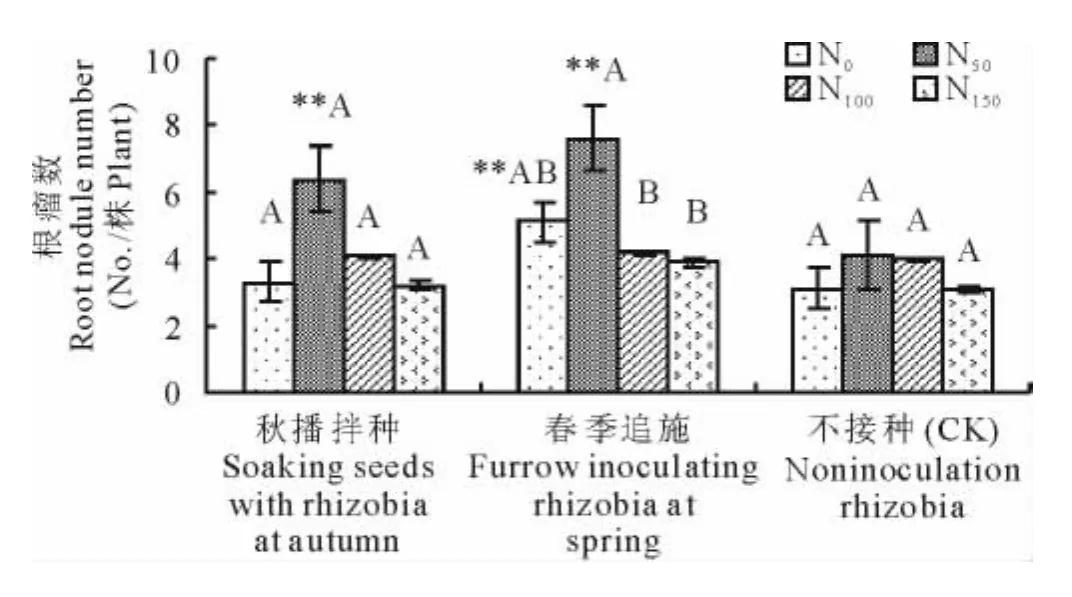
图1 不同处理下苜蓿的根瘤数Fig.1 The nodule number of alfalfa under different treatments
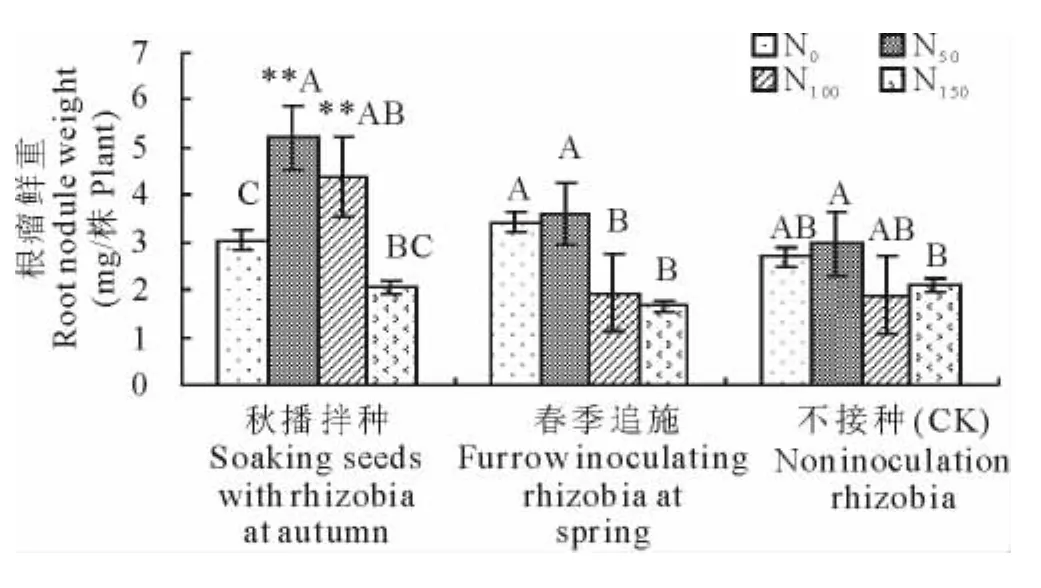
图2 不同处理下苜蓿根瘤鲜重Fig.2 The nodule fresh weight of alfalfa under different treatments
2.2 不同处理对苜蓿生物固氮率、固氮量的影响
不同处理苜蓿固氮率、固氮量的结果表明(图3和4),在不施氮肥(N0)和施用少量氮肥(N50)条件下,人工接种根瘤菌较不接种能显著提高苜蓿的生物固氮百分率和固氮量,固氮率平均提高了(91.1±0.032)%和(17.3±0.004)%,固氮量平均提高了(110.9±0.218)% 和(71.6±0.120)%。且在低施氮水平下(N50)接种根瘤菌苜蓿固氮率、固氮量都达到最高;而施用更多的氮肥,则引起苜蓿固氮率、固氮量降低。当施氮量达N150时,固氮量降低幅度最大,春季追施和秋播拌种较N50处理分别降低了52.6%和60.5%。在不接种条件下,施氮量N100苜蓿固氮率、固氮量最高,表明接种高效固氮菌较土著菌株可以提高生物固氮能力,替代部分氮肥,减少化肥的施用量。
比较2种接种方式,以秋播拌种根瘤菌结合N50低施氮量处理的苜蓿固氮率、固氮量最高,分别达到了(77.8±0.508)% 和(452.51±2.568)kg/hm2,比返青追施根瘤菌结合施用低氮和不接种的对照分别增加了15.1% 和83.6%。说明对苜蓿接种根瘤菌,采用秋播拌种方式并结合施用一定量的外源氮肥,可以增强其生物固氮的性能,显著提高固氮量。
2.3 不同处理对苜蓿生长性状及种子产量的影响
总体而言,通过秋播拌种和春季返青追施方式接种根瘤菌都能有效促进苜蓿生长(表1),在不同施氮水平下其有效分枝数、单株荚果数、地上部生物量较不接种对照分别增加了2.3%~48.7%[平均(30.1±8.126)%]、6.7%~47.0% [平均(25.1±5.254)%]和1.2%~51.7% [平均(17.0±5.597)%]。其中接种根瘤菌苜蓿的分枝数、荚果数在不施氮(N0)和低施氮量(N50)下及地上干物质重在N100施氮量下与不接种处理差异达极显著(P<0.01)。在不同施氮量下,接种和未接种处理苜蓿植株的地上部生物量都表现出随着施氮量的增加而增长,在N100水平达到最大值(接种处理不施氮和其他施氮处理差异显著,未接种各处理间差异未达显著水平),而超过N100施氮量,根瘤菌促进苜蓿植株生长的效应明显降低,地上部生物量随施氮量增加而下降,有效分枝数的变化也呈现出相似的变化趋势。而单株荚果数的变化则呈现出接种苜蓿在N50施氮量下达到最大值,未接种苜蓿在N100时达到最大值,之后均随施氮量增加而下降的变化特点。
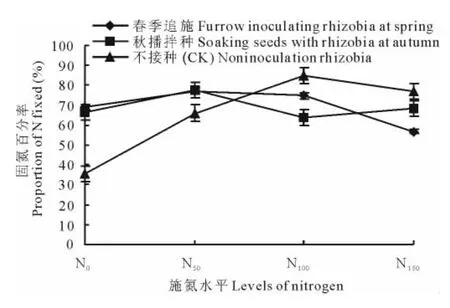
图3 不同处理下苜蓿固氮百分率Fig.3 The proportion of N fixed by alfalfa under different treatments
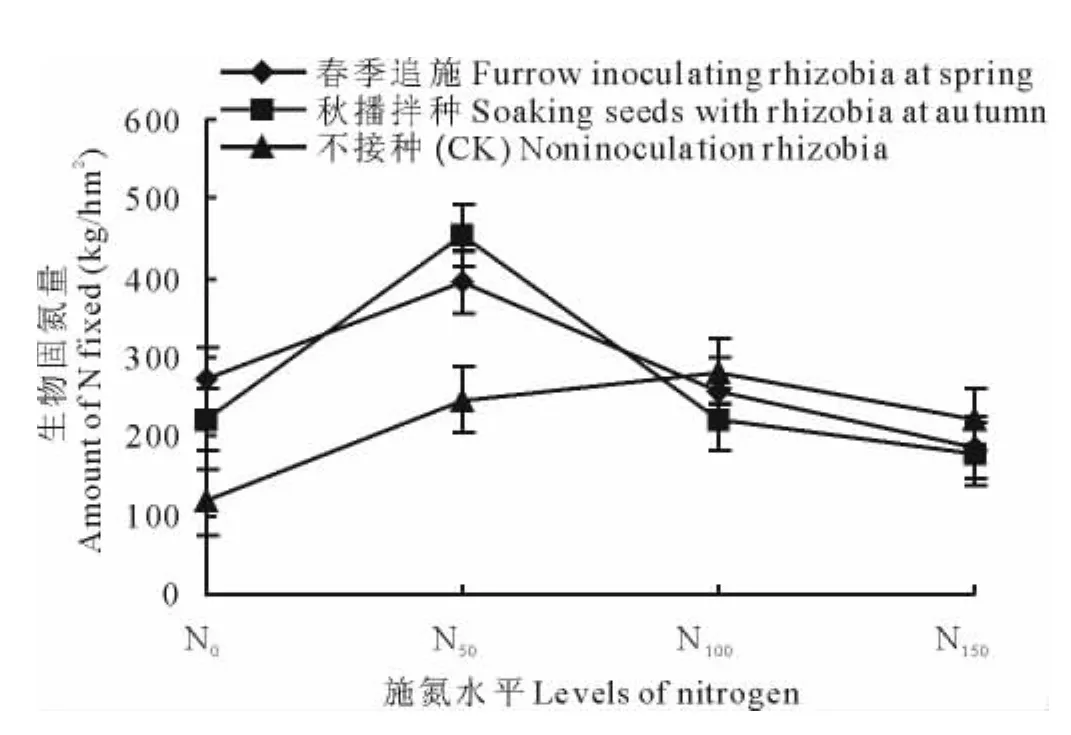
图4 不同处理下苜蓿生物固氮量Fig.4 The amount of N fixed by alfalfa under different treatments
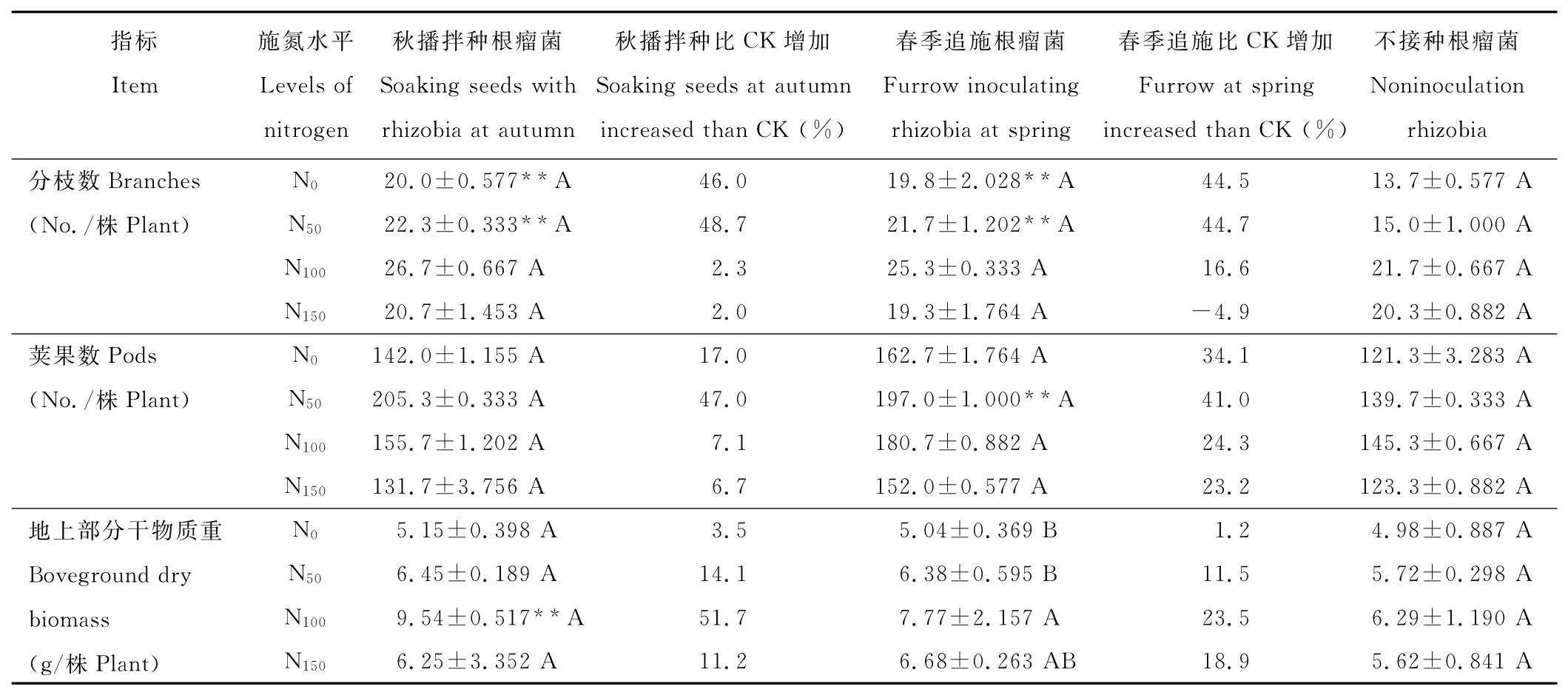
表1 不同处理下苜蓿的生长性状Table 1 The growth characteristics of alfalfa under different treatments
接种根瘤菌能显著提高苜蓿种子产量(图5)。在施氮肥量N50~N150时苜蓿种子均有不同幅度的增加,较其他处理产量增幅平均达(59.7±0.118)%。其中秋播拌种根瘤菌以施氮量N50时的增产最为显著,产量达到了557kg/hm2,与不施氮肥处理差异极显著(P<0.01),而施氮量为N100和N150的处理种子产量无显著差异。春季追施根瘤菌,以施氮量N100种子增产幅度最为显著,产量为452kg/hm2。说明根瘤菌的接种时期、接种方法对苜蓿的接种效果不同,以秋播拌种效果较佳。
试验结果表明,接种根瘤菌结合施用适量氮肥有利于根瘤菌与苜蓿共生关系的建立和固氮效能的发挥,改善植株的氮素营养,进而促进苜蓿的营养生长,提高其分枝数,促进干物质积累和向荚果中的分配。但施氮量过高则抑制了根瘤固氮功能的发挥,影响苜蓿生长,造成生物量减少和向荚果中的分配率降低,使增产幅度降低。
2.4 苜蓿生物固氮百分率、固氮量与种子产量的相关性
在不同施氮量下接种根瘤菌,其中秋播拌种接种处理的生物固氮率、固氮量与苜蓿种子产量均呈正相关关系(图6和7),相关性分别达显著(P<0.05)和极显著水平(P<0.01);而春季追施接种处理生物固氮率、固氮量则与种子产量未表现出显著的线性相关性。
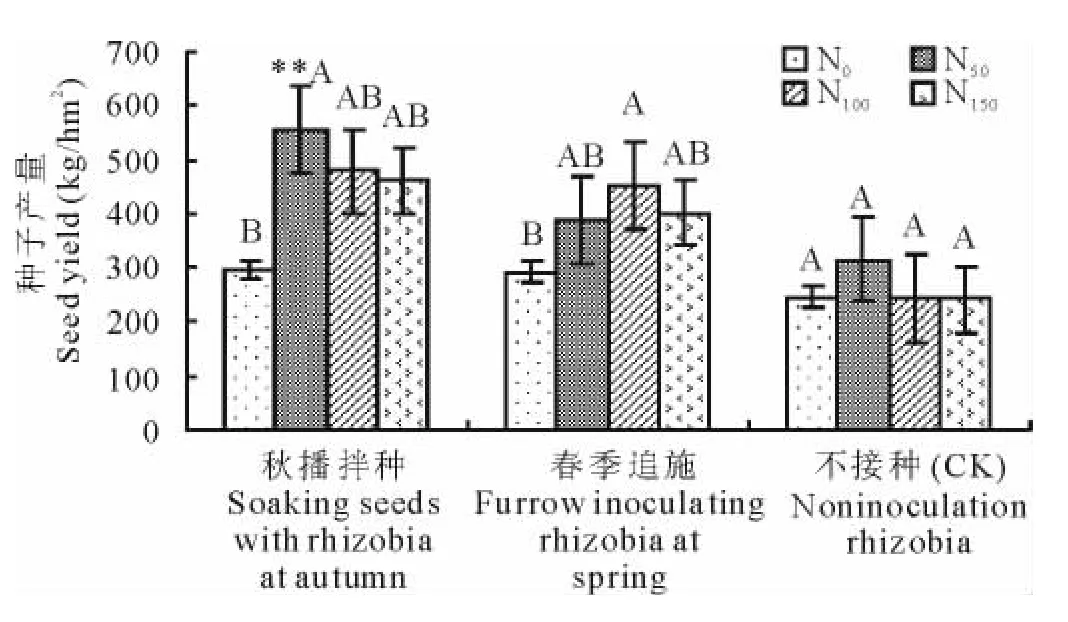
图5 不同处理下苜蓿的种子产量Fig.5 The seed yield of alfalfa under different treatments
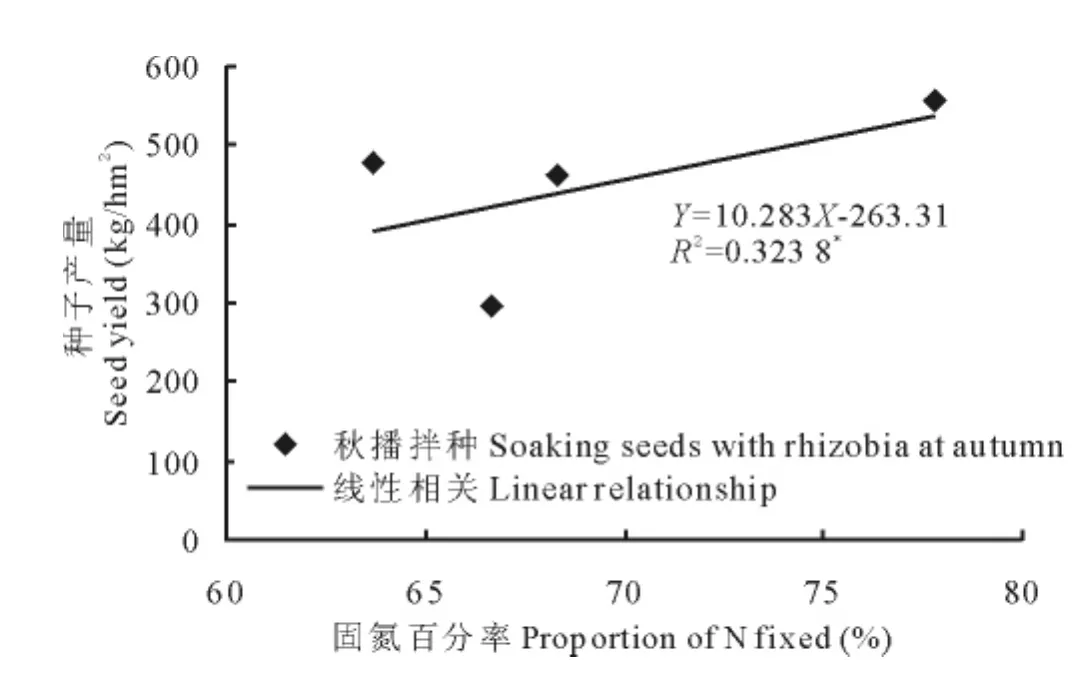
图6 接种根瘤菌苜蓿生物固氮百分率与种子产量的相关性Fig.6 The relationship between proportion of N fixed and seed yeild of alfalfa inoculated with rhizobia
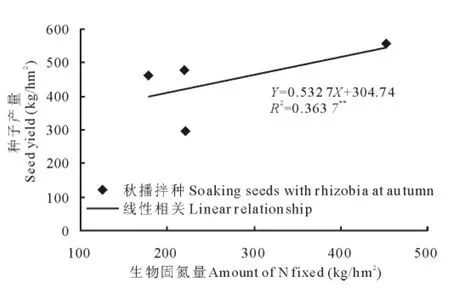
图7 接种根瘤菌苜蓿生物固氮量与种子产量的相关性Fig.7 The relationship between amount of N fixed and seed yeild of alfalfa inoculated with rhizobia
3 讨论
3.1 施用氮肥对苜蓿根瘤菌固氮能力的影响
根瘤菌与豆科植物结瘤形成共生体是自然界中最为高效的固氮体系,土壤环境中的生物和非生物因素均能不同程度地影响接种根瘤菌的结瘤和共生固氮效率。研究发现,由于能源方面的原因,植物根瘤优先吸收环境中的化合态氮,土壤中化合态氮素含量是影响根瘤菌固氮效应的重要环境因子,氮肥施用不合理会阻碍根瘤的形成和降低根瘤的固氮活性[15]。一方面在幼苗期,根瘤菌尚未与植物建立起共生固氮关系,植物生长所需氮素主要从土壤中获取。施用少量氮肥可以氮换碳,以氮促碳,加强植株的光合作用,促进根系生长,为根瘤菌感染和结瘤创造较好条件,起到“起爆氮”的效应[16,17]。另一方面,土壤中有效态氮供应增加,能影响根瘤菌对根毛的侵染,降低结瘤数量,抑制类菌体的固氮酶活性,从而对固氮效率表现出明显的抑制作用,导致固氮量减少,即产生了“氮阻遏”效应[18]。研究表明随着施氮水平的增加,宿主植物干物质重和叶面积增加,但可减少根系的发展,根瘤的数量和生长显著受到抑制[19,20]。浅召兴一郎研究发现在200mg/L化合态氮浓度下,籽实百粒重和产量虽然仍有少量增加,但产量及其组成受氮肥的影响已不显著[7]。姚允寅等[21]研究表明,合理施入低水平的化合态氮肥能提高苜蓿固氮能力,延长固氮高峰的持续时间,特别是对初建或低供氮能力的草场,施入化合态氮肥尤为重要。Gan等[22]研究发现以25kg/hm2氮肥作种肥,大豆(Glycinemax)的固氮比例最高,84%生物量氮来自生物固氮,而花期施用50kg/hm2追肥则使结瘤状况和固氮数量下降,可见氮肥对根瘤固氮能力的影响较为复杂,氮肥施用量、氮肥类型、施用时期和方式等都会影响到根瘤菌的固氮效能[23]。
本试验结果表明,不同施氮水平下接种根瘤菌对苜蓿固氮效能、苜蓿生长和种子产量的影响有明显差异。在N50的施氮量下,接种根瘤菌能显著增加苜蓿单株根瘤数量和根瘤重量,苜蓿固氮率、固氮量都达到最高,有利于菌株的结瘤和固氮,进而改善植株的氮素营养,促进苜蓿生长,提高了上部干物质积累和有效分配,增加有效分枝数、荚果数等产量构成因子,最终达到显著的增产效果。而超过N100施氮量,会抑制根瘤菌结瘤,引起苜蓿固氮率、固氮量降低,根瘤菌促进苜蓿植株生长的效应明显降低,造成生物量减少和向荚果中的分配率降低,种子增产幅度下降。但本试验条件下的N50施氮量是否为最佳施氮量?肥料肥效的发挥受环境条件的影响很大,该施氮量是否还受到试验地土壤肥力条件的影响?以及施氮肥的最佳时期,根瘤菌侵染结瘤适宜的环境氮素水平是否因菌株和苜蓿品种不同而异等问题都还有待进一步研究。针对不同土壤类别和不同气候条件,找出适合当地条件的最佳施肥配比、施肥量、施肥时期和施肥方式等,对因地制宜指导苜蓿生产有重要的理论和实践意义。
3.2 接种方式对苜蓿根瘤菌固氮的影响
在土壤中接种高效根瘤菌株,建立起有效的寄主—根瘤菌共生体系是充分发挥根瘤菌固氮潜能的前提条件。接种菌株与宿主形成根瘤是两者相互作用的一系列复杂过程,由根瘤菌与宿主植物的遗传因素及生态因素两方面决定。其中接种根瘤菌的方式影响根瘤菌在土壤中的定殖、侵染及结瘤的效率,一直是根瘤菌应用过程中的一个关键环节。前人对根瘤菌的接种方式讨论较多,但尚无定论。Maria和Silvina[24]认为种下接种根瘤菌结瘤率最高。唐颖等[25]的研究显示,采用根瘤菌液体菌剂拌种与颗粒菌肥作种肥施用导致大豆结瘤部位不同,液体菌剂拌种根瘤多集中于根上层,施用颗粒菌肥根瘤多集中于根下层;施用颗粒菌肥在大豆生长后期根瘤数量及干重均表现出明显的优势,大豆产量高于液体菌剂拌种处理。张红侠等[26]在黄淮海地区和黄土高原地区试验了喷施、拌种和种下接种根瘤菌对大豆生长及产量的影响。结果表明,黄土高原喷施接种辽宁慢生根瘤菌(B.liaoningense)4345在大豆植株干重、植株全氮量、结瘤率和产量等方面均显著高于另2个处理和对照,而费氏中华根瘤菌(S.fredii)4338拌种和喷施较好。而在黄淮海地区拌种更适用于对慢生性大豆根瘤菌(B.japonicum)4302和费氏中华根瘤菌4822菌株的接种。本研究在制种苜蓿小区试验中采用根瘤菌菌液对秋播苜蓿拌种和苜蓿春季返青开沟追施2种方法接种,试验结果表明,2种接种方式都有利于增加根瘤重量,增强生物固氮性能,提高固氮量,显著提高苜蓿种子产量。但比较而言,秋播拌种结合N50低施氮量处理的效果更加显著。究其原因可能是秋播拌种形成的根瘤在当年秋季即开始固氮,有效促进了苜蓿前期的营养生长和干物质的积累,幼苗生长健壮,同时也为来年返青新生根生长及根瘤的形成、膨大提供了物质基础,因而固氮效率增强,有利于提高产量。而在春季苜蓿返青时开沟追施根瘤菌可能由于土著根瘤菌优先占据的生态位影响到接种菌的占瘤率,进而影响其固氮效能的发挥,但此推测还有待标记基因技术研究证实。此外,本研究也发现拌种法接种简便易行,易于推广,是多年来广泛采用的方法,但此法也有其缺点,仅适用于新播种苜蓿,不适用于老种植区[27]。本试验探讨采用春季开沟追施根瘤菌,具有较好的接种效果,对拌种效果不理想或老种植区补施根瘤菌提供了又一途径,值得进一步研究。
3.3 15 N天然丰度法估测苜蓿根瘤菌的固氮性能
目前对于固氮植物固氮能力和固氮量估算的方法主要有差值法、乙炔还原法、15N同位素稀释法和15N天然丰度法等[28]。15N天然丰度法即确定用大气中15N丰度作为15N的标准自然丰度,应用固氮植物和非固氮植物利用有效氮源的不同而形成的植物15N丰度的差异来测定生物固氮量。该法不需向待测作物生长的土壤中施入昂贵的15N肥料,也不破坏作物生长的正常生态环境,通过测定待测植株样品15N含量即可估算固氮能力[29,30],特别是在原位条件下研究多年生草本植物和木本植物的固氮量具有其独特的优点。15N天然丰度法对非固氮参比植物的选择尤为关键,否则会对生物固氮量的估算产生大的偏差。杜丽娟等[10]以扁穗雀麦(Bromuscatharticus)、燕麦(Avenasativa)、黑麦草和法拉斯草等非共生固氮禾本科植物作为参比植物,通过测定紫云英(Astragalus sinicus)、圆苜蓿和紫花苜蓿等越冬草本豆科植物固氮百分率的结果来评定所选参比植物的合理性。试验测算出紫云英、圆苜蓿和紫花苜蓿的固氮百分率分别为(78.0±1.8)%、(183.5±5.3)%和(65.3±1.4)%,结果显示用所选的4种参比植物测得的圆苜蓿固氮百分率极不合理,而作为紫云英、紫花苜蓿的参比植物所测固氮百分率合理,表明它们吸收土壤氮的比例相似,是适合的参比植物。姚允寅等[14]以牛尾草(Rabdosiaternifolia)和鸭茅(Dactylisglomerata)作参比植物估算7个不同品种苜蓿在不同生长时期的固氮率,发现用鸭茅做参比植物所得数据不合理,而牛尾草做参比植物所得数据较好,与15N稀释法的估测值无明显差异。本研究在应用15N天然丰度法估测评价不同处理下苜蓿根瘤菌固氮能力的试验中是以与紫花苜蓿生长在同一试验小区的多年生黑麦草作为参比植物,二者生长在具有同样δ15N丰度的土壤中。经测定计算苜蓿地上部分固氮百分率为35.5%~84.6%,此试验数据是合理的,且与前人的测定结果相似[31],进一步证明了黑麦草吸收土壤氮源δ15N与紫花苜蓿相近,选用黑麦草作为参比植物估测苜蓿根瘤菌的固氮性能是科学可行的。
豆科植物地下部分固N量也不容忽视。有试验[32]测定华中红壤丘陵地区蚕豆(Viciafaba)、紫云英、苏箭3号、紫花苜蓿等几种冬季绿肥作物地下部固定的N量占总固N量的比例为11.4%~45.3%。紫花苜蓿与禾草混播,地上部分全年固N量为40~118kg/hm2,如果包括根的固N量,则为52~153kg/hm2。因苜蓿根系发达,入土很深,取其完整的根系较为困难,本试验只测定了地上部分的生物固N百分率和固N量,如果包括根部固氮,苜蓿的固N能力可能略高。
[1] 曹宏,章会玲,盖琼辉.22个紫花苜蓿品种的引种试验和生产性能综合评价[J].草业学报,2011,20(6):219-229.
[2] 黄新,王亚琴,刘建新,等.接种根瘤菌对不同紫花苜蓿品种结瘤和生物学产量的影响[J].浙江农业学报,2005,(6):391-394.
[3] 宁国赞,刘惠琴,马晓彤.中国苜蓿根瘤菌大面积应用研究现状及展望[A].首届中国苜蓿发展大会论文集[C].北京:中国草原学会,2001.
[4] 曾昭海,胡跃高.共生固氮在农牧业上的作用及影响因素研究进展[J].中国生态农业学报,2006,(14):21-24.
[5] 曾昭海,隋新华,胡跃高.紫花苜蓿—根瘤菌高效共生体筛选及田间作用效果[J].草业学报,2004,13(5):95-100.
[6] Peterson T A,Russelle M P.Alfalfa and the nitrogen cycle in the corn belt[J].Journal of Soil and Water Conservation,1991,3:229-235.
[7] 李友国,周俊初.影响根瘤菌共生固氮效率的主要因素及遗传改造[J].微生物学通报,2002,(6):86-89.
[8] 李振高,骆永明,滕应.土壤和环境微生物研究法[M].北京:科学出版社,2008:125-126.
[9] Figueiredo M V B,Martinez C R,Burity H A.Plant growth-promoting rhizobacteria for improving nodulation and nitrogen fixation in the common bean[J].World Journal of Microbiology & Biotechnology,2008,7(24):1187-1193.
[10] 杜丽娟,施书莲,周克瑜,等.利用15N自然丰度法测定固氮植物的固氮量:III.参比植物的选择[J].土壤,1996,(4):210-212.
[11] 何道文,孙辉,黄雪菊.利用15N自然丰度法研究固氮植物生物固氮量[J].干旱地区农业研究,2004,21(1):132-137.
[12] 曹亚澄,施书莲,杜丽娟,等.应用15N自然丰度法测定固氮植物固氮量:I.草本豆科固氮植物固氮量的测定[J].土壤学报,1995,32(增刊2):217-225.
[13] 杨子文,沈禹颖,谢田玲,等.外源供氮水平对大豆生物固氮效率的影响[J].西北植物学报,2009,29(3):574-579.
[14] 姚允寅,陈明,马昌磷,等.15N天然丰度法测量豆科牧草共生固氮的评估[J].核农学报,1991,5(3):139-145.
[15] Bushby H V A.Colonization of rhizaospheres byBradyrhizobiumsp.in relation to strain persistence and nodulation of some pasture legumes[J].Soil Biology and Biochemistry,1993,25:597-605.
[16] 慈恩,高明.环境因子对豆科共生固氮影响的研究进展[J].西北植物学报,2005,25(6):1269-1274.
[17] 闫艳红,杨文钰,张新.施氮量对套作大豆花后光合特性、干物质积累及产量的影响[J].草业学报,2011,20(3):233-238.
[18] 刘莉,周俊初,陈华葵.不同化合态氮浓度对大豆根瘤菌结瘤和固氮作用的影响[J].中国农业科学,1998,31(4):87-89.
[19] 王树起.施氮对大豆根瘤生长和结瘤固氮的影响[J].华北农学报,2009,24(2):76-179.
[20] Cherney J H,Duxbury J M.Inorganic nitrogen supply and symbiotic dinitrogen fixation in alfalfa[J].Plant Nutrient,1994,17:2053-2067.
[21] 姚允寅,陈明,马昌磷,等.低水平化合态氮素对牧草固氮及土壤氮素肥力贡献的影响[J].同位素,1990,3(2):79-84.
[22] Gan Y B,Mark B P,Benjavan R.The effect of N fertilizer strategy on N2fixation growth and yield of vegetables oybean[J].Field Crops Research,1997,51(3):221-229.
[23] Fernando S,James E S,Kenneth G C,etal.Growth and nitrogen fixation in high-yielding soybean:impact of nitrogen fertilization[J].Agronomy Journal,2009,104(4):958-970.
[24] Maria J A,Silvina L.Strain selection for improvement of Brady-rhizobium japonicum competiti veness for nodulation of soybean[J].FEMS Microiology Letters,2008,282:115-123.
[25] 唐颖,卢林纲,隋文志,等.根瘤菌不同接种方式对大豆根瘤分布及产量的影响[J].现代化农业,2002,4:13-17.
[26] 张红侠,冯瑞华,关大伟,等.黄土高原地区优良大豆根瘤菌的筛选与接种方式研究[J].大豆科学,2010,29(6):996-1002.
[27] 姜成林,徐丽华.微生物肥料的生产应用及其资源利用[A].微生物资源开发利用[M].北京:中国轻工业出版社,2001.
[28] 王巧兰,吴礼树,赵竹青,等.15N示踪技术在植物N素营养研究中的应用及进展[J].华中农业大学学报,2007,26(1):127-132.
[29] 姚允寅,陈明,马昌磷.几种饲用牧草的δ15N 值及其固氮能力初评[J].同位素,1992,5(3):129-134.
[30] 姚允寅,陈明,马昌磷.应用15N自然丰度法估测结瘤作物的共生固氮量[J].核农学报,1989,3(2):65-74.
[31] 王平,周道玮,姜世成.半干旱地区禾—豆混播草地生物固氮作用研究[J].草业学报,2010,19(6):276-280.
[32] Chen W,McCaughey W P,Grant C A.Pasture type and fertilization effects on N2fixation N budgets and external energy inputs in western Canada[J].Soil Biology & Biochemistry,2004,36:1205-1212.

