玉簪属植物花瓣中类黄酮化合物价值评价
刘妮娜,李晓东,张金政,王亮生,孙国峰,林秦文,徐彦军
(1.中国科学院植物研究所,北京100093;2.中国科学院研究生院,北京100049;3.中国农业大学理学院,北京100094)
玉簪属(Hosta)植物为百合科(Liliaceae)重要的耐荫观叶地被植物,世界各地广泛栽培。该属野生资源主要分布于东亚的温带与亚热带地区,包括中国的东部和南部、朝鲜、日本及俄罗斯的远东地区,包括43种、35变种/变型。玉簪属植物18世纪传入欧洲,19世纪末传入美国,经过长期的栽培及杂交育种已选育出栽培品种超过4 000个,其中注册品种超过2 000个[1,2]。该属植物除是重要的园林观赏植物外,亦具有悠久的药用历史,“玉簪”之名始见于《本草纲目》[3],其全草、根、茎及花均可入药,具有清热解毒、散结消肿之功效,主要治疗乳痈、疮痈溃疡、毒蛇咬伤[4];蒙古医学以花入药,治疗咽喉肿痛、音哑、肺热[5]。玉簪花的药用价值很大程度上与其含有的类黄酮化合物有关,解红霞等[5]对玉簪(Hostaplantaginea)花进行化学成分研究,95%乙醇渗滤液的乙酸乙酯萃取部分得到山奈酚(kaempferol)、槲皮素(quercertin)、山奈酚3-O-芸香糖苷(kaempfeml-3-O-rutinoside)、山奈酚-7-O-β-D-葡萄糖苷(kaempferol-7-O-β-D-glucoside);石油醚萃取物中经硅胶柱色谱依次用石油醚—乙酸乙酯梯度洗脱,得到化合物为正二十烷酸 (eicosanoic acid)和棕榈酸-α-单甘油酯 (hexadecanoic acid 2,3-dihydroxypropyl ester)[5,6]。2003年,钟国跃等[7]研究发现紫萼玉簪(H.ventricosa)对早期、中期炎症均有较强的抑制作用。类黄酮化合物是广泛存在于自然界的一大类化合物,常以游离态或糖苷形式存在,具有多方面生物活性,包括:抗癌、抗肿瘤、抗心血管疾病、抗炎镇痛、免疫调节、降血糖、治疗骨质疏松、抑菌、抗病毒、抗氧化、抗衰老以及抗辐射等[8-13]。
玉簪属植物种质资源非常丰富,遍布世界各地,从目前查阅到的国内外研究文献来看,人们更加重视玉簪属植物根叶部位的成分研究,而对玉簪属植物花的药用价值研究还很有限,缺少进一步应用该属植物花朵的理论依据。因此应该加大对该属植物花朵部位化学成分研究及活性成分筛选的力度,以发现该属植物的新用途,以更好的造福人类。本研究拟对玉簪属5个野生种和85个栽培品种花瓣中类黄酮成分进行系统的分离鉴定,为进一步丰富玉簪属植物资源的利用提供科学依据[14,15]。
1 材料与方法
1.1 植物材料及试剂
试验材料为玉簪属5个野生种和85个栽培品种(表1)的盛花期花瓣,均于2010年6-10月,采自中国科
学院植物研究所植物园玉簪种质资源圃(39°48′N,116°28′E,海拔76m)。所有试验材料均采用相同的栽培措施(包括相同的施肥、灌溉及病害防治等)。花瓣采集后置于-20℃冰箱保存,用于后续分析。

表1 玉簪野生种、品种表Table 1 Hostaspecies and cultivars
试剂:乙腈和甲醇(色谱纯)购于北京先明乐施科技发展有限公司。三氟乙酸(≥99%)购于德国Merck公司(Darmstadt,Germany)。甲醇(分析纯)和甲酸(分析纯)购自北京化工厂。HPLC级水由 Milli-Q超纯水系统(Millipore,Billerica,MA,USA)制备。黄酮醇标准品:芦丁(纯度91.7%)、山奈酚3,7-二葡萄糖苷购自中国药品生物制品检定所,用于黄酮醇定性定量分析。
1.2 类黄酮化合物提取
每个处理称取2g花瓣材料,加液氮研磨成粉末,溶于5mL甲醇-甲酸(98∶2,V/V)的抽提溶剂,黑暗条件下4℃浸提24h,期间每隔6h于旋转振荡器(海门市其林贝尔仪器制造有限公司,江苏)振荡混匀1次。之后超声振荡30min,离心(12 000r/min,10min),收集上清液。滤渣分次加入3mL,2mL抽提液,进行第2、3次的抽提,合并收集的上清液。0.22μm尼龙微孔滤膜过滤后保存在-20℃冰箱,用于HPLC-DAD或HPLC-MSn分析。每个处理重复3次。
1.3 类黄酮化合物定性、定量分析
采用 Agilent 1100LC/MSD Trap VL 液质联用仪(HPLC-ESI-MSn)进行类黄酮定性分析。色谱条件为:采用TSK gel ODS-80Ts QA(150mm×4.6mm,5μm i.d.,Tosoh,Tokyo,Japan)色谱柱;检测波长350nm;流动相组成:A相0.1% 甲酸-水溶液;B相0.1%甲酸-乙腈溶液,洗脱程序:0min,5%B;10min,10%B;12min,11.7%B;15min,12%B;35min,13.4%B;40min,20%B;55min,29%B;60min,5%B;流速0.8mL/min;温度35℃,进样量10μL。质谱电离源采用电喷雾电离(ESI),分别在正离子和负离子模式下进行全扫描,扫描范围:(m/z)100~1 000u。正离子模式下质谱分析条件为:氮气作为干燥和喷雾气体,干燥温度350℃,氮气流速6.0 L/min,喷雾器压力:241.3kPa;毛细管电压:3 500kV,毛细管出口电压:140V;八级射频电压振幅:150Vpp;skim 1电压:55.6V,skim 2电压:6.0V;cap exit offset,84.4V。负离子模式下,参数设定值不同的为:毛细管出口电压:-127.3V;skim 1电压:-47.7V,skim 2电压:-6.0V;cap exit offset,-79.6V。用 LC/MSD Trap软件(5.2版本)分析不同模式下的质谱数据。依据样品HPLC分析的保留时间、洗脱顺序、紫外-可见吸收光谱和质谱信息,通过与标准品以及参考文献[12-14]比较得出类黄酮化合物的结构。
采用Dionex HPLC系统进行类黄酮化合物定量分析。该系统包括P680泵、TCC-100自动控温柱箱、PDA-100光电二极管阵列检测器。色谱条件与类黄酮化合物定性分析一致。利用标准品芦丁分别对黄酮/黄酮醇总量(TF)进行半定量分析,重复3次,单位为每克新鲜花瓣中含有的毫克数。
1.4 统计分析
用SPSS 16.0对数据进行聚类分析、主成分分析,并用SigmaPlot 10.0对数据作盒须图。
2 结果与分析
2.1 标准曲线
以芦丁标准溶液绘制了标准曲线,并测定了方法的灵敏度。结果表明,在所检测的浓度范围内,响应值与浓度高度线性相关,相关系数r2>0.999 3。LOD为0.229μg/mL;LOQ为0.764μg/mL(表2)。

表2 分析方法的线性检验(y=kx+m)及检测限、定量限Table 2 Linearity of response for rutin using the separate method(Calibration fitting:y=kx+m)and LOD,LOQ
2.2 玉簪属植物类黄酮化合物定性分析
表3列出了玉簪花中检测到的类黄酮化合物的紫外可见吸收光谱和质谱数据[16-20]。其中,负离子模式下的质谱数据为化合物的结构解析提供了更多信息[20]。共发现3种黄酮醇苷元和1种黄酮苷元,分别为:kaempferol(1,2,4,5,6,7,8,9,13,14,15,16和17)、quercetin(11,12)、isorhamnetin(3)和luteolin(10)(表3、图1)。
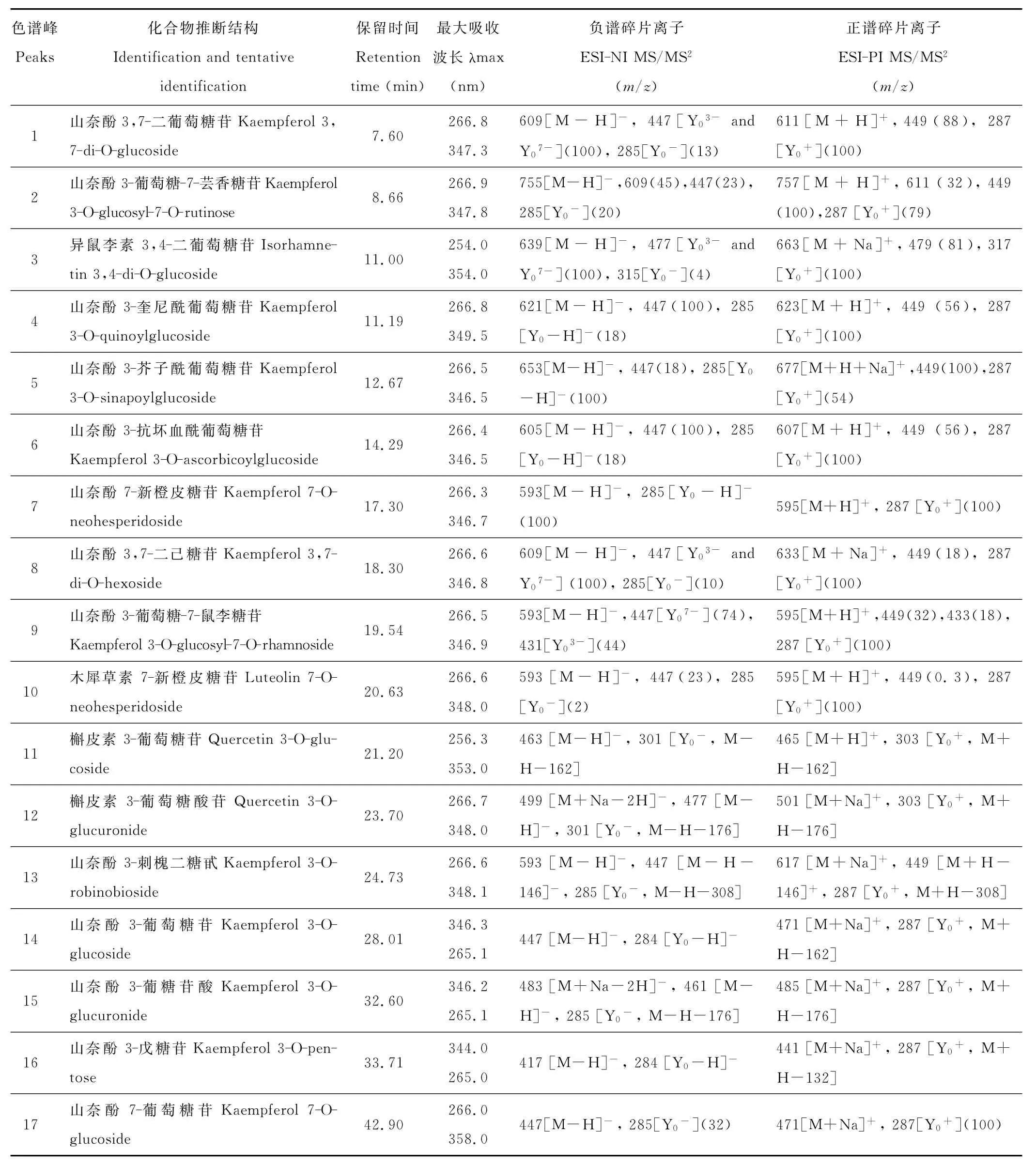
表3 玉簪类黄酮组分的紫外—可见吸收光谱与质谱数据Table 3 HPLC-DAD and HPLC-ESI-MSn analysis as well as the structure characterization and tentative identification of glycosides of flavone,flavonol in petals of Hosta
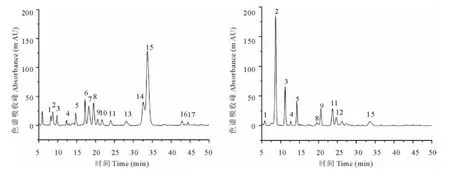
图1 灰黑叶玉簪(左)和披针叶玉簪(右)黄酮类组成的HPLC图谱(检测波长:350nm)Fig.1 DAD-chromatogram of flavonoids recorded at 350nm of H.nigrescens(left)and H.lancifolia(right)
HPLC-ESI-MSn分析结果表明,组分1通过与标准品的共洗脱和紫外吸收光谱的比较鉴定为山奈酚3,7-二葡萄糖苷(kaempferol 3,7-di-O-glucoside,Km3G7G)。组分2,3,8,9(图1)的质谱裂解行为与kaempferol 3,7-di-O-glucoside相似,表明它们是黄酮醇3,7-二糖苷。此类化合物在负离子模式下的碎片离子可以提供糖苷化位置的可靠信息[20]。在黄酮醇糖苷的MS2质谱中,准分子离子[M-H]-失去3-位的糖基产生的离子记为Y03-,而失去7-位糖基的记为Y07-。由于[M-H]-更容易失去7-位上的糖基,Y07-的相对丰度通常比Y03-高[21]。根据以上原理,将组分2,3,9分别推定为山奈酚 3-葡萄糖-7-芸香糖苷(kaempferol 3-O-glucosyl-7-O-rutinose),异鼠李素3,4-二葡萄糖苷(isorhamnetin 3,4-di-O-glucoside)[19]和山奈酚3-葡萄糖-7-鼠李糖苷(kaempferol 3-O-glucosyl-7-O-rhamnoside)。组分8的MS2质谱信息与1相同,且8的洗脱顺序在后,推测可能是半乳糖参与了糖苷化,由于没有更多的证据,暂将8推定为山奈酚3,7-二己糖苷(kaempferol 3,7-di-O-hexoside)。
组分4,5和6的[M-H]-离子在MS2分析中都有丢失碎片m/z174u,m/z206u,m/z158u的现象,推测这3个化合物为黄酮醇的酰化葡萄糖苷。将组分4,5和6的紫外吸收光谱与标准品Km3G7G进行比较,推定4为山奈酚3-奎尼酰葡萄糖苷(kaempferol 3-O-quinoylglucoside)、5为山奈酚 3-芥子酰葡萄糖苷(kaempferol 3-O-sinapoylglucoside)、6为山奈酚3-抗坏血酰葡萄糖苷(kaempferol 3-O-ascorbicoylglucoside)。
10号峰的质谱数据显示是木犀草素的衍生物,MS2质谱中只能观察到m/z447([M-H-146u]-),而没有m/z431([M-H-162u]-),表明木犀草素是被一种双糖糖苷化的。根据碎片m/z449([M+H-146u]+)的相对丰度大于m/z287([Y0+,M+H-(146+162)u]),判断双糖之间的糖苷键是1→2连接方式[20]。再比较10号峰的紫外吸收光谱,最终将10号峰推定为木犀草素7-新橙皮糖苷(luteolin 7-O-neohesperidoside)。同样,将7号峰推定为山奈酚7-新橙皮糖苷(kaempferol 7-O-neohesperidoside),13号峰被推定为山奈酚3-刺槐二糖甙(kaempferol 3-O-robinobioside)[22]。
组分11,正离子模式下检测到高丰度的苷元离子m/z303(Y0+),负离子模式下检测到相应的离子m/z301(Y0-)。再结合它们在色谱柱中的洗脱顺序和紫外可见吸收光谱数据,组分11被推定为槲皮素衍生物。组分11在(+)ESI-MS下的分子离子m/z465([M+H]+)和(-)ESI-MS下的去质子分子离子m/z463([M-H]-)表明糖基为一个己糖分子。而负离子模式下相对高丰度的自由基苷元离子m/z300([Y0-H]-)说明糖基化位置在3位上。组分11最终确定为槲皮素3-葡萄糖苷 (quercetin 3-O-glucoside)[23]。根据紫外可见吸收光谱,洗脱顺序,负离子模式下的分子离子m/z477([M-H]-),正离子模式下的分子离子m/z501([M+Na]+),组分12被推定为槲皮素3-葡萄糖酸苷(quercetin 3-O-glucuronide)[24]。
组分13鉴于紫外最大吸收波长265nm(Band II)[22],正离子模式下的苷元碎片离子m/z287(Y0+)以及负离子模式下的苷元离子m/z285(Y0-)和自由基苷元离子m/z284([Y0-H]]-)。组分14和15在正离子模式下检测到显著的加钠分子离子m/z471([M+Na]+),负离子模式下检测到去质子分子离子m/z447([MH]-),分子量正好是在山奈酚分子量的基础上加上一个己糖的分子量162u,由此确定组分14的结构为山奈酚3-葡萄糖苷(kaempferol 3-O-glucoside),组分15为山奈酚3-葡糖苷酸(kaempferol 3-O-glucuronide)。
16号峰正离子模式下检测到显著的加钠分子离子m/z441([M+Na]+)和苷元离子m/z287(Y0+),负离子模式下也检测到相应的分子离子m/z417([M-H]-)和自由基苷元离子m/z284([Y0-H]-),这些都是戊糖苷化的山奈酚或木犀草素的特征质谱数据。同时该化合物在265nm,而不是255nm有最大吸收,即是山奈酚的紫外特征吸收。但尚无法确实戊糖是木糖还是阿拉伯糖,因此组分16暂定为山奈酚3-戊糖苷(kaempferol 3-O-pentose)。
在负离子模式下,当苷元的3-位发生糖苷化时,[Y0-H]-的相对丰度大于Y0-;而7-位发生糖苷化时则相反,Y0-的相对丰度更高[20]。并且2种糖苷的紫外特征吸收波长不同,类黄酮7-糖苷的特征吸收带I与3-糖苷相比发生红移[25]。根据 MS和 UV光谱数据(表3),推定17号峰为山奈酚7-葡萄糖苷(kaempferol 7-O-glucoside)。
2.3 玉簪属植物类黄酮化合物定量分析
为了进一步筛选应用价值大的玉簪种质,首先依据类黄酮化合物成分对选定的玉簪种质进行聚类分析(图2)。当选取5为聚类距离时,玉簪分为2类。通过比较2类玉簪种质的类黄酮组成,发现I类中kaempferol 3,7-di-O-hexoside、kaempferol 3-O-glucuronide含量相对较高,II类中kaempferol 3-O-glucosyl-7-O-rutinose含量最高。进一步依据玉簪类黄酮化合物含量进行主成分分析,发现聚类分析中I类主要分布在组分8,15得分值高的区域;II类主要分布在组分2得分值高的区域(图3)。分别对I、II类作盒须图(图4),可以更加清晰明了的看出2类的区别。在以kaempferol 3,7-di-O-hexoside、kaempferol 3-O-glucuronide为主成分的I类中,山地玉簪(H.montana)为kaempferol 3,7-di-O-hexoside含量最高的品种,达到1.41mg/g。玉簪‘蒙特利尔’(Hosta‘Montrealensis’)为kaempferol 3-O-glucuronide含量最高的品种,达到1.08mg/g。在II类当中,野生种披针叶玉簪(H.lancifolia)为kaempferol 3-O-glucosyl-7-O-rutinose含量最高的玉簪种质,达到2.11mg/g,同时披针叶玉簪还是类黄酮总量最高的玉簪种质,达到2.94mg/g(表4)。
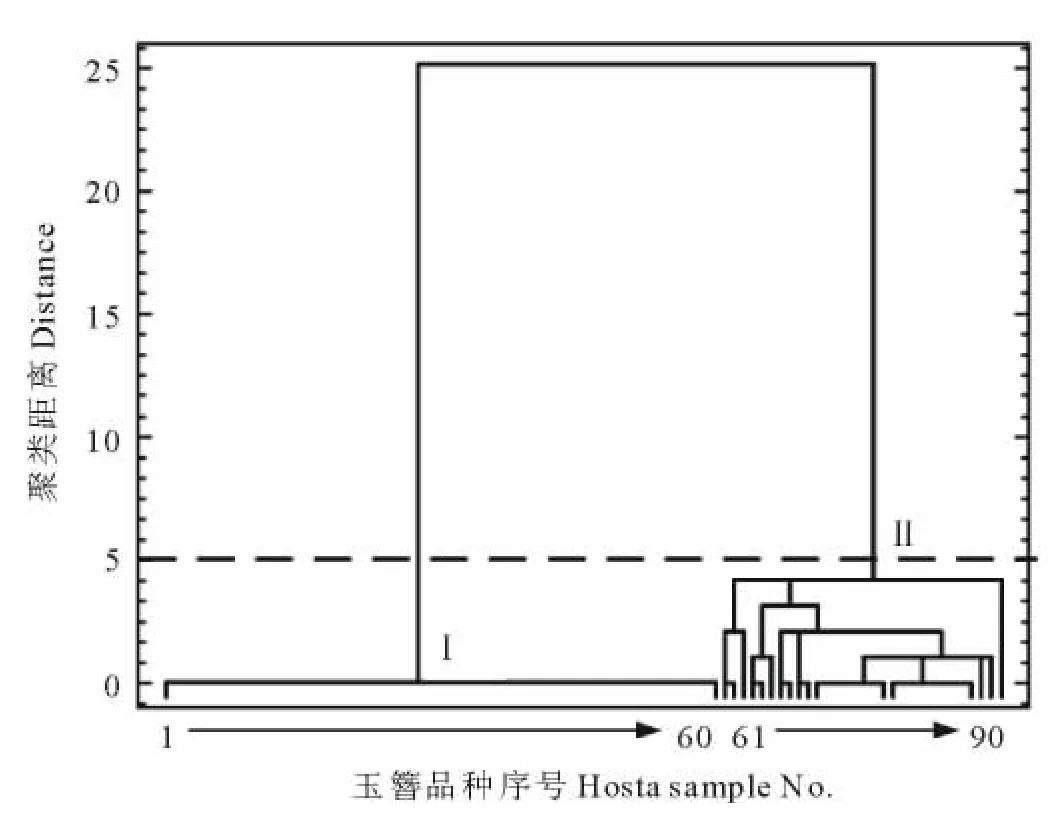
图2 玉簪聚类树形图Fig.2 Hierarchical diagram showing the classification results using cluster analysis of the flavonoids profile

图3 主成分因子得分图Fig.3 PCA scatter diagram of samples based on flavonoids profile
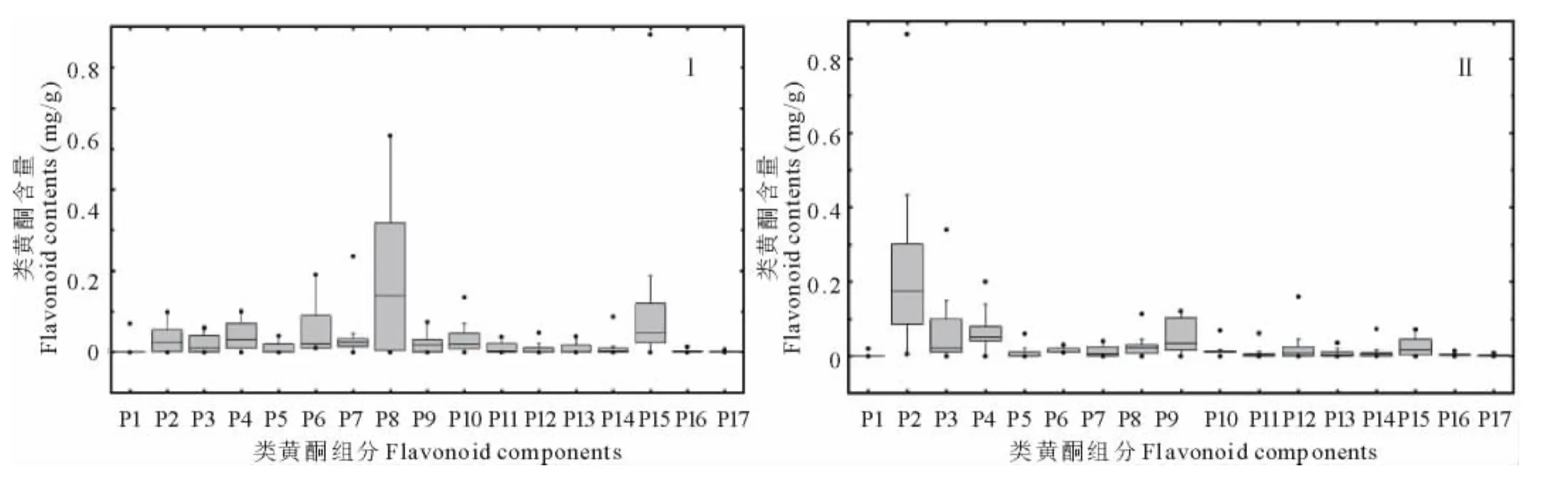
图4 不同玉簪品种中类黄酮组成Fig.4 Flavonoids constitutions from different species and cultivars of Hosta
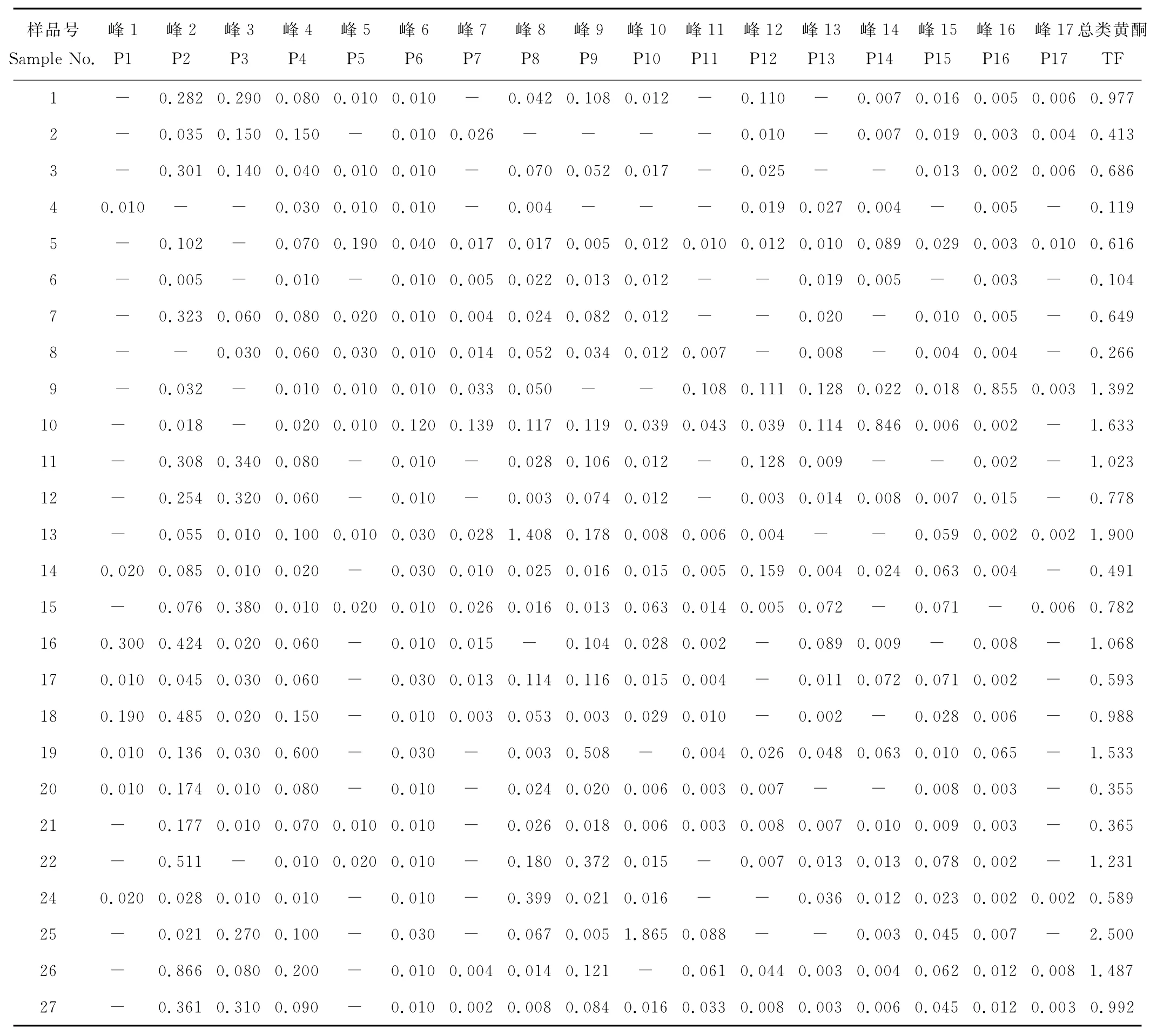
表4 玉簪花的类黄酮组成及定量分析Table 4 Flavonoid constitutions and relative quantity of flavonoid in Hosta mg/g

续表4 Continued

续表4 Continued
3 结论
目前,从植物中寻找具有各种生物活性的天然化合物备受人们关注。玉簪属植物不仅是重要的耐荫观叶地被植物,由于其多个部位均可入药,在民间及蒙药中广泛应用于乳痈、咽喉肿痛、肺热等多种炎症的治疗。玉簪属植物类黄酮化合物组成有其特殊性,但相关研究却一直没有引起人们的足够重视。到目前为止,仅见解红霞等[5]对玉簪花的类黄酮成分的初步研究,得到山奈酚(kaempferol)、槲皮素(quercertin)、山奈酚3-O-芸香糖苷(kaempfeml-3-O-rutinoside)和山奈酚-7-O-β-D-葡萄糖苷(kaempferol-7-O-β-D-glucoside)。为丰富玉簪属植物的开发利用,有必要利用高效液相色谱(HPLC-DAD)技术,建立了定量分析玉簪花中类黄酮化合物的HPLC方法,可作为玉簪花药材的质量控制方法。同时结合质谱(MSn)技术,鉴定了玉簪花瓣中类黄酮化合物的化学结构,并筛选出其富含类黄酮化合物的种质资源。
本研究以玉簪属5个野生种和85个栽培品种的花瓣为材料,利用高效液相色谱(HPLC-DAD)结合质谱(MSn)技术,鉴定了玉簪花瓣中17种类黄酮化合物的化学结构,分别为:山奈酚3,7-二葡萄糖苷、山奈酚3-葡萄糖-7-芸香糖苷、异鼠李素3,4-二葡萄糖苷、山奈酚3-奎尼酰葡萄糖苷、山奈酚3-芥子酰葡萄糖苷、山奈酚3-抗坏血酰葡萄糖苷、山奈酚7-新橙皮糖苷、山奈酚3,7-二己糖苷、山奈酚3-葡萄糖-7-鼠李糖苷、木犀草素7-新橙皮糖苷、槲皮素3-葡萄糖苷、槲皮素3-葡糖苷酸、槲皮素3-刺槐二糖苷、山奈酚3-葡萄糖苷、山奈酚3-葡糖苷酸、山奈酚3-戊糖苷和山奈酚7-葡萄糖苷。并比较了90种玉簪花中类黄酮化合物成分与含量的差异性,筛选出类黄酮化合物含量较高的种类:山地玉簪(H.montana)为kaempferol 3,7-di-O-hexoside含量最高的品种;玉簪‘蒙特利尔’(Hosta‘Montrealensis’)为kaempferol 3-O-glucuronide含量最高的品种;野生种披针叶玉簪(H.lancifolia)为kaempferol 3-O-glucosyl-7-O-rutinose含量最高的玉簪种质,同时也是类黄酮总量最高的玉簪种质。
[1] Mark R Z.TheHostaHandbook(Third Printing)[M].Rochelle:Q &Z Nursey,Inc.,2001.
[2] 刘岳路,张金政,李晓东,等.氮肥施用量对嵌合体‘金旗’玉簪叶色的影响[J].草业学报,2011,20(2):93-100.
[3] 李时珍.本草纲目[M].北京:人民卫生出版社,1977.
[4] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999.
[5] 解红霞,张金花,张宏桂,等.蒙药玉簪花的化学成分研究[J].中国药学杂志,2009,44(10):733-735.
[6] 瞿江媛,王梦月,王春明,等.玉簪抗炎活性部位及化学成分研究[J].中草药,2003,28(10):979-980.
[7] 钟国跃,周华蓉,禹志领,等.民间药物“玉簪”抗非特异性炎症活性的研究[J].中国中药杂志,2003,28(10):979-980.
[8] Havsteen B H.The biochemistry and medical significance of the flavonoids[J].Pharmacology & Therapeutics,2002,96(2-3):67.
[9] Hollman P C H,Hertog M G L,Katan M B.Analysis and health effects of flavonoids[J].Food Chemistry,1996,57(1):43-46.
[10] Middleton E,Kandaswami C.The impact of plant flavonoids on mammalian biology:implications for immunity,inflammation and cancer[A].In:Harbourne J B.The Flavonoids:Advances in Research since 1986[C].London:Chapman & Hall,1993:619-652.
[11] Day A J,Williamson G.Human metabolism of dietary quercetin glycosides in plant polyphenols[J].Plant Polyphenols 2:Chemistry,Biology,Pharmacology,Ecology,1999,2:415-433.
[12] Hertog M G L,Kromhout D,Aravanis C,etal.Flavonoid intake and long term risk of coronary heart disease and cancer in the Seven Country Study[J].Archives of Internal Medicine,1995,155:381-386.
[13] Huang M T,Ferraro T.Phenolic compounds in food and cancer prevention[A].In:Huang M T.Phenolic Compounds in Food and Their Effects on Health II,Antioxidants and Cancer Prevention[C].Washington DC:American Chemical Society,1992:8-34.
[14] 冯德庆,黄勤楼,李春燕,等.28种牧草的脂肪酸组成分析研究[J].草业学报,2011,20(6):214-218.
[15] 李孟良,郑琳.五河野生大豆种子营养成分及饲用价值研究[J].草业学报,2011,20(4):137-142.
[16] Martin C,Carpenter R,Sommer H.Control of anthocyanin biosynthesis in flowers ofAntirrhinummajus[J].The Plant Journal:for Cell and Molecular Biology,1991,1:37-49.
[17] Masa A,Vilanova M.Flavonoid and aromatic characterisation of cv.Albarín blanco(VitisviniferaL.)[J].Food Chemistry,2008,107:273-281.
[18] Masato K,Keiichi W,Kazunari N,etal.Cultivar differences in anthocyanin and carotenoid pigments in the petals of the flowering lotus(Nelumbospp.)[J].Journal of the Japanese Society for Horticultural Science,2002,71:812-817.
[19] Castillo-Muoz N,Gómez-Alonso S,García-Romero E,etal.Flavonol profiles ofVitisviniferared grapes and their single cultivar wines[J].Journal of Agricultural and Food Chemistry,2007,55:992-1002.
[20] 阿布拉江·克依木.黄酮苷类天然产物的质谱分析方法研究[D].北京:中国协和医科大学,2006.
[21] Ma Y,Cuyckens F,Van den Heuvel H,etal.Mass spectrometric methods for the characterisation and differentiation of isomeric O-diglycosyl flavonoids[J].Phytochemical Analysis:PCA,2001,12:159-165.
[22] Lim S S,Jung Y J,Hyun S K,etal.Rat lens aldose reductase inhibitory constituents ofNelumbonuciferastamens[J].Phytotherapy Research,2006,20:825-830.
[23] Rahman W,Ilyas M,Khan A W.Flower pigments:Flavonoids fromNelumbonuciferaGaerten[J].Naturwissenschaften,1962,49:327.
[24] Laboratory P,Medica S,Sciences C.The Ultraviolet Spectrums of Flavones and Flavonols[M].Beijing:Science Press,1981.
[25] Kashiwada Y,Aoshima A,Ikeshiro Y,etal.Anti-HIV benzylisoquinoline alkaloids and flavonoids from the leaves ofNelumbonucifera,and structure-activity correlations with related alkaloids[J].Bioorganic & Medicinal Chemistry,2005,13:443-448.

