罗氟司特对百草枯诱导的小鼠肺、肝、肾组织损伤与纤维化的抑制作用*
陈 妍,贺利利,罗钰龙,林 锋,黄志强,彭 维,苏薇薇,李沛波
(中山大学生命科学学院,广东 广州 510275)
百草枯(paraquat,PQ),化学名称为1,1-二甲基-4,4-联吡啶二氯化物,是一种在欧美与亚洲广泛应用的除草剂[1]。PQ对人体与动物均具有极强的毒性,目前临床尚无有效的解毒药物。近年来因误食或自杀口服PQ造成人和动物急性中毒与死亡的案例越来越多[2]。PQ摄入后能分布于哺乳动物机体各组织,主要蓄积在肺、肝、肾等器官,而最终导致其氧化损伤与纤维化病变[3]。呼吸道中的氧气会增加PQ诱导的活性氧自由基产生,加重氧化应激诱导的肺损伤,从而造成肺泡塌陷、血管渗漏与纤维化病变。PQ中毒还能造成肝血管破坏与堵塞、肝细胞坏死以及肾小管破坏与肾小球坏死等病变[4]。
PQ诱导的纤维化是继氧化应激后在多种诱导因子如IL-13、TNF-α、TGF-β等诱导下的成纤维细胞活化及其对受损机体的异常修复。环氧合酶(COX-2)或前列腺素受体基因敲除的小鼠在百草枯与博来霉素的诱导下更易产生严重的肺纤维化,而环腺苷酸(cAMP)及其结构类似物的含量上升均能显著缓解气道滴注博来霉素诱导的仓鼠肺纤维化,表明cAMP在抑制纤维化发生的过程中发挥了重要的作用[5-6]。
罗氟司特是一种磷酸二酯酶4(phosphodiesterase 4,PDE4)选择性抑制剂,具有有效抑制cAMP水解,提高细胞内cAMP含量的作用[7]。罗氟司特对临床哮喘与慢性阻塞性肺病患者具有显著疗效[8-11]。结果表明:罗氟司特能显著抑制中性粒细胞与血管内皮细胞的粘附,抑制中性粒细胞弹性蛋白酶、髓过氧化物酶、金属基质蛋白酶、白三烯B4以及活性氧自由基的释放;能显著抑制嗜酸性粒细胞、淋巴细胞与单核细胞的增殖及其细胞因子的分泌;还能显著抑制肺动脉平滑肌细胞的增殖以及气道上皮细胞MUC5AC基因的表达。除此之外,罗氟司特还能够显著缓解烟熏7个月诱导的小鼠肺气肿,减少卵白蛋白反复激发6周诱导的哮喘小鼠肺间质胶原沉积以及抑制慢性缺氧21天诱导的小鼠肺动脉平滑肌增生。
近期研究结果表明:罗氟司特能够抑制博来霉素诱导的小鼠急性肺损伤以及肺纤维化,而且证实这种作用与提高cAMP含量,促进前列腺素(PGE2)的合成相关[12]。本研究旨在通过构建百草枯诱导的小鼠肺、肝、肾组织纤维化模型,探索罗氟司特对百草枯诱导的小鼠肺、肝、肾组织损伤与纤维化的抑制作用。
1 材料与仪器
1.1 实验动物
昆明种小鼠,SPF级,雌雄各半,体质量18~22 g,24只,由广东省医学实验动物中心提供。合格证号:SCXK(粤)2003-0002粤鉴证字2008A022。
1.2 试剂与材料
罗氟司特(Rof);由海利来医药科技有限公司提供,批号:20110519,纯度(w)大于99%;百草枯(PQ):sigma-Aldrich,货号856117,纯度(w)大于98%;地塞米松:广东华南制药厂,批号20110504。
2 方 法
2.1 动物分组与造模
昆明种小鼠24只,SPF级,体质量18~22 g,购自广东省医学实验动物中心,动物合格证号为:SCXK(粤)2003-0002 粤鉴证字2008A022。小鼠饲养1周适应环境后,随机分成以下4组,每组6只:空白对照组、PQ组、PQ+地塞米松组5 mg/kg组(PQ+Dex)、PQ+罗氟司特5 mg/kg组(PQ+Rof)。
具体造模方法如下:除空白组小鼠外,其余各组小鼠分别在第1天时腹腔注射PQ 20 mg/kg造模。在造模过程中,除空白组小鼠外,其余各组小鼠每天灌胃给与各受试药物或生理盐水,每天给药1次,共给药21 d。
2.2 样本收集与染色切片分析
造模结束后,各组小鼠分别腹腔注射w=3.5%水合氯醛麻醉,并通过摘眼球法放血处死小鼠,然后四肢仰卧位固定于实验台上,手术分离小鼠肺叶、肝脏与肾后分别浸泡于φ=10%中性福尔马林溶液中进行脱水,并经石蜡固定后切成3~4 μm的切片做HE染色与Masson染色。切片使用Mirax Scan在400×视野下观察组织损伤与纤维化程度等病理学变化,并通过双盲法进行半定量分析。
3 结 果
3.1 肺组织形态学变化
小鼠肺组织Masson染色切片结果见图1。肺组织中气道、血管以及肺泡的形态学变化主要从血管渗漏与基底膜纤维化、气道基底膜纤维化、气道上皮增生、肺泡塌陷与融合、肺泡内炎性细胞浸润与肺间质纤维化等6个指标进行双盲法半定量评分,评分结果见表1。空白组小鼠肺组织气道、血管与肺泡形态学结构完整,仅在血管与气道基底膜侧见到少量胶原纤维沉积(图1a)。PQ组小鼠肺组织在气道、血管与肺泡水平均发生了显著的纤维化病变,主要体现在:①血管尤其是肺小静脉发生了渗漏与基底膜纤维化;②气道基底膜增厚以及纤维化;③气道上皮增生与黏液分泌增加;④部分肺泡细胞发生塌陷与融合,使得单个肺泡表面积增大;⑤环气道与血管周围的肺泡内有较严重的炎性细胞浸润与间质纤维化(图1b)。PQ+地塞米松组按每天5 mg/kg的剂量给予地塞米松21 d后,小鼠肺组织中气道基底膜、血管基底膜以及肺泡间质纤维化程度均有明显改善,而肺泡塌陷、气道上皮增厚与黏液分泌、以及炎性细胞浸润水平的改善并不明显(图1c)。PQ+罗氟司特按每天5 mg/kg的剂量给与罗氟司特21 d后,小鼠肺组织气道、血管与肺泡形态学病变均发生了明显改善,仅出现中度的环气道与血管基底膜纤维化与炎性细胞浸润(图1d)。

图1 小鼠肺组织Masson染色切片Fig.1 Lung tissues of mice stained by Masson (T:气道;V:血管;A:肺泡;1:血管基底膜纤维化;2:气道基底膜纤维化;3:气道上皮增生;4:肺泡塌陷与融合;5:炎性细胞浸润)

评价指标ConPQPQ+DexPQ+Rof血管渗漏与基底膜纤维化-/+++/++++/+++气道基底膜纤维化-/++++++气道上皮增生-++/++++++/++肺泡塌陷与融合-++/+++++-/+血管壁破坏与炎性浸润-+++++/++++/++肺间质纤维化-+++/++-/+总评分11551056
1) -表示无(0分),+表示轻度(1分),++表示中度(2分),+++表示重度(3分)
3.2 肝组织形态学变化
小鼠肝组织Masson染色切片结果见图2。肝组织中血管与肝实质细胞的形态学变化主要从肝间质内炎性细胞浸润、血管壁破坏与基底膜纤维化、肝间质纤维化与肝细胞坏死等四个指标进行双盲法半定量评分,评分结果见表2。空白组小鼠肝组织血管与肝细胞形态学结构完整(图2a),PQ组小鼠肝中心静脉以及小静脉显示出严重的血管壁破坏、血液堵塞以及基底膜纤维化,大量血液与炎性细胞渗出到肝组织中,肝间质出现明显的胶原纤维沉积与炎性细胞浸润,部分肝细胞发生坏死(图2b)。PQ+地塞米松组按每天5 mg/kg的剂量给与地塞米松21 d后,PQ诱导的小鼠肝组织中血管壁渗漏、基底膜纤维化以及肝细胞坏死程度均有明显改善,但与空白组小鼠相比,其肝组织与血管形态学发生了明显变化(图2c)。PQ+罗氟司特组按每天5 mg/kg的剂量给与罗氟司特21 d后,PQ诱导的小鼠肝组织中肝细胞与血管形态学病变均得到明显恢复(图2d)。

图2 小鼠肝组织Masson染色切片Fig.2 Liver tissues of mice stained by Masson(H:肝细胞;V:血管;1:炎性细胞浸润;2:血管基底膜纤维化;3:血管内皮渗漏以及浸润)

评价指标ConPQPQ+DexPQ+Rof肝间质内炎性细胞浸润-++/++++-/+血管壁破坏与基底膜纤维化-++/++++/+++肝间质纤维化-+++-/+肺细胞坏死-++++总评分09453
1) -表示无(0分),+表示轻度(1分),++表示中度(2分),+++表示重度(3分)
3.3 肾组织形态学变化

图3 小鼠肾组织HE染色切片Fig.3 Kidney tissues of mice stained by H&E (G:肾小球;R:肾小管;V:血管;1:肾小管形态变化、2:肾小球形态变化、4:血液渗漏与炎性细胞浸润)
小鼠肾组织HE与Masson染色切片结果见图3与图4。肾组织中肾小管、肾小球与血管的形态学变化主要从肾小管上皮坏死、肾小球坏死、肾组织间质与血管基底膜纤维化、血液渗漏与炎性细胞浸润等五个指标进行双盲法半定量评分,评分结果见表3。空白组小鼠肾组织肾小管、肾小球与血管等组织形态学结构完整,仅有个别肾小管出现柱状上皮胞质空泡化与脱落症状(图3a与4a)。PQ组小鼠肾组织中肾小管、肾小球与血管显示出严重的破坏与坏死症状,主要表现为肾小管柱状上皮大量胞质空泡化与脱落、部分肾小球坏死与退化、肾血管壁破坏导致血液与大量炎性细胞渗漏、血管平滑肌增生与基底膜纤维化(图3b与4b)。PQ+地塞米松组按每天5 mg/kg的剂量给与地塞米松21 d后,PQ诱导的小鼠肾组织中肾小管柱状上皮坏死脱落以及炎性细胞浸润均得到明显改善,但血管基底膜的纤维化程度以及肾小球坏死的比例均没有明显作用,且其整个肾组织形态学特征,与空白组小鼠相比仍具有明显差异(图3c与4c)。PQ+罗氟司特按每天5 mg/kg的剂量给与罗氟司特21 d后,PQ诱导的小鼠组织中肾小球与肾小管坏死、炎性细胞浸润与血管基底膜纤维化等形态学病变均得到明显恢复,与空白组小鼠比较,仅肾小管柱状上皮的坏死与脱落存在明显差异(图3d与4d)。

图4 小鼠肾组织Masson染色切片Fig.4 Masson staining of kidney tissues(G:肾小球;R:肾小管;V:血管;1:肾小管形态变化、2:肾小球形态变化、3:肾组织间质与血管基底膜纤维化4:血液渗漏与炎性细胞浸润)
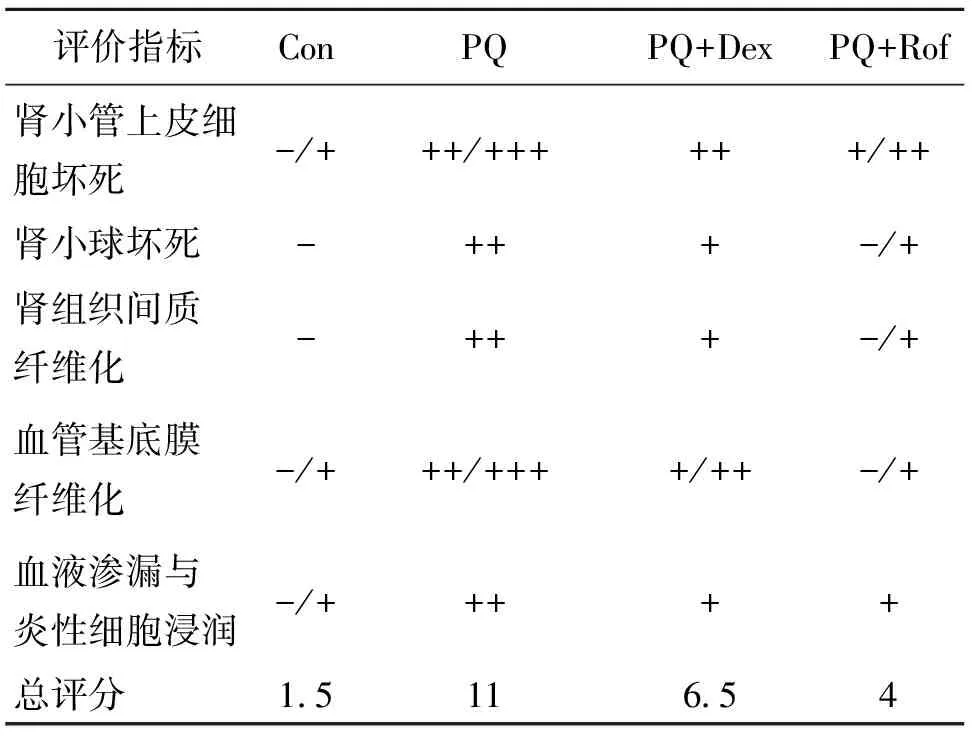
评价指标ConPQPQ+DexPQ+Rof肾小管上皮细胞坏死-/+++/++++++/++肾小球坏死-+++-/+肾组织间质纤维化-+++-/+血管基底膜纤维化-/+++/++++/++-/+血液渗漏与炎性细胞浸润-/+++++总评分1511654
1) -表示无(0分),+表示轻度(1分),++表示中度(2分),+++表示重度(3分)
4 讨 论
本研究中,我们参照文献[2]构建了一个PQ诱导的小鼠慢性肺、肝、肾组织损伤与纤维化模型,并在此模型上成功复制了PQ中毒后人体肺、肝、肾等器官组织损伤以及纤维化的形态学变化。这些变化主要包括:①肺泡塌陷、炎性细胞浸润以及间质纤维化,肺血管与气道壁增厚以及基底膜纤维化;②肝血管壁破坏、血液堵塞以及基底膜纤维化,肝实质细胞坏死以及肝间质炎性细胞浸润与胶原纤维沉积;③肾小管与肾小球坏死,肾血管壁破坏与基底膜纤维化,以及肾组织间质炎性细胞渗漏与胶原纤维沉积。这些病理学特征与已有的文献报道一致[3,11]。
有文献表明,罗氟司特能够抑制TGF-β诱导的成纤维细胞活化以及胶原纤维合成,这与其提高胞浆内cAMP含量进而促进PGE2的合成相关[13]。本研究首次通过PQ诱导的小鼠慢性组织损伤与纤维化模型,发现罗氟司特对PQ诱导的小鼠肺、肝、肾等器官的组织损伤与纤维化症状均有显著改善。这为罗氟司特的临床应用提供了依据。
参考文献:
[1] 李光义, 邓晓, 侯宪文, 等. 除草剂对飞机草化感作用的影响研究[J]. 中山大学学报:自然科学版, 2009, 48 (3): 93-101.
[2] 邵阳, 杨期东. 百草枯致小鼠肺纤维化作用的实验研究[J]. 环境与健康杂志, 2009, 26(4): 305-307.
[3] AWADALLA E A. Efficacy of vitamin C against liver and kidney damage induced by paraquat toxicity [J]. Experimental and Toxicologic Pathology, 2012, 64(5): 431-434.
[4] ZHI Qiaoming, SUN Haichen, QIAN Xiaoming, et al. Edaravone, a novel antidote against lung injury and pulmonary fibrosis induced by paraquat [J]. International Immunopharmacology, 2011, 11(1): 96-102.
[5] BOZYK P D, MOORE B B. Prostaglandin E2 and the pathogenesis of pulmonary fibrosis [J]. American Journal of Respiratory Cell and Molecular Biology, 2011, 45(3): 445-452.
[6] LIU Xiaoqiu, OSTROM R S, INSEL P A. cAMP-elevating agents and adenylyl cyclase overexpression promote an antifibrotic phenotype in pulmonary fibroblasts [J]. American Journal of Physiology-cell Physiology, 2004, 286(5): C1089-C1099.
[7] BOSWELL-SMITH V, PAGE C P. Roflumilast: a phosphodiesterase-4 inhibitor for the treatment of respiratory disease [J]. Expert Opinion on Investigational Drugs, 2006, 15(9), 1105-1113.
[8] MAHER T M, EVANS I C, BOTTOMS S E, et al. Diminished prostaglandin E2 contributes to the apoptosis paradox in idiopathic pulmonary fibrosis[J]. American Journal of Respiratory and Critical Care Medicine, 2010, 182: 73-82.
[9] HUANG S K, WHITE E S, WETTLAUFER S H, et al. Prostaglandin E(2) induces fibroblast apoptosis by modulating multiple survival pathways [J]. Faseb Journal, 2009, 23: 4317-4326.
[10] BAUM B J, MOSS J, BREUL S D, et al. Effect of cyclic AMP on the intracellular degradation of newly synthesized collagen [J]. Journal of Biological Chemistry, 1980, 255: 2843-2847.
[11] KUMAR R K, HERBERT C, THOMAS P S, et al. Inhibition of inflammation and remodeling by roflumilast and dexamethasone in murine chronic asthma [J]. Journal of Pharmacology and Experimental Therapeutics, 2003, 307(1): 349-355.
[12] CORTIJO J, IRANZO A, MILARA X, et al. Roflumilast, a phosphodiesterase 4 inhibitor, alleviates bleomycin-induced lung injury [J]. British Journal of Pharmacology, 2009, 156(3): 534-544.
[13] TOGO S, LIU Xiangde, WANG Xingqi, et al. PDE4 inhibitors roflumilast and rolipram augment PGE2 inhibition of TGF-{beta}1-stimulated fibroblasts [J]. American Journal of Physiology-lung Cellular and Molecular Physiology, 2009, 296(6): L959-L969.

