以酵母菌双杂合技术寻找志贺氏菌IpaH7.8作用蛋白质的目标蛋白
李思硕 简俊伊 程树德
以酵母菌双杂合技术寻找志贺氏菌IpaH7.8作用蛋白质的目标蛋白
李思硕 简俊伊 程树德
台湾阳明大学微生物及免疫学研究所
背景:志贺氏菌感染能造成人类出血性腹泻,此菌常带有一大型毒性质体,以携带第三型分泌系统及相关致病基因,并透过此系统释放作用蛋白,协助菌体侵入人类肠壁细胞,操控细胞功能,以利在细胞中存活及增殖。IpaH 家族蛋白是作用蛋白中较特别的一群,志贺氏菌常带有数个IpaH家族基因,除了在毒性质体上,经常同时存在染色体上。从蛋白质结构上来说,IpaH家族蛋白皆由两个功能性区域组成,其C端均为E3泛素连接酶,而N端在不同IpaH 家族蛋白则具有不同的白氨酸重复序列,可能结合不同的目标蛋白,最后将其泛素化。其中 IpaH4.5、IpaH7.8、IpaH9.8 在侵入宿主细胞后才释放;目前已有研究发现IpaH4.5和IpaH9.8的目标蛋白,其他IpaH蛋白的目标蛋白和功能则仍未知,因此我们希望利用酵母菌双杂合技术找出IpaH7.8的目标蛋白。方法:使用酵母菌双杂合系统筛选,接着将可能的候选蛋白,以其在细胞内的分布、伪阳性的可能性、与IpaH7.8交互作用的强度等,作进一步评估,最后以共同沉淀技术进行验证。结果:经酵母菌双杂合系统筛选后,我们得到6个候选蛋白,其中多数参与细胞的代谢反应。其中一候选蛋白-RAD50,主要分布在细胞核,而我们直接在细胞中表现IpaH7.8 N端和绿色萤光蛋白的融合蛋白,也发现绿色萤光聚集在细胞核,因此推测RAD50为候选蛋白的可能性最高。将IpaH7.8和RAD50进行共同沉淀,显示两者在生物体外的条件下可互相结合。
酵母菌双杂合技术 志贺氏菌IpaH7.8作用蛋白质 目标蛋白 共同沉淀法
志贺氏菌为人类的病原菌,当 10~100 个菌体感染人类时,即可能造成严重的出血性腹泻以及发炎反应[1]。其致病性来自毒性质体上所携带的第三型分泌系统 (Type III secre- tion system) 及相关致病基因[2]。包含这群基因的片段被称为进入区域 (Entry region),当此区域内的转录活化因子 VirB (第二号毒性基因,Virulence B)受VirF (第六号毒性基因,Virulence F) 活化后,会启动进入区域的其他基因,以构成第三型分泌系统,同时也活化进入区域外的osp(外膜蛋白质,Outer membrane protein) 家族基因。部分osp家族蛋白已证实可被释放至宿主细胞,降低细胞的免疫反应,协助志贺氏菌的感染[3-4]。osp家族和ipaA、ipaB、ipaC、ipaD 基因属于感染初期 (菌体尚未进入细胞前) 最先被分泌的作用蛋白,当菌体进入宿主细胞后,IpgD会与MxiE结合,活化另一群作用蛋白的基因,包含部分osp家族,以及ipaH家族,这些作用蛋白被认为可抑制细胞的非专一性免疫反应,并减少受感染细胞的凋亡,帮助细菌在宿主细胞内存活[5]。
IpaH家族基因在1987年被发现,在众多作用蛋白当中,IpaH是唯一具有多套(multi-copy)基因的蛋白[6],且此家族同时存在毒性质体,以及细菌染色体上。在已定序的志贺氏菌株中,有5个ipaH家族基因经常出现,总基因数目则因菌株不同而稍有差异[7],因此Sasakawa等人认为此作用蛋白可能具有重要的功能[8]。
IpaH 蛋白约为 60 kD,从结构上可分为 N 端和 C 端两部分:N 端具有白胺酸重复序列 (Leucine rich repeat,LRR),这样的重复序列常被用来与其目标蛋白结合,不同 IpaH 的 N 端则带有不同的重复序列;IpaH 家族的 C 端序列则几乎是相同的,且被发现具有E3泛素连接酶 (E3 ubiquitin ligase) 的功能[9]。综合上述推测,IpaH 家族的不同成员,可能具有将其目标蛋白泛素化的功能[10]。
Sasakawa等人在2005年发现,IpaH9.8会进入细胞核,借由和U2AF35结合,影响mRNA的剪接作用 (splicing),使mRNA无法成熟(maturation),进而影响介白素8 (interleukin-8)、趋化素 (Regulated upon Activation, Normal T-cell Expressed, and Secreted,RANTES)、颗粒单核球群落刺激生长因子(Granulocyte-macrophage colony-stimulating factor,GM-CSF) 和介白素 1β (interleukin-1β),以抑制宿主细胞的免疫反应[11];相同团队在2010年又发现IpaH9.8可和细胞质中的NEMO和ABIN两个蛋白质结合,NEMO为NF-κB复合物的前驱物IKKα-IKKβ 的结合蛋白,IpaH9.8 可将 NEMO 泛素化,促使其降解,进而抑制IL-6的分泌,降低免疫反应[12]。
此外,Fernandez-Prada等在 2000 年将志贺氏菌接种至天竺鼠眼球(Sereny test),观察正常基因型,或分别具有 ipaH4.5或ipaH7.8 基因缺失时,对天竺鼠眼球发炎的影响,结果发现ipaH4.5或ipaH7.8基因缺失皆增强发炎反应,且 ipaH4.5和ipaH7.8同时剔除将更加剧烈;此论文并未探讨其作用机制,但由此推测,IpaH7.8可能也和抑制发炎反应有关。其他研究中则指出,IpaH7.8会促使吞噬细胞的凋亡,调控机制仍不清楚[13]。
最近,北京军事医学科学院疾病预防控制所王芳博士的论文《志贺氏菌Ⅲ型分泌系统效应子蛋白 IpaH4.5功能研究》,也以酵母菌双杂合技术为基础,发现其目标蛋白为p65,借此降低宿主细胞的免疫反应[14]。
本研究以酵母菌双杂合技术找寻IpaH7.8可能的结合蛋白,期望能找到参与免疫反应路径的候选蛋白。
1 材料与方法
1.1 菌株和细胞株
E. coli 由益生生技公司购买,DH5α菌株作为胜任细胞和质体增殖用,BL21菌株用以生产重组蛋白。酵母菌由阳明大学郑明媛教授馈赠,菌株 Y187 (MATα,ura3-52,his3-200,ade 2-101,trp 1-901,leu 2-3,112,gal4D,met,gal80D,URA3::GAL1UAS-GAL1TATA-Lac,MEL1),菌株 PJ69-2A,(MATa, trp1-901,leu2-3,112,ura3-52,his3-200,gal4D,gal80D,LYS2::GAL1UAS-GAL1TATA-HIS3,GAL2UAS- GAL2TATA-ADE2,MEL1)。人类均质化互补型去氧核糖核酸基因库 (normalized cDNA library) 由 Clontech 公司购买。HeLa 细胞株由阳明大学林奇宏教授馈赠。
1.2 使用基因序列以及质体
IpaH7.8 基因由 Shigella flexneri 2457T 经聚合链酶连锁反应(PCR)取得。于大肠杆菌表现重组蛋白之质体 pTAC- MAT-Tag2由Sigma公司购买。酵母菌表现用质体 pACT-2、pAS2-1、pGBP-9由阳明大学郑明媛教授馈赠。细胞表现用质体 pEGFP-N2 由阳明大学林奇宏教授馈赠。
1.3 菌种培养
大肠杆菌菌株皆以 Luria broth (LB) 培养基于 37℃ 恒温培养箱培养,制成洋菜平板 (agar plate) 时则外加 1.2洋菜胶 (agar) 并视需要添加抗生素:ampicillin (50μg/mL) 或 kanamycin (30μg/mL)。如需 IPTG 诱导,细菌先培养于外加 0.5glucose 及 0.5yeast extract 之 M9 培养基,隔夜后再 1:1 稀释至含 1mM IPTG 之 LB 培养基,于 37℃ 培养 2 小时。
1.4 共轭焦显微镜观察
使用 T-Pro Biotechnology 公司之T-Pro Non-liposome Transfection Reagent 进行转染,经 12~18 小时后,抽去细胞之培养液并以 3.7的福马林溶液 (formaldehyde) 固定,室温静置15分钟,吸去福马林,再以 PBS 缓冲液冲洗两次,最后利用 Leica SP5 共轭焦显微镜观察。
1.5 重组蛋白纯化
将IpaH4.5或IpaH7.8 接入 pTAC-MAT-Tag2 使其带有MAT-tag,并转型至 BL21 菌株,经 IPTG 诱导表现后,离心去除培养液,再使用裂解溶液 (lysis buffer:triton X100 1% PMSF 50mM 之 PBS 溶液) 悬浮,利用法式细胞破碎仪 (French press) 打破菌体,接着离心取上清液,通过 His-Trap FF 管柱纯化。
1.6 HeLa 细胞溶解物 (cell lysates)
将10公分培养盘之培养液抽去,以PBS溶液冲洗后,加入 200μL RIPA裂解液,刮下细胞,经 4℃、14000 rpm 离心10分钟,取上清液使用。
1.7 共同沉淀法
使用 TAN Beads公司之His Mag磁珠,经 RIPA裂解溶液清洗两次,并悬浮在 RIPA 裂解溶液,再和重组蛋白混合,于 4℃缓慢摇动30分钟后,离心去除上清液;接着将带有重组蛋白之磁珠加入细胞裂解物中,经4℃缓慢摇动1小时后,离心去除上清液,并以样本缓冲液 (sample buffer) 将磁珠悬浮,以100℃沸水加热5分钟后置冰上冷却。最后离心去除磁珠,取上清液进行西方墨点法分析。
1.8 酵母菌双杂合系统
使用 Y187和PJ69-2A 两菌株,其中 Y187 为α型,而 PJ69-2A是a型;两菌株皆无法生长在缺少白胺酸 (leucine)、色胺酸(tryptophan)、腺嘌呤 (adenine)、组胺酸 (histidine) 的培养基上。本研究中所使用的 pGADT7 质体带有 leu2 基因,可使酵母株生长在缺少白胺酸的培养基上;pAS2-1 和 pGBT9 质体则带有 trp2 基因,可使酵母菌生长在缺少色胺酸的培养基上。将猎物蛋白和饵蛋白分别接入其中一个质体,并分别转型至 Y187 或 PJ69-2A,经交配后,以同时缺少白胺酸和色胺酸的培养基筛选,即得同时带有两个质体的二倍体。若猎物蛋白和饵蛋白可进行交互作用,则菌株可开启质体上的下游基因,进一步生长在缺乏腺嘌呤和组胺酸的培养基,若交互作用较强,还可使菌落在含X-α-gal 的培养基上呈蓝色。
1.9 酵母菌培养
一般培养使用 YPAD 培养液;SD/-Trp、SD/-Leu、SD/-Trp-Leu (2SD)、SD/-Trp-Leu-His-Ade (4SD) 培养液分别用于筛选转型后,或交配后可生长于缺乏特定营养源的菌株。X-α-gal (4mg/mL) 则视需要添加。
1.10 酵母菌转型
酵母菌经 30℃隔夜培养后,重新接种,于30℃培养至 OD600达0.4~0.6,离心去除上清液,以无菌3次水清洗,再离心去除上清液后,以 TE/LiAc 缓冲液清洗,再离心后悬浮于 TE/LiAc 缓冲液,即为酵母菌胜任细胞;使用1.5mL胜任细胞,加入150~200μg carrier DNA 和10~50μg质体,以及6mL含40PEG3350的TE/LiAc 缓冲液,在30℃培养箱缓慢摇动30分钟,再加入700μL DMSO,并于42℃水浴15分钟,最后离心去除上清液,以无菌三次水悬浮,并涂抹在缺乏特定营养源的培养基上。
1.11 酵母菌交配
将具有饵蛋白质体的酵母菌株接种至100mL的 SD/-Trp 培养液中,30℃隔夜培养,接着离心并重新悬浮为5mL体积,再和OD600约100的带有猎物蛋白质体之酵母菌1mL混合,并加入45mL YPAD培养液,在30℃培养箱中培养20~24小时。取少量经连续稀释后涂抹在培养机上,以计算交配效率,其余则涂抹于缺乏特定营养源的培养基。
1.12 酵母菌菌落聚合酶链锁反应
将酵母菌菌落挑入 30μL 0.2SDS溶液中,震荡15秒后,马上以95℃隔水加热4分钟,于室温冷却后,离心取上清液稀释10倍为DNA样本。PCR包含一组TUB1引子作为阳性控制组,一组 GAL4 引子确认饵蛋白质体,及一组 cDNA 用引子获得基因库嵌入片段。
2 结果
2.1 酵母菌转型及交配效率
酵母菌交配完成后,经连续稀释,将菌液分别涂在 YPDA、SD/-Leu、SD/-Trp、2SD 上,以计算交配效率,回推所得的二倍体数目约16000个。进一步筛选有交互作用者,得到264个阳性菌落,再经由酵母菌菌落聚合链酶连锁反应确认,得到68个菌落带有cDNA资料库嵌入片段。进一步分析嵌入片段长度,并利用限制酶处理,区分不同嵌入片段,最后选出28个不同的cDNA嵌入片段。
2.2 候选蛋白筛选
经定序后发现,并非所有嵌入片段都和活化区域属于同一开放阅读框架 (open reading frame),因此最后得到 6 个可转译出长片段的候选蛋白 (见表1)。
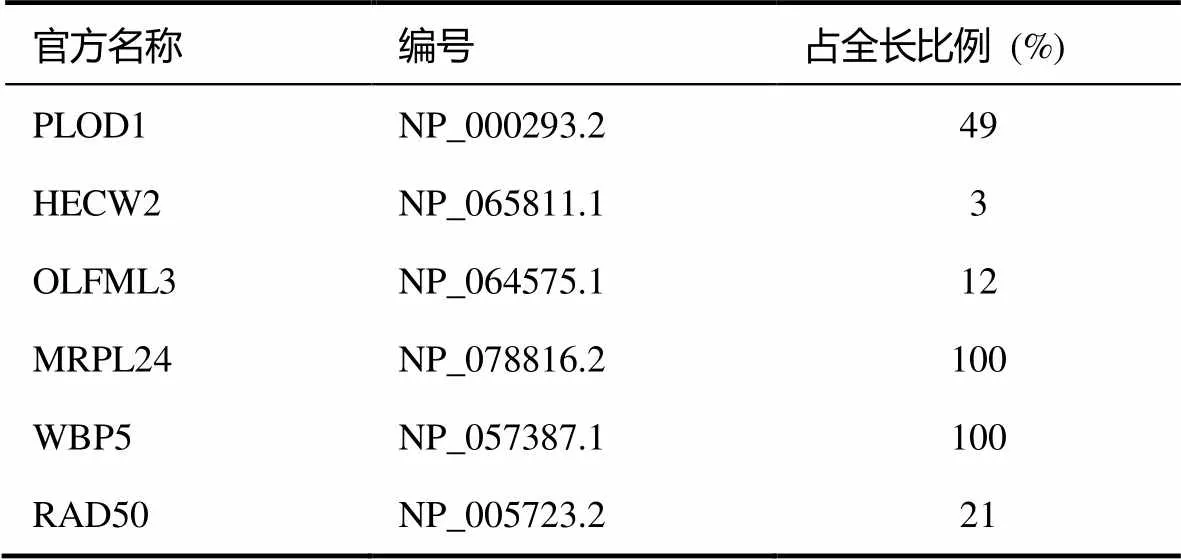
表1 利用酵母菌双杂合系统所得 6个可转译出长段的候选蛋白(其中部分候选蛋白仅包含全长 cDNA 之一部分)
为进一步分析交互作用强度,我们分别制作带有 pAS2- 1-IpaH7.8N(高量表现IpaH7.8 N端的质体)、pGBT9- IpaH7.8N (低量表现IpaH7.8 N 端的质体)、pGBT9-IpaH7.8 (低量表现 IpaH7.8全长的质体) 的酵母菌株,与带有候选蛋白质体的酵母菌株进行交配。
若交配后仅表现his3基因,会因生成腺嘌呤的前导物累积,而呈现红色菌落,我们将此状况的交互作用的强度定为 1 分;若可开启his3和ade2两基因,则菌落呈现白色,定为 2 分;若可开启his3、ade2、mel1三个基因,则可在含 X-α-gal 的培养基上呈现蓝色菌落,定为3分。结果显示候选蛋白中的 WBP5 和 OLFML3与IpaH7.8 N 端有最强的交互作用 (见图1)。

红色菌落 1 分开启 his3 白色菌落 2 分开启 his3 + ade2 蓝色菌落 3 分开启 his3 + ade2 + mel1
2.3 IpaH7.8 与候选蛋白在细胞中的分布
在真实的情况下,若两个蛋白发生交互作用,则需同时出现在细胞的相同区域。因此我们分别在 HeLa 细胞株直接表现与绿色萤光蛋白融合的全长 IpaH7.8,或只有 IpaH7.8 N 端,并利用共轭焦显微镜确认。结果表现全长的融合蛋白时,萤光强度偏低,难以判读,但表现 IpaH7.8 N 端的融合蛋白时,绿色萤光有聚集在细胞核的现象 (图2)。接着,我们查询基因本体 (Gene Ontology) 系统中对候选蛋白在细胞中分布的描述,发现其中 RAD50 会出现在细胞核。
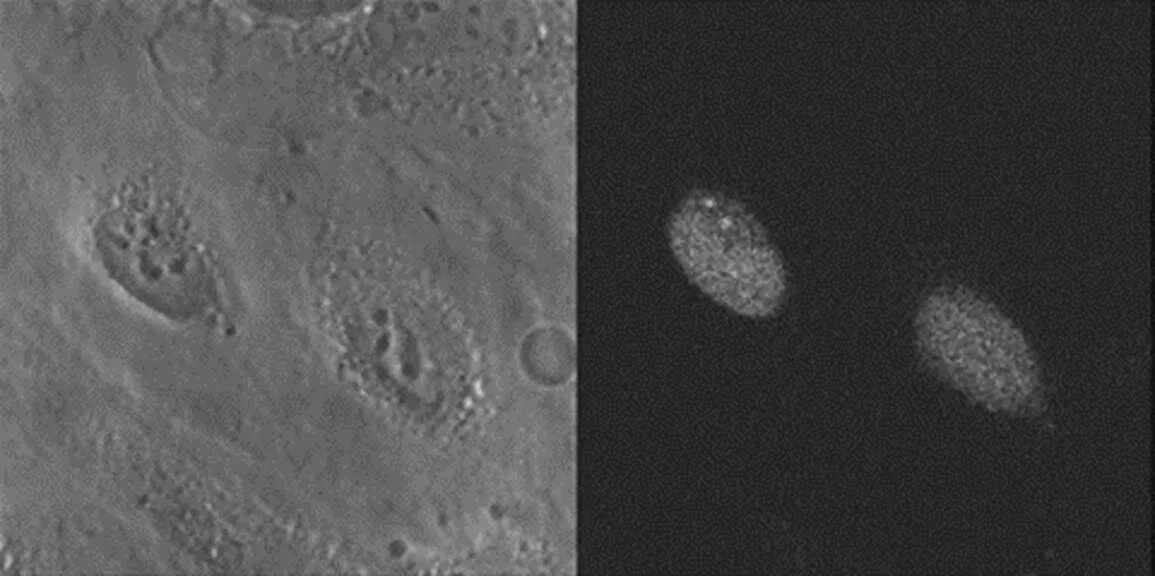
图2 在 HeLa 细胞中直接表现 IpaH7.8 N 端和绿萤光蛋白的融合蛋白,显示绿色萤光聚集在细胞核中。左为相位差影像,右为绿色萤光影像。
2.4 以共同沉淀法验证候选蛋白
我们进一步在候选蛋白的N端接上FLAG标记,转染入 HeLa细胞表现,另一方面利用大肠杆菌生产带有MAT 标记的IpaH7.8的重组蛋白,以共同沉淀法验证两者在生物体外的环境下是否发生交互作用。由西方墨点法结果显示,含有 IpaH7.8的重组蛋白的确可和RAD50结合,而改以IpaH4.5 重组蛋白取代,便无法得到RAD50 (见图3)。

RAD50 Mock IpaH7.8IpaH4.5 IpaH7.8IpaH4.5 Total lysateSupernatantPelletSupernatantPellet Total lysateSupernatantPelletSupernatantPellet Anti Flag-Tag Anti tubulin
3 讨论
从交互作用强度、候选蛋白在细胞中的分布、共同沉淀等结果来说,在我们的候选蛋白中,RAD50是可能性最高的。过去研究指出,RAD50会与MRE11和NBN 蛋白形成复合物[15],辨认DNA双股断裂处,进行 DNA 修复,同时也会透过 ATM 蛋白调控细胞周期,使细胞停留在DNA 合成期 (S phase) 之前[16]。若RAD50受IpaH7.8的结合并接上泛素,可能会改变其功能,或吸引其他因子与RAD50结合[17],而停止细胞周期。如志贺氏菌的另一个分泌蛋白 IpaB,可透过与Mad2L2的作用,使宿主细胞的细胞周期停止,避免宿主细胞内的志贺氏菌因细胞分裂而有机会被排除在细胞外[18]。
我们原先希望在候选蛋白中看到参与调控免疫机制的蛋白,但最后并未发现,从酵母菌双杂合技术层面来说,可能一开始筛选得的二倍体数目并未完整涵盖人类的转录体 (transcriptome),因而错失真正的目标蛋白,或者其目标蛋白在酵母菌表现后影响酵母菌生长,而难以被培养出,这两点也是酵母菌双杂合技术经常遇到的基本问题;此外,也可能 IpaH7.8并不直接调控免疫反应,而是透过其他途径间接影响。若多重复此实验,收集更多候选蛋白加以分析,或有较多机会发现IpaH7.8在细胞中的目标蛋白。
[1] DuPont HL LM, Hornick RB, Formal SB. Inoculum size in shigellosis and implications for expected mode of transmission[J]. J Infect Dis, 1989, 159(6):1126-1128.
[2] P J Sansonetti DJK, S B Formal. Involvement of a plasmid in the invasive ability of Shigella flexneri[J]. Infect Immun, 1982, 35(3):852–860.
[3] Hromockyj AE MA. Identification of Shigella invasion genes by isolation of temperature-regulated inv::lacZ operon fusions[J]. Infect Immun, 1989, 57 (10):2963-2970.
[4] Venkatesan MM BJ, Oaks EV. Surface presentation of Shigella flexneri invasion plasmid antigens requires the products of the spa locus[J]. J Bacteriol, 1992, 174(6):1990-2001.
[5] Le Gall T, Mavris M, Martino MC, Bernardini ML, Denamur E, Parsot C. Analysis of virulence plasmid gene expression defines three classes of effectors in thetype III secretion system of Shigella flexneri[J]. Microbiology, 2005, 151(Pt 3): 951-962.
[6] Hartman AB, Venkatesan M, Oaks EV, Buysse JM. Sequence and molecular characterization of a multicopy invasion plasmid antigen gene, ipaH, of Shigella flexneri[J]. Journal of bacteriology, 1990, 172(4):1905-1915.
[7] Jin Q YZ, Xu J, Wang Y, Shen Y, Lu W, Wang J, Liu H, Yang J, Yang F, Zhang X, Zhang J, Yang G, Wu H, Qu D, Dong J, Sun L, Xue Y, Zhao A, Gao Y, Zhu J, Kan B, Ding K, Chen S, Cheng H, Yao Z, He B, Chen R, Ma D, Qiang B, Wen Y, Hou Y, Yu J. Genome sequence of Shigella flexneri 2a:insights into pathogenicity through comparison with genomes of Escherichia coli K12 and O157[J]. Nucleic Acids Res, 2002, 30(20):4432- 4441.
[8] Ashida H, Toyotome T,Nagai T, Sasakawa C. Shigella chromosomal IpaH proteins are secreted via the type III secretion system and act as effectors[J]. Molecular microbiology, 2007, 63(3):680-693.
[9] Venkatesan MM BJ, Hartman AB. Sequence variation in two ipaH genes of Shigella flexneri5 and homology to the LRG-like family of proteins[J]. Mol Microbiol, 1991, 5(10):2435-2445.
[10] Bell JK, Mullen GED, Leifer CA, Mazzoni A, Davies DR, Segal DM. Leucine-rich repeats and pathogen recognition in Toll-like receptors[J]. Trends in Immunology, 2003, 24(10):528-533.
[11] Okuda J, Toyotome T, KataokaN, Ohno M, Abe H, Shimura Y, Seyedarabi A, Pickersgill R, Sasakawa C. Shigella effector IpaH9.8 binds to a splicing factor U2AF(35) to modulate host immune responses[J]. Biochemical and biophysical research communications, 2005, 333(2):531-539.
[12] Ashida H, Kim M, Schmidt-Supprian M, Ma A, Ogawa M, Sasakawa C. A bacterial E3 ubiquitin ligase IpaH9.8 targets NEMO/IKK gamma to dampen the host NF-kappaB-mediated inflammatory response[J]. Nature cell biology, 2010, 12(1):66-73; sup pp 61-69.
[13] Fernandez-Prada CM, Hoover DL, Tall BD, Hartman AB, Kopelowitz J, Venkatesan MM. Shigella flexneri IpaH(7.8) facilitates escape of virulent bacteria from the endocytic vacuoles of mouse and human macrophages[J]. Infection and immunity, 2000, 68(6):3608-3619.
[14] WANG Fang MH-F, HE Xiang,YUAN Xi-Tong,JIANG Zeng,LIU Da-We, ZHAO Jiang-Li, ZHAO Hong-Qing, YUAN Jing, ZHONG Hui, HUANG Liu-Yu. Functional Analysis of Type ⅢSecretion System Effector IpaH4.5 of Shigella flexneri. China Paper 2010.
[15] Haber JE. The many interfaces of Mre11[J]. Cell, 1998, 95(5):583.
[16] Lim DS, Kim ST, Xu B, Maser RS, Lin J, Petrini JHJ, Kastan MB. ATM phosphorylates p95/nbs1 in an S-phase checkpoint pathway[J]. Nature, 2000, 404(6778):613-617.
[17] Dianov G, Meisenberg C, Parsons J. Regulation of DNA repair by ubiquitylation[J]. Biochemistry (Moscow), 2011, 76(1):69-79.
[18] Iwai H, Kim M, Yoshikawa Y, Ashida H, Ogawa M, Fujita Y, Muller D, Kirikae T, Jackson PK, Kotani S. A bacterial effector targets Mad2L2, an APC inhibitor, to modulate host cell cycling[J]. Cell, 2007, 130(4):611-623.
——有效的抗弓形虫药物靶标

