单巢类轮虫有性生殖的研究进展与展望*
孙 栋,牛翠娟
(北京师范大学生命科学学院生物多样性与生态工程教育部重点实验室,北京 100875)
轮虫是一类体型微小的后生动物,通常体长100 ~1000 μm,目前已知约2000 种,隶属轮虫动物门(Rotifera)[1].一般认为,轮虫动物门包括 3 大类群:单巢纲(Monogononta)(1570 种)、蛭态纲(Bdelloidea)(461 种)和尾盘纲(Seisonidea)(3 种)[2].轮虫动物门3 个主要类群的生殖方式迥异,单巢纲为典型的周期性孤雌生殖(cyclical parthenogenesis),蛭态纲为无性的孤雌生殖(asexual parthenogenesis),而尾盘纲为有性生殖(sexual reproduction).作为轮虫动物门的主体,单巢类轮虫广泛分布于河湖、沼泽和海洋等各类水体,特别是淡水浮游动物的重要组成部分,在河流和湖泊生态系统的物质循环、能量流动和信息传递中起着关键作用.研究单巢类轮虫在自然水体中的种群动态及其决定机制对淡水生态系统管理具有重要的理论和应用价值.作为周期性孤雌生殖的动物,有性生殖的发生和进化对策对单巢类轮虫种群动态和进化都有着根本性的影响,因而一直是轮虫学研究的核心内容.本文就单巢类轮虫有性生殖的最新研究进展做一系统综述,以期为国内相关领域的研究提供参考.
1 单巢类轮虫有性生殖的机理
1.1 轮虫有性生殖的信息素
在单巢类轮虫中,很多证据表明它们使用一些化学信号来调节其生殖方式(即孤雌生殖到有性生殖的转变).早在1960s,Gilbert[3]就证实萼花臂尾轮虫(Brachionus calyciflorus)和角突臂尾轮虫(B.angularis)种群由无性繁殖到有性繁殖的转变是由种群自身释放到水体中的一种化学物质所诱发的.Snell 等[4]证明B.manjavacas(属于褶皱臂尾轮虫(B.plicatilis)种复合体)有性生殖的触发是由一种其自身释放的39 kDa 的蛋白质(被定义为“有性生殖诱导蛋白”,MIP)在水体中积累所致.进一步的研究发现单巢类轮虫有性生殖触发过程与细菌中的群体感应现象(quorum sensing)很相似[5].轮虫有性生殖的另一个重要环节——交配行为,也是由化学信号触发的.目前已经确定在轮虫身体表面存在一种特殊的糖蛋白,被称为“雄性识别信息素”(MRP),当雄虫与雌虫相遇时,这种糖蛋白通过两者的身体直接接触而被体表的性信息素感受器所探知,并完成交配前的物种识别和确认过程[6-7].最近的研究表明MRP 基因属于一个编码一类相似蛋白质的基因家族,因而它可能是单巢类轮虫中存在快速进化现象的一种潜在解释[8-9].
到目前为止,还没有任何一种轮虫的信息素被准确鉴定(解析出其晶体结构),但有大量证据表明单巢类轮虫种群的混交雌体比率可对多种动物的信息素做出反应.这些物质包括脊椎动物的生长激素(vertebrate growth hormone)、孕酮(progesterone)、人体绒毛膜促性腺激素(human chorionic gonadotropin)、17β-雌二醇(17β-estradiol)和三碘甲状腺氨酸(triiodothyronine)以及昆虫中的类固醇二十羟基蜕皮酮(steroid 20-hydroxyecdysone)和保幼激素(juvenile hormone)[10-12].尽管上述研究都没有准确测定轮虫体内的被试物质含量与培养液中此物质含量的关系,而且培养液中的被试物质浓度可能与轮虫体内此物质的浓度差异极大,同时这类物质在轮虫体内的吸收和代谢途径也远未明晰,但考虑到这些物质的水溶性特征和在自然界中分布的广泛性,这些实验结果都暗示某种类固醇类(steroid)的内源性物质可能在单巢类轮虫有性生殖的调控过程中起着核心作用.
另外,研究证实某些药物、杀虫剂和有机化合物可对水生动物内分泌系统造成干扰[13].在单巢类轮虫中,人们也发现水体中常见的内分泌干扰物质,如壬基苯酚(nonylphenol)、睾酮(testosterone)、氟他胺(flutamide)、早熟素(precocene)、抗雄性激素杀螟松(anti-androgens fenitrothion)和环丙氯地孕酮(cyproterone acetate)等都可显著影响萼花臂尾轮虫的有性生殖和休眠卵生产[14-15].这些实验证据启示单巢类轮虫的有性生殖对于雄激素及其拮抗物质干扰的敏感度可能要高于雌激素类物质的干扰,同时也进一步支持类固醇类物质可能是单巢类轮虫有性生殖过程关键信息素的观点.
1.2 轮虫卵母细胞的发育过程及外源物质影响其发育的信号通路
在很多动物中,卵母细胞的发育过程都受到各种信号转导通路的紧密调控[16].但在轮虫中,调控卵母细胞发育过程的信号转导通路至今尚未完全阐明.在轮虫中卵母细胞的成熟是连续性的,而卵黄腺产生的卵黄物质开始注入到卵细胞中标志着这一系列过程的起始[17].近期研究表明,母体产出后代的生殖类型(混交雌体或是非混交雌体)在其产卵前较短时间内才被确定,大约是卵细胞在卵巢内发育的时段[18];同时研究发现当母体暴露于含有一定浓度孕酮的培养液中时,后代的生殖类型会受到影响[12].这暗示通过抑制某些卵母细胞发育信号通路上关键基因的表达就可以人为改变它们后代的生殖类型[19].
目前认为单巢类轮虫卵母细胞发育过程的内分泌信号有两种可能的通路:一种可能的途径是体外的有性生殖诱导信号穿越轮虫的体壁,直接作用于卵母细胞,并导致卵母细胞发育过程中的特定基因表达发生改变,从而产生混交雌体.具体来说,这种途径中对有性生殖诱导信号的受体可能直接存在于卵母细胞表面,也可能存在于卵黄腺,通过卵母细胞发育过程中卵黄物质的注入而将信息间接传递给卵母细胞,也可能两者皆有.另一种可能是卵母细胞和卵黄腺都没有信号受体,或者体外的有性生殖诱导信号无法穿透轮虫体细胞到达生殖腺,而受体存在于轮虫体细胞(更可能是存在于体表).体细胞的受体接受信息后通过神经系统或是其他体内的信息传递方式将有性生殖的诱导信号传递至生殖腺和生殖细胞[20].
2 单巢类轮虫有性生殖发生的诱导因素
到目前为止,已经有3 种环境因子被证实可诱导单巢类轮虫的孤雌生殖母体产生有性后代,进一步诱导种群发生有性生殖.这3 种环境因子包括种群密度信号、食物中的维生素E 和长的光周期.
2.1 种群密度信号
密度效应(crowding effect)是单巢类轮虫中研究最为广泛同时也是最早发现的一种有性生殖诱导信号[21].实验室研究在褶皱臂尾轮虫种复合体[4,22-24]、萼花臂尾轮虫[25-26]、角突臂尾轮虫、臂尾水轮虫(Epiphanes brachionus)、椎尾水轮虫(E.senta)、前额犀轮虫(Rhinoglena frontalis)[27]和颤动疣毛轮虫(Synchaeta tremula)[28]中都发现高的种群密度可以诱导有性母体的产生.同时野外观察的证据也支持这个结论[29].在其他周期性孤雌生殖的浮游动物(如枝角类)中,也有很多证据表明高的种群密度可以诱导种群发生有性生殖[30-31].如此广泛的实证表明,高种群密度会诱导种群进行有性生殖在整个单巢类轮虫中可能是一种普遍现象.
近期研究证实在褶皱臂尾轮虫中这种诱导种群发生有性生殖的物质是一种39 kDa 的蛋白质[4].尽管在其他轮虫种类中有性生殖诱导信号物质并未得到深入研究,但考虑到有性生殖诱导信号所必须具备的种间特异性(见下文论述)和保守性特征,其他的单巢类轮虫很可能也是采用类似蛋白质作为诱导信号(MIP)[4,32].在自然水体中,某一特定轮虫物种的MIP 浓度取决于轮虫种群释放积累速率和水体中细菌分解速率的平衡.其中轮虫释放MIP 的速率主要取决于轮虫种群大小、年龄结构和种群增长率,水体中MIP 分解的速率则主要与温度和细菌群落构成有关[32].最近的模型研究还认为轮虫种群释放MIP 很可能存在一种正反馈机制,即水体中MIP 的积累会促进轮虫种群加快释放MIP 的速率[33],但是更为确凿的实验证据目前仍然很缺乏.
2.2 食物中的维生素E
关于食物中的维生素E 诱导轮虫发生有性生殖的研究集中于晶囊轮虫属(Asplanchna)的几个种类,其中包括卜氏晶囊轮虫(Asplanchna brightwelli)、间型晶囊轮虫(A.intermedia)和西氏晶囊轮虫(A.sieboldi).当孤雌繁殖的晶囊轮虫母体摄入富含维生素E(即α-生育酚)的食物时,它们就可以生产混交后代[34-35].事实上,维生素E 很可能是通过直接控制晶囊轮虫非混交雌体的多态性(一种晶囊轮虫特有的体型大小和身体结构发生显著改变的现象,并非诱导防御现象)而影响后代的生殖方式.关于食物中维生素E 诱导轮虫产生有性生殖后代的生态意义,Gilbert 进行了详细讨论:在自然水体中维生素E 只能由绿藻和高等植物合成,因而捕食性的晶囊轮虫只有通过摄食植食性轮虫(例如臂尾轮虫和龟甲轮虫等)才可能摄入充足维生素E.有研究发现富含维生素E 的食物可以诱导晶囊轮虫的体型和结构发生显著变化:孤雌生殖的雌体体型增大,同时具有显著宽阔的头冠部(称为“钟型”,campanulate morphotype),这些体型和结构的变化有利于晶囊轮虫进一步扩大食物范围,使得它们能够捕食较大的轮虫和甲壳类的猎物[32,35].高的维生素E 摄入量意味着环境中食物丰富(尤其是可以为晶囊轮虫提供丰富营养的植食性轮虫),随着种群密度上升,雌雄个体的相遇概率也增大,同时丰富的食物可以允许受精雌体为休眠卵提供更为丰富的营养储备(主要是脂类物质)[35],因此对于晶囊轮虫来说,食物中维生素E 的丰富程度可以作为环境中食物丰富程度和晶囊轮虫种群密度的良好指示.
2.3 长的光周期
到目前为止人们仅在椎轮属(Notommata)和异尾轮属(Trichocerca)中发现长的光周期可诱导孤雌生殖种群产生混交个体[36-37].光周期作为一种信号的特点是高度的稳定性和可预测性.当轮虫将光周期与环境条件及种群密度联系时,长的光周期意味着合适的水温和环境条件以及随之而来的种群密度上升,这些都符合资源需求假说和雌雄相遇假说(两个假说内容见下文论述).但是光周期作为有性生殖诱导因素的基本前提是轮虫生活环境中的各种条件(特别是食物丰富程度以及随之而来的种群密度)与光周期强烈而且稳定地关联,这点在臂尾轮虫属和晶囊轮虫属显然是不具备的,因而这些类群的轮虫只有依靠与自身所处环境条件更为直接相关的因素(例如种群密度)而不是极端稳定和可预测的光周期来作为有性生殖的诱导因素[32,38].
3 有性生殖诱导信号的物种特异性
衡量周期性孤雌生殖轮虫长期适合度的合理指标是一个生长季内休眠卵的生产量[21],而在较高的种群密度下进行有性生殖有利于雌雄个体的相遇和交配,因而有助于提高休眠卵产量.如果同域共存的多个轮虫物种的有性生殖诱导信号没有种间界限,那么先萌发的物种在水体中积累的MIP 就会让后萌发的物种在种群密度仍然较低时面临高的MIP 浓度(从而触发种群的有性生殖).而此时如果后萌发物种的种群被触发有性生殖,那么此物种的种群增长率将受到极大抑制,同时产生的休眠卵总数量也会较少.因而理论上说,在温带水体中分布的单巢类轮虫,其有性生殖诱导信号(MIP)应该存在显著的种间隔离机制,即MIP 的物种特异性[39].但迄今为止只有少数研究探讨了有性生殖诱导信号在浮游动物中的种特异性问题,主要集中于枝角类水蚤属和单巢类轮虫臂尾轮属[40-41].
近期有两个更为系统的实验探究了臂尾轮虫类的有性生殖诱导信号物种特异性的问题.Gilbert[25]发现萼花臂尾轮虫北美品系和澳洲品系个体释放的MIP 都可以诱导同品系其他个体产生有性个体,但是不能诱导对方品系个体产生有性个体.这表明萼花臂尾轮虫的有性生殖诱导存在分类上(地理品系间)的特异性.后续的分子系统学和交配实验研究表明,澳洲品系很可能是萼花臂尾轮虫种复合体内的一个隐种[42].Stelzer 等[43]利用核糖体ITS1 序列构建了褶皱臂尾轮虫种复合体内5 个不同地理隐种间的系统发育树,并与它们相互之间的有性生殖诱导特异性进行了比较.结果并未发现种复合体内的地理隐种间在有性生殖诱导方面存在特异性,而且也与系统发育关系无关.为什么在萼花臂尾轮虫种复合体和褶皱臂尾轮虫种复合体内隐种间得到的结论完全不同?目前尚无实验证据或理论假说很好解释此差异.不过有实验证据表明在单巢类轮虫的部分类群(包括萼花臂尾轮虫和褶皱臂尾轮虫)存在有性生殖延迟现象(详见下文论述)[27,44]和交配行为上的生殖隔离[42,45],这可能是这种不依赖于有性生殖诱导信号种间特异性的隐种共存的一种解释.
4 关于单巢类轮虫有性生殖发生时刻的假说
实验室和野外研究都发现单巢类轮虫有性生殖的发生时刻及种群中有性个体的比率通常都与种群密度紧密相关[24,29].关于单巢类轮虫种群有性生殖的发生,目前主要有3 个假说.
4.1 环境恶化假说(habitat deterioration hypothesis)
环境恶化假说认为由于周期性孤雌生殖动物有性生殖的发生可以显著抑制种群的增长[46],因而在环境条件适宜时它们进行孤雌生殖快速扩大克隆种群,而有性生殖应该在环境条件恶化时发生[47].在环境恶化时进行孤雌生殖产生休眠卵有两个优势:一是可以借助休眠卵的形式渡过不良环境条件;二是有性生殖和基因重组带来的遗传上的多样性有利于种群在未来的生长季适应新的环境.
4.2 雌雄相遇假说(male-female encounter hypothesis)
雌雄相遇假说的前提是雌雄个体在水体中的相遇是随机的,随着种群密度的增加,这种相遇的概率和受精的成功率也随之增大[48],这样可以保证克隆种群产生尽量多的休眠卵.如果种群在低密度下即大量进行有性生殖,不仅受精成功率低,而且还要显著牺牲种群在一个生长季内的增长潜力和竞争能力(均依赖孤雌生殖)[21,49].
4.3 资源需求假说(resource-demanding hypothesis)
在自然环境中,种群密度较高的时期通常也与食物条件适宜的时期,在此时种群进行有性生殖除了可以有利于雌雄相遇之外,丰富的食物还有利于受精雌体产生数量较多且质量较好的休眠卵(其中储存的脂类物质含量较多)[32,35].Snell 等[23]发现在褶皱臂尾轮虫中种群的最低可增长食物浓度要远远低于种群进行有性生殖所需的最低食物浓度.而最近关于萼花臂尾轮虫休眠卵生产与环境食物条件关系的研究中,下列两个假说得到证实:第一,混交雌体生产休眠卵所需要的最低食物浓度要远高于非混交雌体生产非混交卵的食物需求;第二,当环境中食物浓度较低时,混交雌体生产休眠卵的数量较少(净生殖率低),只有当食物条件适宜时混交雌体休眠卵的生产量才能够达到最大值[50].上述研究都表明单巢类轮虫成功进行有性生殖并产下正常的休眠卵所需要的食物条件要远高于种群增长所需要的食物阈值,即从食物资源的角度来说有性生殖和休眠卵生产只能在食物条件适宜的环境中发生.
5 单巢类轮虫有性生殖发生的几个理论模型
周期性孤雌生殖动物(例如单巢类轮虫)有性生殖的发生对于其种群增长有着显著的代价[46,51].孤雌生殖带来的种群快速增长可提高某一物种或基因型的竞争能力,在捕食风险存在的环境中这一点更为重要.而有性生殖产生的休眠卵又是种群渡过不良环境所必须的形式,因此休眠卵产量是某一物种或基因型的长期适合度指标[21].在周期性孤雌生殖动物的生活史中,一个核心问题是种群如何权衡孤雌生殖和有性生殖.
很多单巢类轮虫都生活于不同程度的暂时性生境中.对于不同物种来说,每一个可利用生长季节的长度从几天到几个月不等.例如,对分布于北美洲Chihuahuan 沙漠中的一种六腕轮虫Hexarthra sp.来说,由于沙漠中降雨很少且很快蒸发,因而它们的每一个生长季节就只有几天,而且长度和间隔都高度不可预测[52].而对于温带淡水湖泊中常见的萼花臂尾轮虫,其每一个生长季可长达几个月,而且年际变化不大.正是基于轮虫生境的暂时性特征,Serra 等[51]提出了轮虫种群有性生殖发生的“bang-bang”策略模型(图1a).此模型认为,周期性孤雌生殖轮虫种群的有性生殖存在一个0 或1 的策略,即当某一生长季内轮虫种群达到一个较高的阈密度(图1a 中的“有性生殖起始”密度)后种群只会生产有性个体,而有性生殖对当前的种群增长没有贡献,同时由于个体的自然死亡和被捕食造成的种群密度下降会让种群达到一个较低的阈密度(图1a 中的“有性生殖终止”密度),此时有性生殖完全消失,种群回到完全的孤雌生殖方式以快速增殖,随后进入下一个“有性生殖起始/终止”周期.
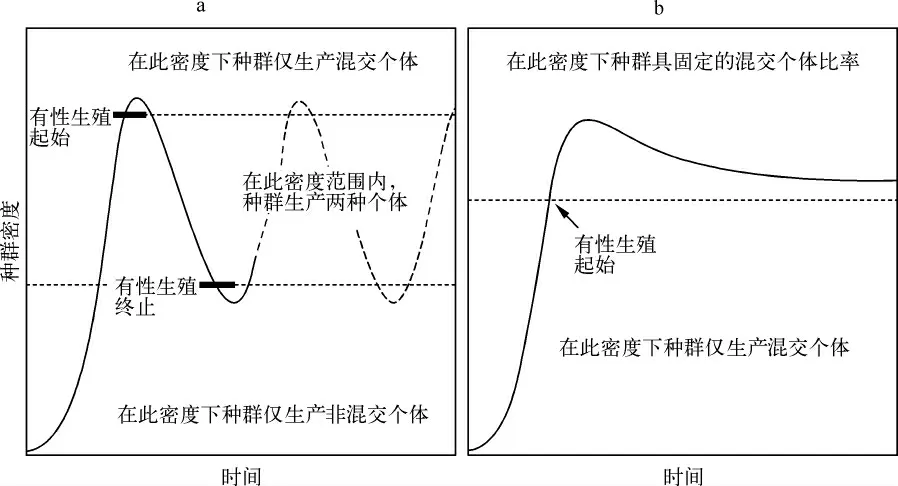
图1 单巢类轮虫有性生殖的理论模型(a:“bang-bang”策略模型;b:中等有性生殖比率模型)[21]Fig.1 Two models of sexual reproduction in the monogonont rotifers(a:“bang-bang”model;b:intermediate mictic ratios model)
理论模型的模拟还发现在这种有性生殖模式下有性生殖的最佳时刻(即生长季内总的休眠卵产量最高)是种群的死亡率刚刚超过出生率之时,这时种群中新生的个体将全部为有性个体,直到种群密度低于“有性生殖终止”密度.如果自然水体中的轮虫种群也是采取这种“bang-bang”策略,那么如果连续监测的话应该可以观察到某一时段出现极高的有性个体比率,但是野外观察数据并不支持这种“bang-bang”策略.例如,Carmona 等[29]在1992年7月到1993年11月间连续监测了西班牙地中海沿岸3 个小型咸水湖中褶皱臂尾轮虫种群的动态,发现多数种群在大部分时间采取以孤雌生殖为主的繁殖方式,所有样本中有性个体的比率为0 ~29%之间.最高29%的有性个体比率显然并不支持上述的“bang-bang”策略模式.实验室内关于轮虫种群生态学的研究也发现在各种培养条件下轮虫种群中有性个体的比率一般不超过50%[40,53].上述野外观察和室内实验的结果表明,温带湖泊中单巢类轮虫的有性生殖采取此种策略模式的可能性并不大.
自然水体中进行的食物添加实验证实温带湖泊中的轮虫种群经常处于食物限制的环境中[54],因此在一个生长季节内轮虫的种群增长通常是密度依赖性的.基于轮虫这种密度依赖性的种群增长模式,Serra 等[21]提出了一个密度依赖性轮虫种群的最佳有性个体比率模型:

式中,m 为有性个体比率,种群中有性雌体数量与种群中总雌体数量的比值;其中,此模型中假定在一个生长季内,某一特定克隆种群的有性个体比率为一恒定值;mo为最佳有性个体比率,在此有性个体比率下,种群一个生长季内的休眠卵产量最高;q 为种群的死亡率;b 为种群的出生率.
对于一个特定的克隆种群,当环境条件好转时,死亡率下降、出生率上升,此时种群的最佳有性个体比率上升;反之,当环境恶化时(例如种群的快速增长导致的食物缺乏),死亡率上升、出生率下降,种群的最佳有性个体比率随之下降.自然水体中的轮虫种群出生率通常大于死亡率(至少在整个生长季节的大部分时间是这样),根据上述模型,轮虫种群应采取中等的有性生殖比率,而不是“bang-bang”策略模型的0 或1 比率.这一结论也与早期Snell 模型的模拟结果相吻合:根据13 个褶皱臂尾轮虫地理品系的生命表实验数据[55]修正了模型中的种群增长率参数后,此模型模拟出褶皱臂尾轮虫种群的最佳有性生殖比率在10% ~50%之间;而综合多个实验结果得到的褶皱臂尾轮虫种群平均有性个体比率为21.20% ±3.84%(变化范围为0 ~ 50%)[46].
这个模型的前提假设就从另一方面解释了为什么“bang-bang”策略模型预测的有性生殖模式很难在实际观察中发现:由于通常温带水域分布的单巢类轮虫生活于食物受限制的环境中[54],而种群在这种相对稳定和食物作为主要限制因子的环境中显然是一种密度依赖性的增长(即有一个食物条件决定的环境容量K),此时轮虫种群更倾向于采取中等的有性生殖比率(图1b);只有当种群长期处于一种高度可预测的临时性环境,同时种群在生长季内的主要限制因子不是食物而是像灾变性的干旱等突发性限制因子时,“bangbang”有性生殖模式似乎才有可能在轮虫种群中被保留下来[21].
多个轮虫有性生殖发生的模型都发现有性生殖对种群增长有着显著的代价[21,46].Serra 等[21]认为也可以从有性生殖的代价角度解释为什么环境条件适宜时种群的最佳有性个体比率会上升:

式中,RCm为种群有性生殖的相对代价(relative cost of mixis),m 为有性个体比率,q 为种群的死亡率,b 为种群的出生率.
模型的说明:b·m 可以视为种群进行有性生殖对种群增长的绝对代价,b-q 可以认为是没有有性生殖时种群的增长率,因而b·m/(b-q)即为有性生殖对种群增长的相对代价.如果种群的有性个体比率不变,当环境条件好转时,b 上升、q 下降,有性生殖的相对代价下降,这里计算的种群有性生殖的相对代价是针对短期适合度的,由于种群的短期适合度(一个生长季内的种群增长)和长期适合度(生长季内的休眠卵产量)存在着权衡关系[46,49],因此当种群有性生殖导致的短期适合度代价下降时,选择压力将会偏好种群提高有性生殖比率以获得更高的长期适合度.

表1 环境的可预测性与轮虫种群的有性生殖策略*Tab.1 The relationship between the environmental predictability and the sexual reproduction strategy in the monogonont rotifers
6 影响单巢类轮虫有性生殖的主要外在因素
人们在长期的研究中还发现,有一些环境因子虽然不能够直接诱导轮虫发生有性生殖,但可以显著影响轮虫的有性生殖策略,如改变种群的有性生殖阈密度等.目前已知的主要外在因素有食物、温度、盐度、特殊的细菌等.
6.1 食物
单巢类轮虫有性生殖对食物条件的要求要显著高于孤雌生殖.如Snell 等[57-58]发现食物种类可显著影响褶皱臂尾轮虫的休眠卵和雄性个体生产:适宜环境下饲喂褶皱臂尾轮虫普通小球藻Chlorella vulgaris 和Baker's 酵母混合的食物时,其休眠卵和雄性个体的产量显著高于饲喂其相同碳浓度的一种蓝藻Schizotrix calcicola 时的产量;研究的同时发现轮虫种群进行有性生殖需要更高的食物浓度:当培养液中盐藻Dunaliella的浓度为1.53×104cells/ml 时,轮虫有性个体生产就会停止,但孤雌生殖直到培养液中盐藻浓度低至1.50×103cells/ml 时才会停止[23].在萼花臂尾轮虫中也发现类似的现象.当培养液中的啮蚀隐藻(Cryptomonas erosa var.reflexa)浓度为1.25×103cells/ml(极低的食物浓度)时,孤雌生殖个体的净生殖率为1.4,而有性生殖个体产生休眠卵的净生殖率仅为0.9[50].
6.2 温度
一些室内实验发现温度可影响轮虫种群中有性个体的比率,但这种影响并不具有一致性.例如,Hagiwara 等[59]发现培养温度为15℃时褶皱臂尾轮虫种群的有性个体比率要高于培养温度为20、25 或30℃时的种群,这似乎可以解释为低温下种群的有性生殖阈密度更低;然而在臂尾水轮虫中发现了相反的趋势[60].面临环境温度变化时,这种有性生殖倾向性的种间差异可能与自然水体中此物种的种群动态与水温的相关性有关.假设在自然水体中,上述实验中的轮虫在其一个生长季中于水温15℃左右时,其最适食物种类的密度最高,由于有性生殖和生产休眠卵需要更多的能量,因此此时是种群进行有性生殖的最佳时刻.如果这种食物条件和环境温度的相关性是相对稳定的,即种群可以通过水温来预测环境中的食物条件,那么长期的选择压力就有可能导致这个种群在15℃下更倾向于进行有性生殖.
6.3 盐度
水体盐度是影响很多咸水轮虫生活史与分布的重要因子.近期研究表明咸水湖泊中的盐度异质性很可能是褶皱臂尾轮虫种复合体内隐种同域共存现象的一个重要原因[61].大量研究证实盐度对轮虫的有性生殖也有显著影响.例如,Lubzens 等[62]发现褶皱臂尾轮虫种群在盐度为4‰ ~20‰的培养环境中种群的有性个体比率最高,盐度低于或高于此范围时有性个体比率急剧降低,表明某些盐度范围有利于有性生殖发生.Snell[63]关于环境对褶皱臂尾轮虫种群有性生殖净生殖率影响的研究也发现了类似规律,并且认为相比于孤雌生殖,有性生殖更易受环境限制.褶皱臂尾轮虫种复合体内的不同隐种有不同盐度偏好[61],而且在不同盐度下的有性生殖倾向性也有显著差别.如Hagiwara 等[64]发现褶皱臂尾轮虫的“L”型种群(事实为一个隐种)在8‰的低盐度环境中更倾向于有性生殖,随着水体盐度的升高,其有性生殖受到显著抑制;而“S”型种群(另一个隐种)的反应与之相反,其在32‰的高盐度环境中更倾向于有性生殖,随着水体盐度的降低,其有性生殖受到显著抑制.
6.4 特殊的细菌
关于水体中细菌直接影响轮虫有性生殖的研究很少,目前只有Hagiwara 等[65]研究了水体中人为添加特定细菌对褶皱臂尾轮虫有性生殖的影响.研究发现当水体中添加少量假单胞菌(Pseudomonas)、莫拉氏菌(Moraxella)或微球菌(Micrococcus)时,褶皱臂尾轮虫实验种群的有性个体比率相比于对照组上升了4 ~10倍.尽管目前对该现象尚无确切的解释,但猜测可能是由于这些细菌向水体中释放了结构上类似于可诱导种群发生有性生殖的轮虫密度信号类的代谢物质,从而极大提高了种群的有性个体比率.此外,水体中的细菌对轮虫的有性生殖可能还有一种潜在的间接影响:在自然水体中,单巢类轮虫有性生殖诱导信号(即种群密度信号)的积累是一个轮虫种群向水体中不断释放与水体中的细菌不断分解之间的平衡过程[32],因而特定细菌群落的存在可能加速或减慢这种分解过程,进而改变水体中轮虫有性生殖信号的积累速率,并间接对有性生殖造成影响.考虑到自然淡水水体中细菌所占的巨大生物量[66],关于水细菌的群落结构和代谢活动对轮虫自然种群有性生殖的影响尚需进一步研究.
7 影响单巢类轮虫有性生殖的主要内在因素
关于影响单巢类轮虫有性生殖内在因素的研究远不如外在因素的研究广泛,到目前为止只有母体年龄(即后代的出生顺序效应)的影响、食物因素导致的泛代母系效应的影响和有性生殖延迟(一种泛代表型可塑性)等三个主要方面得到实验证实.
7.1 母体年龄
早在1940s,人们就在轮虫中发现母体年龄(即后代的出生顺序)的多代积累效应可以对后代的一些生活史特征造成持续的影响[67],后来的研究进一步证实这种现象在轮虫中是普遍存在的[68-69].近期的研究表明母体年龄还可以影响轮虫后代的棘刺长度和休眠卵的形态及孵化率等[70-71].
在单巢类轮虫中,有实验证据表明母体有随年龄增长,所产生有性后代比例降低的倾向.目前已知符合此规律的种类有萼花臂尾轮虫[72-73]、红臂尾轮虫(B.rubens)[72]和褶皱臂尾轮虫[74]等.Carmona 等[74]使用克隆种群的褶皱臂尾轮虫自交得到一些休眠卵,然后分别孵化并各自建立新的克隆种群,结果发现这些克隆种群在有性生殖倾向性方面差别显著,由年轻母体生产的休眠卵所建立的克隆种群中有性个体比率高于年老母体生产的休眠卵所建立的克隆种群,表明休眠卵产生时的母体年龄对后代的有性生殖策略产生了显著影响.但是后来的研究还发现单巢类轮虫后代有性生殖倾向性与母体年龄的这种规律并不像之前认为的那样稳定,在一些褶皱臂尾轮虫和萼花臂尾轮虫品系中后代有性生殖倾向性与母体年龄无关[75-76].Lubzens等[77]报道在其研究的褶皱臂尾轮虫品系中母体繁殖中期生产的后代表现出最大的有性生殖倾向性.在一些萼花臂尾轮虫品系中也发现此现象[78].
上述的大量研究证据表明单巢类轮虫的母体年龄与后代有性生殖倾向性之间的关系存在高度的多样性,这种多样性存在于种间、品系间和克隆间等不同水平.目前关于这个方面还有以下几点尚不清楚:第一,单巢类轮虫表现出的这种高度多样性是由基因决定还是依赖于环境条件亦或是两者的共同作用?第二,如果是基因决定的,则是由细胞核基因决定还是细胞质遗传(母系遗传)?第三,如果证实是依赖于环境条件的,那么这种多样性的适应意义是什么?关于上述方面还有待进一步的实验证明.
7.2 食物因素导致的跨代母系效应(transgenenrational maternal effect)
从轮虫休眠卵中直接孵化出的雌体通常称为干雌体(stem female),它们具有一些适合繁殖高质量的后代以便快速建立克隆种群的生理特征,例如身体具有显著较高的脂质含量等[79].Hino 等[53]发现改变褶皱臂尾轮虫干雌体培养环境中的食物浓度可以对随后的整个克隆种群有性生殖的倾向性产生持续多代的影响,这可能是由于干雌体对环境中食物条件的变化更为敏感,同时环境变化对干雌体的影响可以通过母体的细胞质遗传给后代,从而产生多代的持续效应.Hagiwara 等[80]也发现褶皱臂尾轮虫干雌体生命早期经历的饥饿环境(饥饿12 h,对照组为不经历饥饿环境)可以显著提高其后代的有性生殖倾向性,并且这种影响可以在第8 代之后变得极为显著;与此相比,从非混交卵中孵化出的孤雌生殖雌体经历相同的饥饿环境却不能够产生持续多代的显著的母系效应.关于食物因素导致的泛代母系效应对后代有性生殖策略的影响方面,目前的研究仍然很缺乏,进一步的研究应该更加关注以下方面:一,这种现象目前仅在褶皱臂尾轮虫中得到证实,在其他轮虫,特别是在休眠卵萌发时期常常面临水体中低食物浓度的淡水植食性轮虫(如萼花臂尾轮虫)中是否也有此现象;二,从模型和实证上揭示这种现象的适应意义.
7.3 延迟的有性生殖——一种跨代表型可塑性
早在1970s,人们在研究褶皱臂尾轮虫种群有性生殖时就发现随着从休眠卵中孵化出个体传代数的增加,非混交雌体产生混交雌体后代的倾向性增加,即种群更倾向于进行有性生殖[53].后来,Gilbert[44]详细研究了萼花臂尾轮虫一个Florida 品系的有性生殖策略后确定在一些克隆中的确存在这种规律,并认为这对于温带水域中生长季长度有限的单巢类轮虫是一种进化适应策略.下面本文将从理论模型和实验证实两个方面详细讨论这个现象.
7.3.1 延迟的有性生殖:理论模型 以密度依赖型种群增长时的有性生殖策略模型[21]为基础,Serra 等[39]发表了一个可以模拟轮虫种群增长过程中存在有性生殖延迟现象时的有性生殖模型.其模型中出生率、死亡率和种群内禀增长率等参数均来自于褶皱臂尾轮虫的研究结果.限于本文的篇幅,具体的推导过程这里不再赘述.这里笔者主要讨论一下基于实验和野外观察得到的参数而进行的模型模拟结果.
此模型的基本假定是生长季内存在多个萌发时刻不同的克隆,同时克隆种群的有性生殖阈密度没有显著差异,且克隆间不存在有性生殖诱导信号(MIP)的特异性.依据已有的研究结果,在单巢类轮虫中上述3个前提假定是部分得到证实的[43,81].在这种情况下,一个生长季内较早萌发的克隆将迅速扩大种群并在水体中积累MIP,而后萌发克隆的有性生殖诱导如果没有传代数的延迟,则刚刚萌发在种群密度很低时即被水体中已经存在MIP 诱导发生有性生殖.由于有性生殖对种群增长的显著代价[21,46],后萌发克隆种群的短期适合度将显著低于早萌发种群.由于克隆种群的有性生殖发生在低种群密度下,雌雄相遇的概率小,因而有性生殖的成功率低,同时由于有性生殖发生在种群规模较小时,因而总的休眠卵产量也较低[46],这些都导致后萌发克隆基因型的长期适合度较低.相反,如果后萌发克隆具有延迟的有性生殖策略,那么就可以大大提高基因型的短期适合度和长期适合度.
基于进化稳定对策(ESS)理论[82],Serra 等还模拟了具有延迟的有性生殖策略的基因型对不具有这种策略基因型的入侵性[39].侵入模型的研究发现:(1)当具有此种策略的基因型的种群具有14%的种群有性个体比率和9 d 的有性生殖延迟时间时,对不具有这种策略的种群入侵性最强;(2)有性生殖延迟的时间短于7 d 或超过11 d 都会对采取此策略基因型的适合度造成显著代价;(3)某一基因型即使具有延迟的有性生殖策略,其长期的进化优势也很小,概略的估计为经过40 个生长季后,具有9 d 最佳延迟时间策略的基因型相比于不具有任何有性生殖延迟策略的基因型在基因型频率上的优势不会超过0.05,因而同一水体中几种具有不同策略的基因型是可以长期共存的.
关于Serra 等[39]模型和ESS 可侵入性模型模拟结果,本文主要讨论下面几个问题:
第一,模型模拟得出当具有此种策略的基因型的种群具有14%的种群有性个体比率和9 d 的有性生殖延迟时间时,对不具有这种策略的种群入侵性最强.而基于相同前提假设和模拟参数(种群为密度依赖型增长和褶皱臂尾轮虫的种群增长数据)的Serra 等[21]模型得出褶皱臂尾轮虫种群的最佳有性个体比率为45%.两个模型得出的最佳有性个体比率都相差极大,对此Serra 等给出的解释是早期的模型仅仅考虑到水体中存在一个基因型的情况,而ESS 可侵入性模型则着重研究水体中存在多个基因型时的情况:当不同基因型的克隆种群同域共存时,克隆种群间的竞争能力(主要取决于孤雌繁殖方式的种群增长率)是一个必须要考虑的因素,而某一基因型具有较高的有性个体比率(如Serra 和King 模型中得出的45%)显然不利于其在一个生长季内基因型间的竞争能力.相比较而言,ESS 可侵入性模型则综合考虑了生长季内不同克隆间(基因型间)的竞争能力和整个生长季内生产休眠卵的数量,因而可能更为合理.另外,实证数据也更倾向于支持ESS 可侵入性模型:综合多个有关褶皱臂尾轮虫实验结果和野外观测数据得出的最佳有性个体比率为21.20% ± 3.84%[46].
第二,关于最佳的有性生殖延迟时间(传代数),当前模型得出在褶皱臂尾轮虫中大约为9 d,同时认为超过11 d 时延迟的有性生殖带来的适合度优势将会迅速下降.到目前为止并没有关于褶皱臂尾轮虫有性生殖延迟时间(或代数)的实验数据,而在同属的萼花臂尾轮虫一个Florida 品系中,轮虫从干雌体生出后第5 ~8代的有性生殖倾向性(约10%~20%)要显著高于刚从干雌体中生出的第1 代,同时要显著低于12 代之后的种群(约40%~50%)[44],这表明这个品系的萼花臂尾轮虫有性生殖延迟的代数(受到内源因素抑制的代数)不低于8 代.在20℃食物适宜的环境中,萼花臂尾轮虫通常36 ~48 h 一代(笔者本人的观察),因而这里的有性生殖延迟的时间大约为12 ~16 d.考虑到褶皱臂尾轮虫具有更高的种群增长率(适宜条件下其种群增长率可达到1.0 d-1[83]),因而上述模型模拟得出的最佳有性生殖延迟时间很可能是合理的.
第三,ESS 可侵入性模型模拟结果表明轮虫种群采取延迟的有性生殖策略可带来一定的适合度优势,尽管其长期进化优势很小(40 个生长季后仅达到不超过0.05 的基因型频率变化).然而考虑到轮虫世代周期很短且水域环境中种间及种内不同基因型间激烈的竞争,很小的适合度劣势都可能导致物种或基因型的灭绝.实证表明这种有性生殖延迟策略在单巢类轮虫中尽管大量存在,却并非是一种普遍存在的规律[27,44],其原因何在?对此笔者提出下面几个可能的解释.
1)轮虫生活水域的环境(主要是食物条件)存在明显的年际间波动(即存在波动的选择压力)[81].当某一生长季内的食物条件非常适宜,此时那些没有有性生殖延迟策略的种群(在种群增长早期即进行有性生殖产生休眠卵)由于具有较高的种群增长率,因而有性生殖对种群增长的代价不大,同时不同基因型种群间的竞争也要比环境胁迫时弱很多,所以这些基因型依旧可以达到较大的种群规模同时留下大量休眠卵.考虑到周期性孤雌生殖浮游动物休眠卵库普遍具有的“储存效应”(storage effect)[84],只要多个生长季内有其中一个环境条件非常适宜,那么不具有有性生殖延迟策略的基因型就将一直保持相当的比例而不至于灭绝(尽管比例上有所波动).
2)从轮虫休眠卵的萌发模式考虑,上述模型的默认假设是轮虫休眠卵在极短时间内大量萌发,即暴发式萌发.但事实上,大量实验证据表明轮虫休眠卵的萌发模式在种间和种内不同克隆间(基因型间)均存在高度多样性[22,85].同一种轮虫内的某些克隆群可能倾向于集中萌发,而另一些则倾向于在一段时间内分散萌发.例如,在研究了海城地区一个淡水湖泊中萼花臂尾轮虫休眠卵的萌发模式后,Liu 等[85]发现同域共存的不同克隆间休眠卵的萌发模式存在显著差别,一些克隆的休眠卵在适宜环境中3 d 内的萌发率即达到或接近100%(暴发式萌发),而另一些则需要8 d 甚至更长时间(分散式萌发).由此可见上述模型的基本假设就存在一些缺陷.如果假定某一具有有性生殖延迟策略基因型的休眠卵采取分散式萌发,而另外一个不具有此策略基因型的休眠卵采取暴发式萌发,而且假定最初触发它们萌发的环境条件一致,那么在春季环境条件逐渐好转达到触发萌发的条件时,水体中后一基因型的种群规模将很快超过前一基因型的种群,并且大量占据水体中有限的资源,从而在基因型间的竞争中占据优势地位.因而如果考虑到休眠卵萌发模式的复杂性,单纯假定单一暴发式萌发而建立的ESS 可侵入性模型可能并不能真正揭示轮虫是否采取延迟的有性生殖策略的进化优势.而关于轮虫不同物种间或基因型间是否表现延迟的有性生殖策略与它们休眠卵孵化模式关联性的研究目前还没有报道,这方面的实证研究对进一步评价单巢类轮虫延迟的有性生殖策略的进化优势和解释种内不同克隆间在有性生殖策略上的多样性[27]都有很重要的意义.
3)轮虫在生长季内,特别是在生长季早期面临的捕食压力和种间竞争压力的大小可能会对轮虫是否采取延迟的有性生殖策略造成显著影响.以捕食压力为例,当生长季早期轮虫克隆种群面临的捕食压力较小时,其采取延迟的有性生殖策略可以避免或降低有性生殖对种群增长的代价,从而保证轮虫种群面临一定的捕食压力时仍然能够维持增长.这样达到更高的种群密度后触发有性生殖可以提高雌雄相遇概率并生产更多的休眠卵,从而获得高的长期适合度.另一方面,当生长季早期轮虫克隆种群面临的捕食压力较高时,仅靠降低有性生殖投资无法维持种群增长,此时采取非延迟的有性生殖策略从而尽快产生较多休眠卵以保证某一基因型的种群渡过不良环境就更为有利.如果多个不同基因型共存的一个自然水体中某一种轮虫在生长季早期面临的捕食压力存在显著的年际间变化,那么某一个生长季早期的捕食压力就很大程度上决定了不同有性生殖延迟策略的基因型在这一个生长季是否具有适合度优势(以休眠卵产量计算),再考虑到休眠卵库的储存效应,在这种捕食压力存在显著年际间变化的水体中,多个不同策略基因型的长期共存是完全可能的.但到目前为止关于单巢类轮虫有性生殖延迟与环境中捕食压力的关系尚缺乏实验证据.
4)环境条件的可预测性与轮虫的有性生殖延迟策略之间的关系.ESS 可侵入性模型更多的是考虑在一种稳定环境中的最佳对策,即在高度可预测环境中的情况.在这种情况下,单巢类轮虫的有性生殖采取一定时间的延迟是有利的,但是如果环境条件高度不可预测,例如在沙漠中靠聚集雨水形成的小池塘中生存的轮虫种类,如果仍然采取一定时间的有性生殖延迟,那么就有可能面临环境条件快速恶化后(如水体干涸)有性生殖尚未发生,从而在一个生长季内无法产生休眠卵的情况.考虑到轮虫的休眠卵通常采取“两面下注”的萌发策略[81],因而即使在一个生长季内种群无法产生休眠卵可能也不至于导致某一基因型在休眠卵库中完全灭绝,但经过一个或多个这样的生长季后,整个休眠卵库中具有延迟策略的基因型频率将显著低于不具有这种延迟策略的基因型频率.因此从理论上说,在这种高度不可预测环境中轮虫不应采取延迟的有性生殖策略[27].对于这个假说,目前有两个实证研究的报道,下面本文着重讨论一下这两个研究的重要发现.
7.3.2 延迟的有性生殖与环境条件的可预测性:实证研究 上面的理论分析表明单巢类轮虫是否采取延迟的有性生殖策略与所处环境的可预测性相关,因而人们期望从不同环境条件(主要是生长季长度的可预测性不同)的自然水体中观察到采取不同对策的轮虫来验证此假说(即“在不可预测环境中,轮虫不会采取延迟的有性生殖策略”假说).目前主要有3 个实验研究(表2):1)Gilbert[44]研究了一个萼花臂尾轮虫Florida 品系从休眠卵中孵化出的第1、5、8、12 和18 代个体的有性生殖倾向性,结果发现第1 代个体的有性生殖倾向性极低;第5 代和第8 代的有性个体比率平均值大约为10%~20%;在第12 代和第18 代种群中有性生殖倾向性显著上升,大约为40%~50%.这证实了在此品系轮虫中存在明显的有性生殖延迟策略,而此品系最初采集于一个临时性的湖泊.因而作者认为此实验并不支持上述假说[27].2)Schröder 等[27]研究了不同环境中分布的一个萼花臂尾轮虫品系,一个角突臂尾轮虫品系,两个椎尾水轮虫品系和两个前额犀轮虫(Rhinoglena frontalis)品系的有性生殖延迟策略,并比较了环境的可预测性(永久性水体和临时性水体)与轮虫采取的有性生殖延迟策略间的关系,发现大多数结果并不支持上述假说(表2).3)沙漠中依赖降雨而形成的临时性小水塘可以被认为是一种极端不可预测的环境,对于这种环境中生存的轮虫来说,其生长季的长度可能短至仅有几天到十几天的时间,上述理论分析认为在这种环境中轮虫绝不应采取延迟的有性生殖策略.Schröder 等[52]调查了北美洲Chihuahuan 沙漠里小型临时性水塘中分布的一种六腕轮虫Hexarthra sp.的有性生殖模式后发现它们从休眠卵中孵化出的干雌体即有7%~46%为混交雌体,而在其他生活史已知的单巢类轮虫中通常干雌体全部为非混交雌体[79].在这种高度不可预测环境中的种类不具有任何延迟的有性生殖策略显然是支持上述假说的.
表2 显示大多数实验结果并不支持上述假说.关于出现这种结果的原因,Schröder 等[27]给出了两条解释:1)对于某一特定种类轮虫来说,其临时性生境存在的时间(即可利用的生长季长度)稳定的超过此种轮虫有性生殖延迟的时间,即环境条件的不可预测性没有成为一种极端的限制因子.例如,他们研究的椎尾水轮虫有性生殖延迟的时间通常为6 ~10 代,种群完成这些世代大约需要4 ~5 周,而奥德河洪水泛滥期(即季节性河漫滩生境中椎尾水轮虫的生长季)往往要长于此时间,因而在这种环境中延迟的有性生殖策略还是具有适合度优势的;2)在轮虫生活的自然水体中,食物因子(通常是各种微藻)的变化幅度很大,例如在很多温带湖泊中夏季存在一个食物浓度很低的“净水期”(clear-water phase)[86],因而在所谓的“永久性湖泊”中轮虫生长季的长度也是有限的,甚至在极端情况下每个生长季的长度可能还要短于上述的各种“临时性”生境.因而在永久性生境中,轮虫克隆种群在种群增长早期(即从休眠卵中孵化出后较少的传代数内)即进行有性生殖生产休眠卵也是对食物因素决定的(不可预测的)生长季长度的一种两面下注.
另外,在这类实验中基本上均采取了标准密度信号诱导的方法测定克隆种群不同传代数个体的有性生殖倾向性,例如,在上述第一个实验中采用了大约6 ind./ml 的种群密度作为标准密度信号环境,如此高的种群密度在永久性的自然水体中极为罕见(尽管在一些高度临时性生境中可能存在)[1].因而在这种过高的种群密度信号下得到的有性生殖延迟倾向性的实验结果可能与自然状态下种群的表现有所偏差.
7.4 其他潜在的母系效应影响
母系效应(maternal effect)通常是指子代的表型不仅仅由其基因型和发育过程中经历的环境条件所决定,还由母体的表型或经历的环境条件所决定的一种现象[87].经过多年更为广泛的研究后人们发现母系效应有着多种类型,而它们通常有利于提高母体的适合度[88].在很多无脊椎动物类群,人们都发现母体经历的环境条件可以显著的影响后代的生活史特征,如在飞蝗中人们发现经历高种群密度环境的母体产下的后代将具有显著更大的体型,而这种表型有利于提高后代面临相似环境时的种内竞争能力[89].
在浮游动物中,一些研究也发现母系效应可以对子代的生活史对策产生显著影响.例如,在水蚤中人们发现当子代(F1)的环境中食物条件与母体(F0)生活环境中的食物条件不一致时(高→低/低→高),特别是当子代所处环境中食物条件恶化时(高→低),子代将改变用于繁殖的资源分配,倾向于产生较高比例的有性个体(F2);这证明在水蚤中母体可以将其经历的环境信息传递给后代,这被称为“代间记忆”(generational memory)[90].考虑到有性生殖和产生休眠卵是周期性孤雌生殖浮游动物常用的一种渡过不良环境条件的生活史对策,显然这种特殊的母系效应(“代间记忆”)对于某一基因型的长期适合度是有利的.但是在轮虫中,类似的母系效应是否会影响个体在有性生殖和孤雌生殖之间的资源分配并进一步影响整个种群的有性生殖倾向性,还有待进一步实验的证实.
进一步深入研究母系效应对轮虫有性生殖的影响还能够对揭示轮虫有性生殖机理(详见本文前面相关部分的论述)有所帮助.目前关于单巢类轮虫种群有性生殖发生的假说(依据研究最为透彻的臂尾轮虫属种类)认为卵母细胞在母体体内的发育过程中母体生存环境中有性生殖诱导信号的浓度(即密度信号)决定了子代中有性个体的比例[4,19].同时,关于卵母细胞发育过程中接受环境中有性生殖诱导信号从而决定后代发育类型的信号通路,目前有两个假说较为合理.第一个假说认为体外的有性生殖诱导信号分子穿越轮虫的体壁,直接作用于卵母细胞,并导致卵母细胞发育过程中的特定基因表达发生改变,从而产生有性雌体;第二个假说认为体细胞上的受体接受到体外的信号分子后通过神经系统或是其他体内的信息传递方式将有性生殖的诱导信号传递至生殖腺和生殖细胞,从而间接影响卵母细胞的发育过程[20],但在单巢类轮虫中具体是采取哪种信号转导方式,迄今尚无实证支持.理论上,如果母系效应对轮虫有性生殖的影响得到证实的话(例如发现类似于水蚤中“代间记忆”的效应),那么至少可以证实上述第二种信号传递途经是存在的,因为如果仅存在第一种途径,那么母体(F1)从上代(F0)获得的信息将无法影响到体内卵母细胞的发育过程,因而F0代经历的环境状况(环境中密度信号的浓度)与F2代产生后代的有性个体比率无关.
8 性比率进化理论与单巢类轮虫的有性生殖策略
8.1 单巢类轮虫中均等雌雄比率的证据
单巢类轮虫特殊的生活史决定了它们的有性生殖性别资源分配中存在一种特殊的负反馈机制:如果环境中的雄性个体稀少,那么混交雌体受精的概率就很低,这时它们就会生产雄卵并产出雄性个体;而随着环境中雄性个体密度的上升,越来越多的幼年混交雌体受精并产生休眠卵,从而种群中雄体的产量下降,这种负反馈机制就保证了种群性比率的稳定[91].这里必须要着重指出的是,在一般的性比率进化分析中,研究对象往往是种群中雌雄个体的比例,而由于轮虫具有特殊的雌雄决定机制,因而在轮虫中性比率进化分析的研究对象应改为种群中生产雄性的有性雌体和生产休眠卵的有性雌体,前者相当于一般进化意义上的雄性,而后者相当于一般进化意义上的雌性[92].
在单巢类轮虫生活的水域环境中,尽管各种资源(例如食物)的分布通常是呈现出一定区域异质性(即不同程度的斑块状分布),但同时也表现出高度的流动性和扩散性[93],同时研究发现轮虫有性生殖时的雌雄相遇是随机的[48,94],因此上述局域配偶竞争理论和局域资源竞争理论在轮虫性比率进化研究中并不适用.换句话说,单巢类轮虫是一类适合Fisher 模型的类群,理论上它们种群的性比率(在单巢类轮虫中,此概念指种群中生产雄性的有性雌体数目与种群中有性雌体总数的比率)应接近0.5[91-92].
尽管理论模型从进化稳定策略(ESS)的角度得出单巢类轮虫中应具有均等的雌雄比率,但很长时间以来一直缺乏直接的实验证据.Aparici 等[92]设计了室内和室外两组实验(共4 个)验证此假说.结果表明两组室内培养实验的结果均支持上述假说,而对一个室外人工池塘中轮虫种群连续两年的监测结果中有一年的数据并不支持此假说.关于其中一年(1996-1997年)的野外监测数据不支持均等的性比率假说,Aparici 等给出了两条解释:一是“单巢类轮虫中具有均等的性比率”假说可能并不能局限在一个生长季内实现,当综合计算多个生长季内的性别资源分配情况时会得到支持此假说的结论;二是环境条件的波动选择可能在不同生长季内偏好不同的可受精年龄阈值(详见下节论述),而轮虫的这个特征则可以影响性比率,同时环境条件波动选择的压力将维持同域共存的不同基因型在这个特征上具有一定程度的多样性.事实上,如果仅按时间计算,则生长季内的大多数时段都是偏雄性的性比(即性比率>0.5),只有在种群密度最高的一段时间出现偏雌性的性比率,考虑到此时巨大的种群规模作为基数,才得到整个生长季累计种群具有均等的性比率.而野外观察已经证实淡水湖泊中轮虫种群动态的年际变化显著[95],如果轮虫种群在某一生长季内的种群密度显著低于多年平均的峰值密度,那么理论上急剧且显著偏雌的性比率将难以出现.这样将导致按照整个生长季计算的种群性比率将显著偏雄性.所以,笔者认为均等的性比率对于一个单巢类轮虫种群来说应该是一个长期的概念,而在某一个生长季内种群的性比率是可以显著背离0.5 的.
8.2 单巢类轮虫种群性比率的影响因素
通过对单巢类轮虫特殊的生活史进行详细研究后人们发现其种群的性比率受到两个因素的直接影响:一是有性雌体的可受精时间阈值(在轮虫中此概念的定义是有性雌体可以与雄体成功交配且受精的最大年龄,如果有性雌体在此年龄之内未成功交配,则成熟后将产生雄卵;而如果其在此年龄之内成功交配,则成熟后将产生休眠卵;Threshold Age of Fertilization,TAF).二是种群中的雄性个体密度[91].理论上说,如果轮虫的有性个体能够调节其TAF,那么对其适合度有利的调节是:当种群密度高时(此时往往也意味着具有较高的雄体密度),有性雌体遇到雄体的概率也较大,因而应该缩短TAF;当种群密度低时(此时往往也意味着具有较低的雄体密度),有性雌体遇到雄体的概率也较小,因而应该延长TAF 以提高受精的概率,即有性雌体的TAF 与有性雌体密度呈现显著的负相关[96].利用已知的褶皱臂尾轮虫的生活史参数,Aparici 等[91]采用ESS 可侵入性模型的方法研究了最佳TAF 的问题.结果表明在不同的环境条件下(这直接影响了种群具有不同的出生率、死亡率等生活史参数,同时高的种群密度也意味着雌雄相遇概率较高),最适TAF 不同:当环境条件很适宜时,种群倾向于较低的TAF;相反,在环境条件恶劣时,种群ESS 的TAF 较高.在不同环境下,褶皱臂尾轮虫最佳TAF 的范围在其成熟年龄的14.2%~29.2%之间,即TAF 总是显著小于个体的成熟年龄,这个结论也与实际观察的结果相吻合[97-98].
9 小结与展望
本文较系统地综述了国内外轮虫研究在有性生殖机制与进化策略方面的最新进展,主要包括单巢类轮虫有性生殖的机理、理论模型、影响有性生殖发生和有性生殖策略的内、外因素以及性比率理论在轮虫有性生殖研究中的应用等几个方面.笔者认为,当前轮虫研究在单巢类轮虫有性生殖领域还存在以下几个亟待深入研究的薄弱环节:
第一,尽管目前很多证据都暗示固醇类物质是单巢类有性生殖的关键信息素,但是由于过去水体中信息素物质分析技术和结构生物学研究手段的局限,这类物质在轮虫体内的作用机理(信号通路)并未真正阐明.现在随着研究方法和技术的进步,揭示决定单巢类轮虫有性生殖策略的关键信号通路越来越成为可能.
第二,目前的证据支持在单巢类轮虫的很多类群中,延迟的有性生殖策略是一种广泛存在的现象.但目前的ESS 可侵入模型和实证研究都未能够很好的论证这种有性生殖策略有多大的适应意义,特别是在长期适合度方面.另外,轮虫在很多生活史或是表型方面都有很强的可塑性,那么这种重要的生殖策略本身是否具有相当程度上的可塑性?对于没有这种策略的轮虫物种或是基因型,它们是通过何种机制与具有这种策略的物种或基因型长期共存的?
第三,在过去数十年里,人们基于资源竞争理论[99]和生态位理论[100]做了大量轮虫类种间或是隐种间的竞争与共存研究.然而最近的理论研究发现在周期性孤雌生殖的两个物种间,即使没有任何生态位分化而仅仅依赖有性生殖策略的不同即可实现稳定共存[101],但目前这个理论的实验或观测证据还极端缺乏.
10 参考文献
[1]Wallace RL,Snell TW.Phylum rotifera.In:Thorp JH,Covich AP eds.Ecology and classification of North American freshwater invertebrates(Second Edition).California:Academic Press,2001:195-254.
[2]Segers H.Annotated checklist of the rotifers (Phylum Rotifera),with notes on nomenclature,taxonomy and distribution.Zootaxa,2007,1564:1-104.
[3]Gilbert JJ.Contact chemoreception,mating behaviour,and sexual isolation in the rotifer genus Brachionus.Journal of Experimental Biology,1963,40(4):625-641.
[4]Snell TW,Kubanek J,Carter W et al.A protein signal triggers sexual reproduction in Brachionus plicatilis (Rotifera).Marine Biology,2006,149:763-773.
[5]Kubanek J,Snell TW.Quorum sensing in rotifers.In:Winans SC,Bassler BL eds.Chemical communication among bacteria.Washington:ASM Press,2008:453-461.
[6]Snell T,Rico-Martinez R,Kelly L et al.Identification of a sex pheromone from a rotifer.Marine Biology,1995,123:347-353.
[7]Snell T,Stelzer CP.Removal of surface glycoproteins and transfer among Brachionus species.Hydrobiologia,2005,546:267-274.
[8]Fussmann GF,Ellner SP,Hairston NG.Evolution as a critical component of plankton dynamics.Proceedings of the Royal Society of London.Series B:Biological Sciences,2003,270:1015-1022.
[9]Snell T,Shearer T,Smith H et al.Genetic determinants of mate recognition in Brachionus manjavacas (Rotifera).BMC Biology,2009,7(1):60.
[10]Gallardo WG,Hagiwara A,Tomita Y et al.Effect of some vertebrate and invertebrate hormones on the population growth,mictic female production,and body size of the marine rotifer Brachionus plicatilis Müller.Hydrobiologia,1997,358:113-120.
[11]Gallardo WG,Hagiwara A,Snell TW.Effect of juvenile hormone and serotonin (5-HT)on mixis induction of the rotifer Brachionus plicatilis Müller.Journal of Experimental Marine Biology and Ecology,2000,252:97-107.
[12]Snell TW,DesRosiers NJD.Effect of progesterone on sexual reproduction of Brachionus manjavacas(Rotifera).Journal of Experimental Marine Biology and Ecology,2008,363(1/2):104-109.
[13]夏继刚,牛翠娟.壬基酚暴露对斑马鱼求偶行为与繁殖成功率的影响.生态学报,2010,30(20):5537-5543.
[14]Preston BL,Snell TW,Robertson TL et al.Use of freshwater rotifer Brachionus calyciflorus in screening assay for potential endocrine disruptors.Environmental Toxicology and Chemistry,2000,19(12):2923-2928.
[15]Snell TW,Joaquim-Justo C.Workshop on rotifers in ecotoxicology.Hydrobiologia,2007,593(1):227-232.
[16]Schmitt A,Nebreda AR.Signalling pathways in oocyte meiotic maturation.Journal of Cell Science,2002,115(12):2457-2459.
[17]Gilbert JJ.Rotifera.In:Adiyodi KG,Adiyodi RG eds.Reproductive biology of invertebrates.Oogenesis,Oviposition,and Oosorption.New York:John Wiley & Sons Ltd.,1983:181-209.
[18]Gilbert JJ.Induction of mictic females in the rotifer Brachionus:oocytes of amictic females respond individually to popula-tion-density signal only during oogenesis shortly before oviposition.Freshwater Biology,2007,52(8):1417-1426.
[19]Snell TW.A review of the molecular mechanisms of monogonont rotifer reproduction.Hydrobiologia,2011,662:89-97.
[20]Gilbert JJ.Environmental and endogenous control of sexuality in a rotifer life cycle:developmental and population biology.Evolution and Development,2003,5(1):19-24.
[21]Serra M,King CE.Optimal rates of bisexual reproduction in cyclical parthenogens with density-dependent growth.Journal of Evolutionary Biology,1999,12(2):263-271.
[22]Pourriot R,Snell TW.Resting eggs in rotifers.Hydrobiologia,1983,104:213-224.
[23]Snell TW,Boyer EM.Thresholds for mictic female production in the rotifer Brachionus plicatilis (Müller).Journal of Experimental Marine Biology and Ecology,1988,124(2):73-85.
[24]Stelzer CP,Snell TW.Induction of sexual reproduction in Brachionus plicatilis (Monogononta,Rotifera)by a density-dependent chemical cue.Limnology and Oceanography,2003,48(2):939-943.
[25]Gilbert JJ.Specificity of crowding response that induces sexuality in the rotifer Brachionus.Limnology and Oceanography,2003,48(3):1297-1303.
[26]Gilbert JJ,Dieguez MC.Low crowding threshold for induction of sexual reproduction and diapause in a Patagonian rotifer.Freshwater Biology,2010,55(8):1705-1718.
[27]Schröder T,Gilbert JJ.Transgenerational plasticity for sexual reproduction and diapause in the life cycle of monogonont rotifers:intraclonal,intraspecific and interspecific variation in the response to crowding.Functional Ecology,2004,18(3):458-466.
[28]Timmermeyer N,Stelzer CP.Chemical induction of mixis in the rotifer Synchaeta tremula.Journal of Plankton Research,2006,28(12):1233-1239.
[29]Carmona MJ,Gómez A,Serra M.Mictic patterns of the rotifer Brachionus plicatilis Müller in small ponds.Hydrobiologia,1995,313/314:365-371.
[30]Larsson P,Dodson S.Invited review:chemical communication in planktonic animals.Archiv für Hydrobiologie,1993,129(2):129-155.
[31]Fitzsimmons JM,Innes DJ.Inter-genotype variation in reproductive response to crowding among Daphnia pulex.Hydrobiologia,2006,568:187-205.
[32]Gilbert JJ.Timing of diapause in monogonont rotifers:mechanisms and strategies.In:Alekseev V,Stasio B,Gilbert J eds.Diapause in aquatic invertebrates:Theory and human use.Dordrecht,Netherlands:Springer,2007:11-27.
[33]Serra M,Smith H,Weitz J et al.Analysing threshold effects in the sexual dynamics of cyclically parthenogenetic rotifer populations.Hydrobiologia,2011,662:121-130.
[34]Gilbert JJ,Thompson GA.Alpha tocopherol control of sexuality and polymorphism in the rotifer Asplanchna.Science,1968,159(3816):734-736.
[35]Gilbert JJ.Female polymorphism and sexual reproduction in the rotifer Asplanchna:evolution of their relationship and control by dietary tocopherol.American Naturalist,1980,116(3):409-431.
[36]Pourriot R,Clément P.Influence de la durée de l'éclairement quotidien sur le taux de femelles mictiques chez Notommata copeus Ehr.(Rotifère).Oecologia,1975,22(1):67-77.
[37]Gilbert J.Mictic-female production in monogonont rotifers.Archiv Hydrobiologie Beiheft,1977,8:142-155.
[38]Gilbert JJ.Dormancy in rotifers.Transactions of the American Microscopical Society,1974,93:490-513.
[39]Serra M,Snell TW,Gilbert JJ.Delayed mixis in rotifers:an adaptive response to the effects of density-dependent sex on population growth.Journal of Plankton Research,2005,27(1):37-45.
[40]Gilbert JJ.Mictic female production in the rotifer Brachionus calyciflorus.Journal of Experimental Zoology,1963,153(2):113-123.
[41]Hobæk A,Larsson P.Sex determination in Daphnia magna.Ecology,1990,71(6):2255-2268.
[42]Gilbert JJ,Walsh EJ.Brachionus calyciflorus is a species complex:mating behavior and genetic differentiation among four geographically isolated strains.Hydrobiologia,2005,546:257-265.
[43]Stelzer CP,Snell TW.Specificity of the crowding response in the Brachionus plicatilis species complex.Limnology and Oceanography,2006,51(1):125-130.
[44]Gilbert JJ.Endogenous regulation of environmentally induced sexuality in a rotifer:a multigenerational parental effect induced by fertilisation.Freshwater Biology,2002,47(9):1633-1641.
[45]Gómez A,Snell TW.Sibling species and cryptic speciation in the Brachionus plicatilis species complex (Rotifera).Jour-nal of Evolutionary Biology,1996,9(6):953-964.
[46]Snell TW.Sex,population dynamics and resting egg production in rotifers.Hydrobiologia,1987,144:105-111.
[47]Serra M,Snell TW,King CE.The timing of sex in cyclically parthenogenetic rotifers.In:Moya A,Font E eds.Evolution:from molecules to ecosystems.New York:Oxford University Press,2004:135-146.
[48]Snell TW,Garman BL.Encounter probabilities between male and female rotifers.Journal of Experimental Marine Biology and Ecology,1986,97(3):221-230.
[49]Ciros-Pérez J,Carmona MJ,Serra M.Resource competition and patterns of sexual reproduction in sympatric sibling rotifer species.Oecologia,2002,131(1):35-42.
[50]Gilbert JJ.Effect of food concentration on the production and viability of resting eggs of the rotifer Brachionus:implications for the timing of sexual reproduction.Freshwater Biology,2010,55:2437-2446.
[51]Serra M,Carmona MJ.Mixis strategies and resting eeg production of rotifers living in temporally-varying habitats.Hydrobiologia,1993,255:117-126.
[52]Schröder T,Howard S,Arroyo M et al.Sexual reproduction and diapause of Hexarthra sp.(Rotifera)in short lived ponds in the Chihuahuan Desert.Freshwater Biology,2007,52:1033-1042.
[53]Hino A,Hirano R.Ecological studies on the mechanism of bisexual reproduction in the rotifer Brachionus plicatilis.Ⅱ.Effects of cumulative partenogenetic generation on the frequency of bisexual reproduction.Bulletin of the Japanese Society of Scientific Fisheries,1977,43:1147-1155.
[54]Merriman JL,Kirk KL.Temporal patterns of resource limitation in natural populations of rotifers.Ecology,2000,81(1):141-149.
[55]Snell TW,Carrillo K.Body size variation among strains of the rotifer Brachionus plicatilis.Aquaculture,1984,37(4):359-367.
[56]King CE,Snell TW.Density-dependent sexual reproduction in natural populations of the rotifer Asplanchna girodi.Hydrobiologia,1980,73:149-152.
[57]Snell TW,Hoff FH.The effect of environmental factors on resting egg production in the rotifer Brachionus plicatilis.Journal of the World Mariculture Society,1985,16(4):484-497.
[58]Snell TW,Hoff FH.Fertilization and male fertility in the rotifer Brachionus plicatilis.Hydrobiologia,1987,147:329-334.
[59]Hagiwara A,Hino A,Hirano R.Studies on the formation and hatching of fertilized eggs of the rotifer Brachionus plicatilis.2.Effects of temperature and chlorinity on resting egg formation.Nippon Suisan Gakkaishi,1988,54(4):569-575.
[60]Pourriot R,Rougier C.Température,démographie et mixis chez un rotifère héléoplanctonique,Epiphanes brachionus(Ehrb.).Annales de Limnologie,1999,35:167-172.
[61]Montero-Pau J,Ramos-Rodríguez E,Serra M et al.Long-term coexistence of rotifer cryptic species.Plos One,2011,6:e21530.
[62]Lubzens E,Minkoff G,Marom S.Salinity dependence of sexual and asexual reproduction in the rotifer Brachionus plicatilis.Marine Biology,1985,85(2):123-126.
[63]Snell TW.Effect of temperature,salinity and food level on sexual and asexual reproduction in Brachionus plicatilis (Rotifera).Marine Biology,1986,92(2):157-162.
[64]Hagiwara A,Lee CS,Miyamoto G et al.Resting egg formation and hatching of the S-type rotifer Brachionus plicatilis at varying salinities.Marine Biology,1989,103(3):327-332.
[65]Hagiwara A,Hamada K,Hori S et al.Increased sexual reproduction in Brachionus plicatilis (Rotifera)with the addition of bacteria and rotifer extracts.Journal of Experimental Marine Biology and Ecology,1994,181(1):1-8.
[66]沈蕴芬.水细菌生态.见:刘建康编.高级水生生物学.北京:科学出版社,1999:151-175.
[67]Lansing AI.A transmissible,cumulative,and reversible factor in aging.Journal of Gerontology,1947,2(3):228-239.
[68]Lansing AI.A nongenic factor in the longevity of rotifers.Annals of the New York Academy of Sciences,1954,57(5):455-464.
[69]Parsons PA.Parental age and the offspring.Quarterly Review of Biology,1964,39(3):258-275.
[70]Schröder T,Gilbert JJ.Maternal age and spine development in the rotifer Brachionus calyciflorus:increase of spine length with birth orders.Freshwater Biology,2009,54(5):1054-1065.
[71]Kim HJ,Hagiwara A.Effect of female aging on the morphology and hatchability of resting eggs in the rotifer Brachionus plicatilis Müller.Hydrobiologia,2011,662:107-111.
[72]Pourriot R,Rougier C.Influence de l'âge des parents sur la production de femelles mictiques chez Brachionus calyciflorus(Pallas)et B.rubens Ehr.(Rotifères).Comptes Rendus de l'Académie des Sciences Paris,1976,283:1497-1500.
[73]Pourriot R,Rougier C.Effets de la densité de population et du groupement sur la reproduction de Brachionus calyciflorus(Pallas)(Rotifère).Annales de Limnologie,1977,13:101-113.
[74]Carmona MJ,Serra M,Miracle MR.Effect of population density and genotype on life-history traits in the rotifer Brachionus plicatilis O.F.Müller.Journal of Experimental Marine Biology and Ecology,1994,182(2):223-235.
[75]Pourriot R,Rougier C.Influences conjuguées du groupement et de la qualité de la nourriture sur la reproduction de Brachionus plicatilis O.F.Müller (Rotifère).Netherlands Journal of Zoology,1979,29:242-264.
[76]Gilbert JJ,Schröder T.Intraclonal variation in propensity for mixis in several rotifers:variation among females and with maternal age.Hydrobiologia,2007,593:121-128.
[77]Lubzens E,Minkoff G.Influence of the age of algae fed to rotifers(Brachionus plicatilis O.F.Müller)on the expression of mixis in their progenies.Oecologia,1988,75(3):430-435.
[78]Fussmann GF,Kramer G,Labib M.Incomplete induction of mixis in Brachionus calyciflorus:patterns of reproduction at the individual level.Hydrobiologia,2007,593:111-119.
[79]Gilbert JJ,Schröder T.Rotifers from diapausing,fertilized eggs:Unique features and emergence.Limnology and Oceanography,2004,49(4):1341-1354.
[80]Hagiwara A,Kadota Y,Hino A.Maternal effect by stem females in Brachionus plicatilis:effect of starvation on mixis induction in offspring.Hydrobiologia,2005,546:275-279.
[81]Hairston NG.Zooplankton egg banks as biotic reservoirs in changing environments.Limnology and Oceanography,1996,41(5):1087-1092.
[82]Maynard SJ,Price GR.The logic of animal conflict.Nature,1973,246(5427):15-18.
[83]Miracle MR,Serra M.Salinity and temperature influence in rotifer life history characteristics.Hydrobiologia,1989,186:81-102.
[84]Brendonck L,De Meester L.Egg banks in freshwater zooplankton:evolutionary and ecological archives in the sediment.Hydrobiologia,2003,491:65-84.
[85]Liu W,Niu CJ.Polymorphism in resting egg size and hatching strategy in the rotifer Brachionus calyciflorus Pallas.Zoological Science,2010,27(4):330-337.
[86]Sommer U.Plankton ecology:succession in plankton communities.New York:Springer-Verlag,1989.
[87]Mousseau TA,Fox CW.Maternal effects as adaptations.New York:Oxford University Press,1998.
[88]Marshall DJ,Uller T.When is a maternal effect adaptive?Oikos,2007,116(12):1957-1963.
[89]Chapuis M,Crespin L,Estoup A et al.Parental crowding influences life-history traits in Locusta migratoria females.Bulletin of Entomological Research,2010,100(1):9-17.
[90]LaMontagne JM,McCauley E.Maternal effects in Daphnia:what mothers are telling their offspring and do they listen?Ecology Letters,2001,4(1):64-71.
[91]Aparici E,Carmona MJ,Serra M.Sex allocation in haplodiploid cyclical parthenogens with density-dependent proportion of males.American Naturalist,1998,152(4):652-657.
[92]Aparici E,Carmona MJ,Serra M.Evidence for an even sex allocation in haplodiploid cyclical parthenogens.Journal of Evolutionary Biology,2002,15(1):65-73.
[93]Reynolds CS.Ecology of phytoplankton.New York:Cambridge University Press,2006.
[94]Gómez A,Serra M.Mate choice in male Brachionus plicatilis rotifers.Functional Ecology,1996,10:681-687.
[95]González MJ,Frost TM.Food limitation and seasonal population declines of rotifers.Oecologia,1992,89(4):560-566.
[96]Serra M,Aparici E,Carmona MJ.When to be sexual:sex allocation theory and population density-dependent induction of sex in cyclical parthenogens.Journal of Plankton Research,2008,30(11):1207-1214.
[97]Snell T,Childress M.Aging and loss of fertility in male and female Brachionus plicatilis (Rotifera).International Journal of Invertebrate Reproduction and Development,1987,12(1):103-110.
[98]席贻龙,黄祥飞.萼花臂尾轮虫交配行为和受精作用研究.生态学报,2000,20(4):541-544.
[99]Tilman D.Resource competition and community structure.Princeton:Princeton University Press,1982.
[100]Colwell RK,Futuyma DJ.On the measurement of niche breadth and overlap.Ecology,1971,53(4):567-576.
[101]Montero-Pau J,Serra M.Life-cycle switching and coexistence of species with no niche differentiation.Plos One,2011,6:e20314.

