骨化三醇冲击治疗对维持性血液透析患者微炎症及动脉粥样硬化的影响
彭宇 王特
心血管疾病(cardiovascular disease,CVD)不仅是终末期肾病(end stage renal disease,ESRD)患者最常见的并发症,更是导致维持性血液透析(maintenance hemodialysis,MHD)患者死亡的第一位原因[1],并且MHD患者患CVD的风险比普通人群高出 20~30 倍[2]。近年来的研究提示MHD患者骨及矿物质代谢紊乱与CVD的发生和发展有很大关系,最终影响患者的生存率[3],MHD患者普遍存在慢性炎症,炎症介质参与了动脉粥样硬化(atherosclerosis,AS)的进程,骨化三醇是临床上常用的治疗继发性甲旁亢的药物,其对AS的影响报道较少,本研究观察了骨化三醇治疗能否降低炎症介质的表达,从而延缓AS的进展。
1 资料与方法
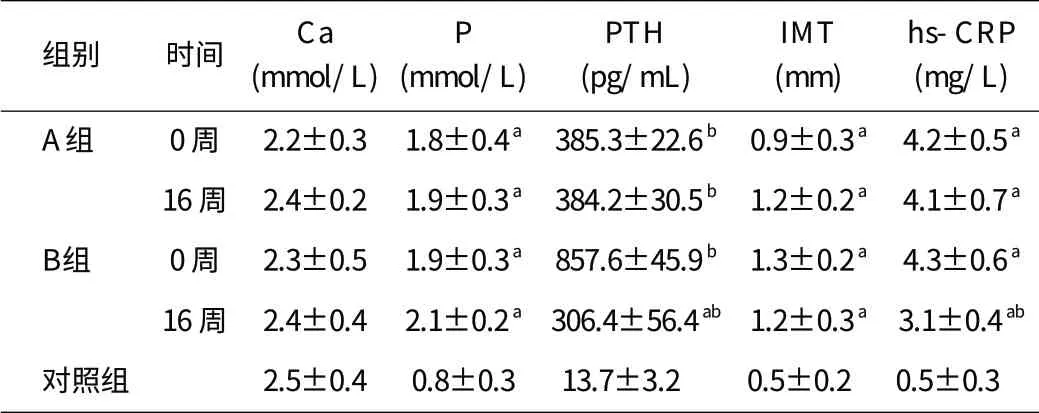
1.1 一般资料 选择 2010年10月~2011年10月我院血透室MHD患者 36 例,入选标准:所有患者均规律透析 6 个月以上,纠正贫血、心衰,一周透析 3 次;继发甲旁亢,甲状旁腺激素(parathyroid hormone,PTH)浓度:300 pg/mL 1.2 方法 36 例MHD患者均维持每周 3 次血液透析治疗,每次 4 h,使用聚砜膜透析器和碳酸氢盐透析液进行透析,透析液钙浓度 1.3~1.5 mmol/L,血流速 200~300 mL/min,透析液流速 500 mL/min。骨化三醇使用方法:A组(n=18):罗钙全 0.25 μg,Qd;B组(n=18):罗钙全 2.0 μg,2 次/周,均为透析后当晚服用。颈动脉超声检测:仪器:GE彩色超声诊断仪,探头频率 7.5 Hz;方法:检查部位是双侧颈动脉起始部,颈内、外动脉分叉处及颈内颈外动脉,记录颈动脉内膜中层厚度(IMT)及粥样硬化斑块的形成。IMT>0.9 mm且≤1.3 mm为颈动脉IMT增厚;IMT>1.3 mm或局部增厚≥0.5 mm定义为斑块形成。IMT增厚和或斑块形成则定义为发生了颈动脉粥样硬化[4]。 1.3 检测指标 透析开始前抽静脉血测定所有患者治疗前和治疗后 16 周血清PTH、钙(Ca)、磷(P)、超敏-C反应蛋白(hs-CRP)。 1.4 统计学方法 采用SPSS17.0 统计软件,正态分布资料,所有数据以均数±标准差(±s)表示,两组均数比较采用组间t检验,hs-CRP与IMT的关系采用相关分析,P<0.05 为差异有统计学意义。 2.1 各组患者颈动脉超声结果的比较 治疗前A、B两组患者的IMT数值皆高于对照组,差异有统计学意义(P<0.01);经过 16 周的骨化三醇治疗,A组IMT较同组治疗前显著增加(P<0.05),而B组的IMT较治疗前没有增加。结果见表1。 表1 各组患者治疗前后资料的比较 2.2 各组患者血Ca、P、PTH、hs-CRP的比较 A、B两组患者的血Ca水平治疗前后基本保持平稳,并与对照组比较无显著性差异;两组患者治疗前血P均较对照组升高(P<0.05),治疗后稍有升高,但无统计学差异。治疗前两组患者血PTH较对照组显著升高(P<0.01),治疗后 2 组患者血PTH均有下降,其中B组较同组治疗前有显著降低(P<0.05)。治疗前两组患者血hs-CRP较对照组显著升高(P<0.01),治疗后B组较同组治疗前有显著降低(P<0.05)。结果见表1。 2.3 相关分析 Pearson相关分析表明,hs-CRP与IMT成正相关(r=0.35,P<0.05)。 MHD患者是发生AS的高危人群,与一般人群比较,具有发病率高、发病年龄早、病变累及广泛等特点。近年来国内外许多学者认为AS实质是一种炎症性疾病,而MHD患者由于代谢产物蓄积、高同型半胱氨酸血症、氧化应激、透析膜及管路的生物不相容性、透析液质量差、蛋白质-营养不良等诸多原因,体内存在炎症因子的轻微而持续的活化,即所谓的“微炎症状态”[5]。因此,其与AS的关系受到了广泛的关注。微炎症状态可能是患者高发动脉粥样硬化性心脑血管事件的独立危险因素之一[6]。 所谓的微炎症状态是指MHD患者没有全身或局部显性的临床感染征象,但由于上述多种因素活化了局部和(或)全身免疫炎症细胞,诱发患者体内存在持续的、低水平的炎症状态。研究表明,C反应蛋白作为一种正性急性时相蛋白,是系统性低水平炎症反应综合征的特异性标志物,超敏C反应蛋白即hs-CRP可以检测出更低水平的C反应蛋白,能更好更早的反映患者存在的微炎症状态,是判断患者预后的重要预测因子[7],hs-CRP升高的患者心血管事件发生率及病死率明显高于hs-CRP正常的患者。 因为有创的冠状动脉造影很难在MHD患者中普及应用,颈动脉粥样硬化是全身性动脉硬化的组成部分,因此近年发展了非创伤性超声检测颈动脉病变的诊断方法,以反映冠状动脉及全身动脉粥样硬化早期病变。本文结果表明,MHD患者不管其PTH结果如何,颈动脉内膜较对照组有了明显的增厚和粥样斑块的形成,而且随病程进展而进一步发展。 骨化三醇即l,25-(OH)2D3是维生素D3的活性形式,其生物学作用主要包括调节钙磷代谢和骨的再建,降低炎症介质的表达及肾素-血管紧张素系统的活性,减轻肾小球硬化及肾小管间质纤维化[8];在糖尿病大鼠的动物实验中,骨化三醇能够参与滤过屏障的维持,恢复裂孔隔膜蛋白的表达,减少足细胞的损伤脱落,从而发挥肾脏保护作用[9]。 本研究发现,MHD患者hs-CRP高出对照组 8~10 倍,表明患者处于微炎症状态,相关分析显示,hs-CRP与IMT成正相关,表明炎症参与了动脉粥样硬化的进程。骨化三醇冲击治疗组患者不但PTH下降显著,而且hs-CRP较治疗前有显著下降,同时,IMT进展遭到了延缓,表明骨化三醇可能通过降低炎症介质的表达,从而延缓动脉粥样硬化的进展[10-11]。另一方面,MHD患者微炎症状态的产生原因众多且很多因素缺乏有效的干预措施,虽然骨化三醇干预使的hs-CRP产生下降,但由于MHD患者少有血磷控制良好的,导致本文研究样本偏少,另外,尚缺乏骨化三醇改善患者预后的相关研究报道,有待更多的研究。 [1]中华医学会肾脏病分会透析移植登记工作组.1999年度全国透析移植登记报告[J].中华肾脏病杂志,2001,17(2):77-78. [2]Block G,Port FK.Calcium phosphate metabolism and cardiovascular disease in patients with chronic kidney disease[J].Semin Dial,2003,16(2): 140-147. [3]付平,唐万欣.慢性肾脏病患者血管钙化的诊治进展[J].中国血液净化,2008,7(5):233-235. [4]Hollander M,Hak AE,Koudstaalp J,et al.Comparison between measures of atherosclerosis and risk of stroke:the Rotterdam Study[J].Stroke, 2003,34(10):2367-2372. [5]Cottone S,Lorito MC,Riccobene R,et a1.Oxidative stress,infla mmation and cardiovascular disease in chronic renal failure[J].J Nephrol,2008,21(2):175-179. [6]叶云洁,倪兆慧,钱家麒,等.终末期肾病微炎症状态和动脉粥样硬化的关系[J].中华肾脏病杂志,2004,20(3):173-176. [7]何朝生,史伟,梁馨苓,等.尿毒症患者微炎症状况与心血管事件的相关性研究[J].中国血液净化,2008,7(5):256-259. [8]邹敏书,余健,何威逊.1,25-二羟维生素D3 在慢性肾疾病中的作用[J].国际儿科学杂志,2008,35(4):346-348. [9]刘雷,甘华,王辉,等.骨化三醇对糖尿病大鼠肾脏保护作用机制的研究[J].中华肾脏病杂志,2008,24(8):590-591. [10]唐卓,秦爱平.阿仑膦酸钠和骨化三醇对绝经后女性糖尿病伴骨质疏松症患者动脉硬化的影响[J].心血管康复医学杂志,2010,19(6):586-589. [11]何映琴,陈惠珊,菅宏蕴.骨化三醇注射液对继发性甲状旁腺功能亢进的疗效观察[J].当代医学,2012,18(21):29-30.2 结果
3 讨论