磷脂酶C分子在结核分枝杆菌触发树突状细胞细胞骨架重排中的作用
徐水凌,徐 妍,黄 佳,范宏彦,金梦媚
(1.嘉兴学院医学院病原生物学教研室,浙江 嘉兴 314001;2.遵义医学院·珠海校区,广东 珠海 519041)
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染引起的人类重大传染病之一。我国也是22个结核病高发病率国家之一,其中活动性肺结核病人数居世界第二位。在MTB感染早期,侵入的宿主细胞主要为树突状细胞和单核细胞[1-3],因此,了解MTB如何侵入机体树突状细胞(dendritic cell,DC),对阐明结核病的发病机制尤为重要。有研究表明,病原菌如沙门菌及致病性大肠埃希菌等粘附宿主细胞后,可激活胞内磷脂酶C(phospholisae C,PLC)信号分子,促使胞内Ca2+浓度增加,触发微丝肌动蛋白(F-actin)细胞骨架重排,最终导致细菌内化入细胞[4-5]。MTB感染DC过程中,细胞PLC分子是否被激活,细胞骨架(微丝、微管)是否有重排至今尚末有报道。在本研究中,我们采用小鼠骨髓来源的成熟细胞系DC2.4作为人结核分枝杆菌H37Rv株侵入的靶细胞,建立了人结核分枝杆菌 H37Rv株DC2.4细胞混合培养模型,检测了H37Rv株侵入DC2.4细胞时细胞骨架(微丝、微管)的变化情况,并采用PLC分子特异性阻断剂U73122抑制DC2.4细胞的PLC分子,观察H37Rv株侵入率变化以及对细胞骨架变化的影响,这将为深入阐明结核分枝杆菌的致病机制及抗感染免疫的研究提供科学的理论依据。
1 材料和方法
1.1 菌株、细胞株及主要试剂 人结核分枝杆菌标准菌株H37Rv株(mycobacterium tuberculosis H37Rv),由本实验室采用改良罗氏固体培养基常规培养并保存。小鼠树突状细胞DC2.4细胞株(为成熟的DC)由浙江大学免疫研究所惠赠,以含10%胎牛血清、100 U/ml青霉素和链霉素的DEME培养液在37℃、5%CO2环境中培养。鼠来源抗β-微管蛋白(Beat-tubulin)单克隆抗体、异硫氰酸荧光素(FITC)标记的兔抗鼠IgG、四甲基异硫氰酸罗丹明-鬼笔环肽(Palloidin-TRITC)、牛血清蛋白(BSA)、磷脂酶C特异性抑制剂 U73122(美国Sigma公司)、DMEM细胞培养基(美国Gibco公司)、胎牛血清(杭州四季青生物制品公司)、小鼠磷脂酶C分子检测试剂盒(美国R&D公司)。
1.2 细胞培养和人结核分枝杆菌H37Rv悬液制备 小鼠树突状细胞DC2.4用DMEM培养液(含10%胎牛血清、100U/ml青霉素和链霉素)于37℃、5%CO2培养箱中培养24 h后,小心吹打细胞,然后以无菌 PBS(pH 7.4,0.01 mol/L)洗3次(1500 r/min离心10 min),最后调整细胞浓度至5.2×105个/ml。将人结核分枝杆菌H37Rv株接种于改良罗氏固体培养基,经37℃孵育3周后,挑取生长良好的H37Rv株于磨菌器中,加入含体积分数为0.05%Tween-80的生理盐水液研磨15 min,无菌PBS(pH 7.4,0.01 mol/L)洗2次(2500 r/min离心10 min),将其重悬于不含抗生素的DMEM培养液(含10%胎牛血清),调整其细菌浓度为4.3×107CFU/ml,备用。
1.3 H37Rv株与DC2.4细胞混合培养 取12孔细胞培养板,每孔置一盖玻片(0.8 cm×0.8 cm),分别接种 DC2.4细胞(5.2×105个/ml)各1 ml,于37℃,5%CO2培养箱孵育至细胞呈单层状。吸弃培养液,每孔加入2 ml DMEM培养液中(无抗生素,含10%胎牛血清),分别孵育2 h。小心吸弃培养液,按细菌∶细胞=80∶1的比例,每孔加入H37Rv株悬液1 ml(浓度为4.3 ×107CFU/ml),37℃分别孵育 0、2、4、6、8、10、12 h时,用PBS冲洗3次,取出盖玻片,以-20℃预冷的细胞固定液固定3 min,PBS洗2次,Giemsa染色,封片,光学显微镜下观察。另取12孔细胞培养板,按上述相同方法分别进行H37Rv和DC2.4细胞株以及U73122(终浓度为10 μmol/L)预处理30 min的DC2.4细胞株混合培养,分别于 0、2、4、6、8、10、12 h 时去除细胞培养板上的细胞培养液,每孔再以PBS小心冲洗5次,然后分别加入250 μl 0.1%Triton X-100于37℃ 裂解细胞,倒置显微镜下观察DC2.4细胞的裂解情况,待细胞全部裂解后每孔加入RPMI 1640细胞培养液(含10%胎牛血清,无抗生素)500 μl,混匀后每孔分别做 1∶10和1∶100稀释后接种于罗氏培养基,37℃恒温培养18 d,计数各时间点 H37Rv菌落总数(CFU),同时计算不同培养时间的细菌侵入率。细菌侵入率(%)=不同混合培养时间的H37Rv菌落总数 /混合培养前H37Rv菌落总数 × 100%[6]。
1.4 荧光显微镜检测细胞微丝变化 将DC2.4细胞分别接种于带小块盖玻片的12孔培养板孔中,每孔约1 ml,细胞浓度分别为3.2×104个/ml,待其呈单层生长后,吸弃培养液,以无菌的PBS轻轻冲洗3次后,加入不含双抗的10%胎牛血清的DMEM培养液继续孵育2 h,加入100 μl以不含双抗的DMEM培养液悬浮的 H37Rv株(细菌浓度为2.6×106CFU/ml),然后加入不含双抗的DMEM培养液1 ml,轻轻混匀,在37℃、5%CO2孵箱中分别孵育0、2、4、6、8、10、12 h 时,吸出孔内液体,用自制微型盖玻片夹夹出小盖玻片,PBS轻轻冲洗3次,用4%多聚甲醛室温固定15 min,去固定液,用PBS轻轻冲洗3次,沥干水份,切勿干燥。将其置于干净的载玻片上,每张盖玻片上加30 μl Palloidin-TRITC荧光染料(用1%BSA/PBS按1∶150稀释)。室温湿盒中静置40 min后,用PBS轻轻冲洗5次,自然干燥,丙三醇/PBS封片,用无荧光软布擦净其背面,放在洁净无荧光载玻片上,荧光显微镜下观察细胞微丝重排情况及计算F-actin细胞骨架重排百分率,同时设不受侵入的DC2.4细胞为对照。F-actin重排百分率计算方法:荧光显微镜下计数200个细胞,显示典型点状F-actin聚集者计1分,点状聚集不明显者计0.5分,F-actin不聚集者计0分[7]。F-actin重排百分率(%)= 总计分/200×100%。
1.5 荧光显微镜检测细胞微管变化 按上述方法将DC2.4细胞接种于培养板中,经混合培养、固定后,每个玻片用5%BSA液对鼠源本底封闭30 min,再以1∶150稀释鼠抗β-微管蛋白单克隆抗体作用30 min,PBS冲洗3次,然后用1∶100稀释的FITC标记的羊抗鼠 IgG 40 μl于暗湿盒作用40 min,PBS冲洗3次,自然干燥,荧光显微镜下观察细胞微管变化情况。
1.6 PLC分子测定 按上述不同感染时间段感染DC2.4细胞,同时以等量10%胎牛血清的DMEM为空白对照,重复4孔。收集细胞后分别以无菌PBS洗2次(1500 r/min离心10 min),沉淀加入100 μl无菌 PBS后,冰上超声破碎(400 V,10 s × 100),12000 r/min 4℃ 离心30 min,分别收集含细胞浆蛋白上清和含细胞膜蛋白沉淀。采用固相夹心法酶联免疫吸附法(ELISA),检测DC2.4细胞浆液和细胞膜液中的PLC分子表达量。严格按说明书要求进行操作,BIO-RAD Model 680全自动酶联免疫吸附仪450 nm测定A值,建立标准曲线YPLC=84.5X+8.1,根据标准曲线测算各组PLC分子的表达(ng/ml)。
1.7 PLC信号通路阻断试验 在12孔细胞培养板中进行DC2.4细胞预培养,待细胞呈单层状生长后,小心吸弃培养液,每孔加入2 ml DMEM培养液稀释的PLC信号传导抑制剂U73122(终浓度为 10 μmol/L),于 37℃,5%CO2培养箱中预处理DC2.4细胞30 min,然后再加入 H37Rv株混匀,采用上述(1.3、1.4和1.5节)相同方法侵入DC2.4细胞,分别检测PLC信号分子抑制剂U73122阻断前后,细菌侵入率、DC2.4细胞的细胞微丝和细胞微管重排情况,以及DC2.4细胞细胞浆和细胞膜中PLC分子表达的变化。
1.8 统计学处理 采用SPSS 13.0统计学软件分析实验数据。实验结果以均数±标准差()表示。各样本均数先进行方差齐性检验,再行单因素方差分析,两两比较采用q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 H37Rv株与 DC2.4细胞混合培养H37Rv株与DC2.4细胞共育2 h,即见有细菌侵入,共育4、6、8、10、12 h 后,DC2.4 细胞的侵入率分别为(26.1±4.5)%、(39.9±5.6)%、(51.2±5.9)%、(57.9±6.1)%和(63.9±6.8)%,混合培养6 h以上,与混合培养2 h相比较,侵入率差异有统计学意义(P<0.05);采用U73122预处理DC2.4细胞30 min后,再混合培养 4、6、8、10、12 h 后,DC2.4 细胞的侵入率则分别为(13.6±3.1)%、(14.2±3.9)%、(15.1±4.3)%、(16.8±4.0)%和(18.3±5.2)%;相同混合培养点,U73122末处理组的侵入率明显高于U73122预处理组(P<0.05,图1)。侵入的细胞中可见H37Rv株呈单个分散排列,主要粘附或集聚在细胞表面,细胞内可见较多中毒颗粒,随着感染时间延长,此现象愈加明显,脱壁细胞增多;而经 U73122预处理后,H37Rv株较少集聚在细胞表面,内吞细菌数显著减少,也末见有脱壁细胞(图2)。从而提示:PLC抑制剂U73122可阻止H37Rv株对DC2.4细胞的侵入。
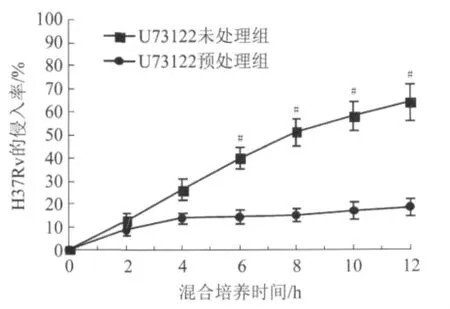
图1 人结核分枝杆菌H37Rv株对DC2.4细胞的侵入率(n=4)Fig.1 Invasion rates of DC2.4 cells induced by H37Rv(n=4)
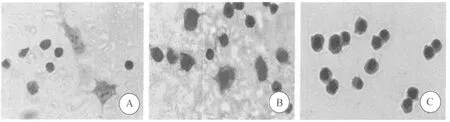
图2 人结核分枝杆菌H37Rv与DC2.4细胞混合培养结果Fig.2 Effects of H37Rv strain co-cultured with DC2.4 cells
2.2 PLC信号通路阻断前后,细胞微丝和F-actin重排率变化 荧光显微镜显示,PLC信号通路阻断前,H37Rv株感染0 h时,DC2.4细胞微丝排列紧密圆滑,网状结构明显;2 h时,细胞微丝开始出现解聚,呈点状分布,点状分布的微丝有聚集现象;4 h时,细胞微丝进一步聚集,形成大小不等的环;6~8 h时,多数微丝在细胞膜下边聚明显,形成皮质应力纤维;10 h后,细胞微丝网状结构又有所恢复。而当PLC信号通路阻断后,在各感染时间段,均出现细胞F-actin的重排抑制现象(图3)。H37Rv株与DC2.4 细胞混合培养 2、4、6、8、10、12 h 时,F-actin重排率分别为(26.9±1.5)%、(59.3±2.8)%、(72.7±4.8)%、(78.2±5.9)%、(63.3±2.9)%和(43.2±2.6)%,而PLC信号通路阻断后,相同混合培养时间的F-actin重排率则分别为(18.5±1.2)%、(22.3±1.7)%、(23.6±2.5)%、(24.8±2.3)%、(22.3±1.3)%和(23.8±1.8)%;感染混合培养4、6、8、10 h时,PLC信号通路阻断前的F-actin重排百分率明显高于PLC信号通路阻断后(P<0.05,图 4)。
2.3 PLC信号通路阻断前后细胞微管变化H37Rv株入侵前,DC2.4细胞微管的网络状纤维结构清晰可见,脉络整齐,微管均匀地分布于胞体和突起内。PLC信号通路阻断前、后,H37Rv株与 DC2.4 细胞混合培养2、4、6、8、10、12 h时,均显示细胞微管末出现发生扭曲、断裂、纹理紊乱现象,也无网络状纤维结构解聚出现。从而提示H37Rv株侵入DC2.4细胞时,并不发生细胞微管的重排(图5)。
2.4 PLC信号通路阻断前后,DC2.4细胞细胞浆液和细胞膜液中的PLC的分子表达 与正常对照组比较,PLC信号通路阻断前,H37Rv株与DC2.4细胞混合培养2 h时,细胞膜的PLC分子表达开始升高,至混合培养8 h时达最高(P<0.05);当PLC信号通路阻断后,细胞膜的PLC分子的表达与正常对照相比较,无显著性差异存在(P>0.05);PLC信号通路阻断前细胞膜的PLC分子表达明显高于PLC信号通路阻断后(P<0.05),而细胞浆中PLC分子表达在阻断前、后变化不大。采用单因素方差分析结果也显示,PLC信号通路阻断前,细胞膜PLC分子表达在组内存在显著性差异(F值471.39,P <0.01),共育 4、6、8、10、12 h 的 PLC分子表达在各组内也存在显著性差异(P<0.01)。从而提示:PLC信号通路阻断前PLC分子主要存在于DC2.4细胞细胞膜中,通过PLC信号分子抑制剂U73122阻断了PLC信号通路,则主要是通过抑制了DC2.4细胞细胞膜中PLC分子表达来完成的,而对细胞浆中PLC分子表达影响不大(表1)。
3 讨论

图3 DC2.4细胞微丝的变化Fig.3 The microfilament aggregation in the DC2.4 cells
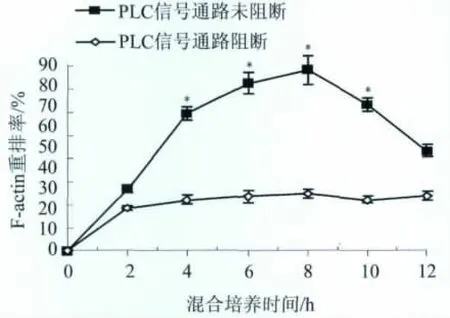
图4 PLC抑制剂U73122对H37Rv株引起DC2.4细胞F-actin重排的影响(n=4)Fig.4 The influence of PLC inhibitor U73122 on the rearrangements of F-actin in DC 2.4 cells infected with H37Rv strain(n=4)
随着结核分枝杆菌耐药菌株的不断增加以及HIV与MTB的双重感染,促使人们对结核病的发病机制进行更为深入的研究。病原菌侵袭宿主细胞是传染建立的重要环节,病原菌常借助宿主细胞骨架的高度可塑性及运动功能而侵袭细胞[8]。细胞骨架包括微丝(MF)、微管(MT)、中间纤维,并具有保持细胞外形、维持细胞结构稳定等重要功能。MT贯穿整个细胞质,一端与细胞膜相连,另一端与细胞核相连。细胞骨架具有锚定亚细胞结构如细胞核、线粒体等作用。研究证实MT与线粒体外膜联系,游离核糖体附着于MT与MF的交叉点上,参与细胞内蛋白质的合成与信号的转导[9]。宿主细胞受到病原菌刺激时,通过细胞骨架重排,引起线粒体通透性转换孔(MPTP)开放,导致线粒体外膜通透性增高,线粒体膨胀,从而影响能量代谢及细胞色素C释放,诱导细胞凋亡的发生。此外,病原菌黏附宿主细胞后,主要激活胞内PLC信号通路,引起胞内Ca2+浓度增加,触发微丝肌动蛋白(F-actin)细胞骨架重排,结果导致黏附的病原菌以内吞方式入侵宿主细胞。DC是机体内最有力的专职抗原呈递细胞,既能启动初始免疫应答,也能负向调控免疫反应,在抗MTB感染中起着核心作用。然而对人结核分枝杆菌在侵入 DC时,能否通过激活胞内PLC分子,触发DC细胞骨架重排而侵入DC的机制尚不清楚。
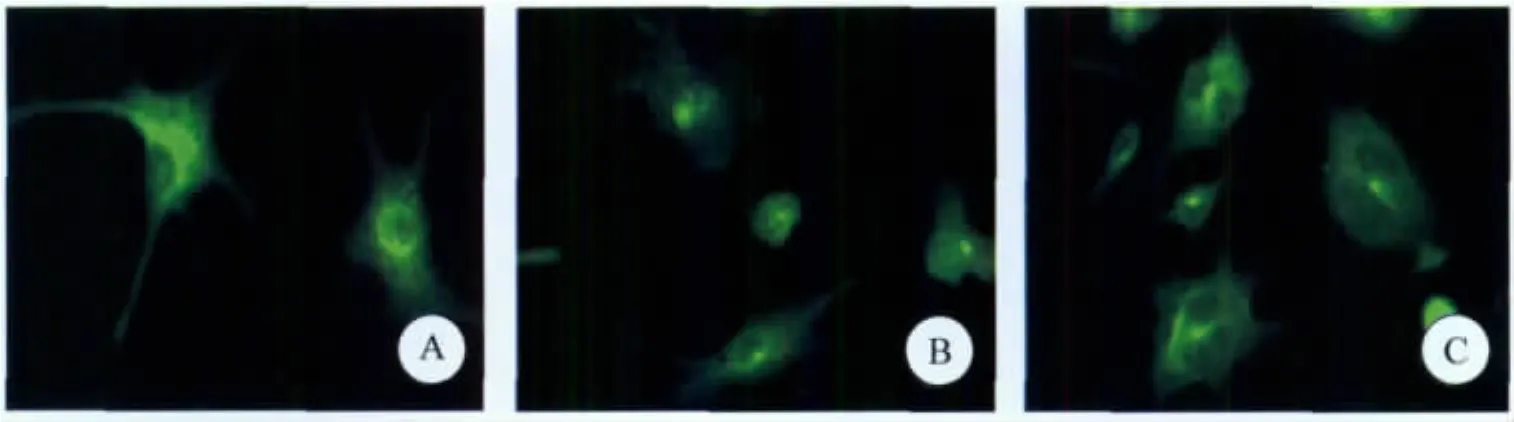
图5 DC2.4细胞微管的变化Fig.5 The microtubule aggregation in the DC2.4 cells
表1 PLC分子的表达Table 1 Expression of PLC molecules(n=4,,ng·ml-1)

表1 PLC分子的表达Table 1 Expression of PLC molecules(n=4,,ng·ml-1)
a:与正常细胞膜对照组比较,P<0.05;b:与PLC分子阻断后细胞膜组比较,P<0.05;c:与正常细胞膜对照组比较,P>0.05.
组 别共育时间/h 02 46 810 12 F值 P值PLC 阻断前细胞浆 26.5 ±1.727 .5 ±1.8 28.9 ±1.7 31.7 ±2.5 34.3 ±3.9 33.9 ±3.4 33.6 ±3.5 4.65 >0.05细胞膜 30.9 ±2.340 .0 ±3.4a48.7 ±3.8ab93.0 ±9.0ab225.8 ±10.4ab166.4 ±8.8ab105.6 ±6.4ab471.39 <0.01 PLC阻断后细胞浆 26.5 ±1.728 .5 ±1.8 27.9 ±2.2 31.8 ±2.5 33.7 ±3.1 34.8 ±3.5 34.1 ±3.7 3.63 >0.05细胞膜 29.1 ±2.130 .4 ±1.9 35.9 ±2.2c 36.3 ±2.4c 34.1 ±4.6c 37.2 ±3.8c 36.4 ±2.4c 5.49 >0.05正常对照组细胞浆 28.3 ±1.430 .7 ±2.6 29.6 ±1.8 30.7 ±2.4 32.6 ±2.9 31.3 ±3.2 33.6 ±3.8 4.19 >0.05细胞膜 29.5 ±1.830 .2 ±1.9 31.8 ±2.6 33.0 ±2.2 34.7 ±2.7 35.1 ±3.2 36.2 ±3.4 4.94 >0.05 F 值 4.66 4.88 73.69 142.20 426.35 385.77 276.81 83.68 P 值 >0.05 >0.05 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01
本研究发现,人结核分枝杆菌H37Rv株与DC2.4细胞共育2 h,便见有细菌侵入,并呈单个分散排列状粘附或集聚在细胞表面;H37Rv株与 DC2.4 细胞共育 4、6、8、10、12 h 后,DC2.4细胞的侵入率分别为(26.1±4.5)%、(39.9±5.6)%、(51.2±5.9)%、(57.9±6.1)%和(63.9±6.8)%,其中侵入6 h与2 h相比较存在着显著性差异(P<0.05);采用U73122预处理DC2.4细胞30 min后,DC2.4细胞的侵入率则分别为(13.6±3.1)%、(14.2±3.9)%、(15.1±4.3)%、(16.8±4.0)%和(18.3±5.2)%,U73122末处理组的侵入率明显高于U73122预处理组(P<0.05)。此外,在PLC信号通路阻断前H37Rv株入侵DC2.4细胞2、4、6、8、10、12 h 时,F-actin 重排率分别为(26.9±1.5)%、(59.3±2.8)%、(72.7±4.8)%、(78.2±5.9)%、(63.3±2.9)% 和(43.2±2.6)%,而PLC信号通路阻断后,相同感染时间的F-actin重排率则分别为(18.5±1.2)%、(22.3±1.7)%、(23.6±2.5)%、(24.8±2.3)%、(22.3±1.3)%和(23.8±1.8)%。PLC分子阻断前的F-actin重排率明显高于PLC分子阻断后(P<0.05),荧光显微镜观察也发现,H37Rv株与DC2.4细胞共育过程中,DC细胞胞质内MF明显增加,胞膜边缘点状荧光颗粒(MF)增强,并逐渐由点状向线状重排,6~8 h时MF在胞膜内侧重排完整;但在相同混合培养时间段,PLC分子阻断前、后,DC2.4细胞微管则末出现重排现象。从而提示:PLC分子抑制剂U73122可明显降低H37Rv株对DC2.4细胞的侵入率以及DC微丝F-actin重排率,MTB侵入DC主要通过触发DC微丝F-actin细胞骨架重排来完成,而与细胞微管的重排无关。由此,我们推测结核分枝杆菌可通过激活PLC分子,触发DC F-actin细胞骨架重排而侵入至胞内。
众所周知,PLC能水解膜磷脂中的磷脂酰肌醇-4,5二磷酸(PIP2),产生三磷酸肌醇(inositol-1,4,5-trisphophate,IP3)和二酰甘油(diacylglycerol,DAG);IP3主要引起胞内的游离Ca2+增加,从而激活多种Ca2+依赖的反应,如微丝肌动蛋白(F-actin)细胞骨架重排,而DAG则激活蛋白激酶C(PKC)。研究证实,单核细胞增多性李斯特菌在黏附侵入小鼠单核样巨噬细胞J774A.1时,可引起细胞膜表面的PLC分子表达量增高[10]。因此,MTB感染DC时,能否引起细胞膜上的PLC分子表达量的增高值得研究。本实验结果表明,MTB感染后,PLC分子表达量的增加主要存在于DC2.4细胞细胞膜上,且于H37Rv株侵入2 h后,细胞膜中的PLC分子表达量即开始升高,至侵入8 h时达最高。U73122阻断PLC分子表达主要是通过抑制了DC2.4细胞膜中PLC分子来完成的,而对细胞浆液中的PLC分子影响不大。
综上所述,人结核分枝杆菌可通过激活PLC信号分子,触发F-actin细胞骨架重排,进而侵入DC、PLC分子表达量的升高而主要存在于DC细胞膜上。一方面,本研究初步阐明了人结核分枝杆菌侵入DC的机制,另一方面,该研究也为今后在临床治疗中,能否研制出一种药物或疫苗能有效阻止此过程发生而提供了新思路。
[1]RAJA A.Immunology of tuberculosis[J].Indian J Med Res,2004,120:213-232.
[2]KAUFMANN S H.Tuberculosis:back on the immunologists'agenda [J].Immunity,2006,24:351-357.
[3]REECC S T,KAUFMANN S H.Rational design of vaccines against tuberculosis directed by basic immunology[J].Int J Med Microbiol,2008,298:143-150.
[4]PHILPOTT D J,CANTEY,SHERMAN P M,et al.Increased adherence of Escherichia coli RDEC-1 to human tissue culture cells results in the activation of host signaling pathways [J].J Infect Dis,1995,172:136-143.
[5]LIN M,ZHU M X,RIKISA Y.Rapid activation of protein tyrosine kinase and phospholipase C-2 and increase in cytosolic free calcium are required by Ehrlichia chaffeensis for internalization and growth in THP-1 cells[J].Infect Immun,2002,70:889-898.
[6]ELENA G,ELISABETTA I,LUCIETTA F,et al.Infection of human macrophages and dendritic cells with Mycobacterium tuberculosis induces a differential cytokine gene expression that modulates T cell response [J].J Immunol,2001,166:7033-7041.
[7]ISABELLE P,ALAIN L,SERVIN,et al.Piracy of decay-Accelerating factor (CD55)signal transduction by the diffusely adhering strain Escherichia coli C1845 promotes cytoskeletal F-actin rearrangements in cultured human intestinal INT407 cells[J].Infect Immun,1998,66:4036-4042.
[8]AKOMPONG T,SPENCER R L,MCEWEN B S.Glucocorticoids inhibitsoluble phospholipase C activity and cytosolic guanine nucleotide regulatory protein-α1 immunoreactivity in spleen [J].Endocrinology,1993,133:1963-1970.
[9]MIZUSHIMA N,LEVINE B,CUERVO A M,et al.Autophagy fights disease through cellular selfdigestion [J].Nature,2008,451:1069-1075.
[10]WADSWORTH SJ,GOLDFINE H. Listeria monocytogenes phospholipase C-dependent calcium signaling modulatesbacterialentry into J774 macrophage-like cells[J].Infect Immun,1999,67:1770-1778.
——水芹主要害虫识别与为害症状

