大豆耐盐性鉴定体系的建立
柏 锡,吴芳芳,林凡敏,赵晓雯,狄少康,朱延明,李 勇,才 华,纪 巍
(东北农业大学生命科学学院,哈尔滨 150030)
目前,我国盐土面积约2 800万hm2,全国有600万hm2次生盐渍化面积且逐年增加[1]。我国耕地面积急剧减少,盐碱地的利用对解决粮食问题具有巨大潜力。盐碱地的开发利用有多种途径,培育和种植耐盐作物品种是经济有效的方法之一。
大豆是重要的粮食作物、油料作物和工业原料,是中度耐盐植物,受盐渍条件影响显著[2],在盐渍条件下产量下降明显,而盐敏感品种较耐盐品种受盐胁迫影响大。提高大豆的耐盐性方法很多,通过植物基因工程技术培育耐盐大豆新品种,是当前国际上的热门研究课题。建立便捷、稳定的大豆耐盐性鉴定体系,是耐盐大豆种植推广和转基因大豆高效筛选的必要前提。本研究采用沙土水溶液的培养方法,选取本实验室转基因育种中3个主要受体品种绥农28、合丰50和合丰55为材料,分别在种子发芽期(VE期)、第二片三出复叶长出时期(V2期)进行不同浓度NaCl处理,测定多项生理指标,建立3个大豆品种的耐盐转基因大豆筛选体系。
1 材料与方法
1.1 材料
选择东北地区主栽大豆品种绥农28(SN28)、合丰50(HF50)和合丰55(HF55)为材料,由黑龙江省农业科学院提供。
1.2 方法
1.2.1 VE期大豆发芽率的测定
精选籽粒饱满、种皮完整、大小均匀的种子,采用氯气灭菌的方法[4],灭菌12~14 h,将灭菌的种子摆放在经高温消毒(180℃×2 h)后的砂床里,该沙床以12 cm×2 cm的培养皿为容器,内为20目的石英砂。用灭过菌的NaCl溶液进行盐胁迫处理,NaCl处理浓度分别为0、100、150、200、250 mmol·L-1,每个处理使用30粒大豆,并重复3次。于(25±1)℃、光周期18 h/6 h的光照培养箱中进行发芽试验。处理后第7天测定发芽率。
1.2.2 V2期耐盐性的测定
种子用5%NaClO溶液消毒2~3 min,用自来水冲洗后再用蒸馏水浸泡4~5 h[4],待种子充分吸水膨胀后,将其播种于盛有砂性土(细沙∶草炭土=7∶3)的育苗盘中。培养时将育苗盘放入盛有20 L蒸馏水的20 cm×80 cm白钵中,并保持砂性土2/3高度处于水面下。每天向白钵中补入一定量的蒸馏水,以维持水面高度。待幼苗长至V2期,将白钵中的蒸馏水换成不同浓度的NaCl溶液。NaCl处理浓度分别为 0、100、150、200 mmol·L-1,电导率分别维持在800 μs·cm-1、11~12、15~16、20~21 ms·cm-1。每个处理含30粒大豆种子,并重复3次。处理时间约为5~8 d。
1.3 各项生理指标的测定方法
1.3.1 种子发芽率
发芽标准为胚根伸出种脐部分长度超过种子纵径一半为标准,要求胚根发育正常,但胚根弯曲并呈螺旋状盘绕者不予统计。
1.3.2 死亡叶面积率
死亡叶面积率(%)=死亡叶片个数/总叶片数×100%。
统计时以干枯部分占叶片面积的比例来计算(例如只有一半叶片干枯即为1/2个叶片)。
1.3.3 相对株高盐害率
相对株高盐害率(%)=(对照植株平均株高-处理后植株的平均株高)/对照植株平均株高×100%;
株高为幼苗茎与沙土接触面到最新的生长点之间的距离。
1.3.4 相对电导率
取植株第一片三出复叶,保证样品的一致性。用打孔器打9个叶盘浸入20 mL ddH2O中,10 h后用DDS-11A型电导率仪测定电导率,记为R1。沸水浴上加热30 min,冷却后测定电导率,记为R2。相对电导率(%)=R1/R2×100%。
1.3.5 丙二醛含量
称取植物材料0.5~1 g放入研钵中,加入液氮研磨至粉末,加入4 mL 5%TCA,5 000 r·min-1离心10 min。吸取离心的上清液2 mL(对照加2 mL蒸馏水),加入2 mL 0.6%TBA溶液,摇匀。将离心管放入沸水浴中煮沸10 min(自试管内溶液中出现小气泡开始计时),取出试管并冷却,3 000 r·min-1离心15 min,以0.6%TBA 溶液为空白对照测定在532、600和450 nm波长下的吸光度值。
MDA浓度(μmol·L-1)=6.45 ×(D532-D600)-0.56×D450。
MDA 含量(μmol·g-1)=MDA浓度(μmol·L-1)×提取液体积(mL)×10-3/样品重量(g)。
2 结果与分析
2.1 不同浓度NaCl对种子发芽率的影响
盐分可从如下两个方面影响种子的发芽率:一是建立渗透势阻止水分吸收,二是离子毒害。盐分胁迫降低种子储藏物质分解和转化速率,也造成活性氧产生和清除系统动态平衡的破坏,启动膜脂过氧化或脱脂作用,损伤膜脂和膜蛋白,从而抑制种子发芽。不同浓度NaCl处理下大豆的发芽率见图1、2(图1彩版见封三)。随着NaCl浓度的增高,3个品种种子发芽率均在逐渐减小,说明该方法能够保证处理条件的稳定,从而准确地区分不同浓度NaCl对大豆的伤害。绥农28、合丰55和合丰50这3个品种分别在150、200和150 mmol·L-1的NaCl浓度下50%的种子发芽率被抑制。在相同NaCl浓度处理下,3个品种表现出不同的种子发芽能力:合丰55>绥农28>合丰50。这说明种子发芽率可以作为这3个品种耐盐性的一个筛选标准。

图1 不同浓度NaCl对大豆发芽的影响Fig.1 Effect of different concertration NaCl on germination of soybean

图2 盐胁迫下种子发芽率的变化Fig.2 Change of germination rate of soybean under salt stress
2.2 不同浓度NaCl对死亡叶面积率的影响
叶片对生境条件的反应最为敏感。盐胁迫开始时造成植物叶片失绿、叶片生长速率降低,随着盐害的增强,叶片停止生长,叶面积不再增加,叶尖叶缘焦黄,叶柄变软并逐渐死亡[10]。所以,死亡叶面积率是衡量盐害程度的一个重要指标。
本研究观察了3个大豆品种在不同NaCl浓度下的死亡叶面积率(见图3,此图彩版见封三),并进行统计分析,从显著性分析中可以看出,合丰50、合丰55、绥农28分别在200、150、100 mmol·L-1的NaCl处理下死亡叶面积率与对照之间存在显著性差异,因此,选择这3个浓度为大量转基因大豆进行耐盐性分析时所取的处理浓度。通过统计分析,在最大处理浓度200 mmol·L-1NaCl条件下,3个品种死亡叶面积率表现为合丰55>合丰50>绥农28,死亡叶面积率可作为大豆耐盐性的一个筛选标准。

2.3 不同浓度NaCl对相对株高的影响
过量盐分对植物造成渗透胁迫,从而干扰营养离子平衡,盐分通过抑制和诱导多种酶系统来影响植物的正常生长[11]。生物量是植物对盐胁迫反应的综合体现,也是植物耐盐性的直接指标之一。
不同浓度NaCl下的相对株高盐害率见图4。可以看出随着NaCl浓度的增高,大豆株高受到的抑制越严重。在4个处理浓度下,合丰55相对株高减小幅度最大,其次是绥农28,最小的是合丰50。该结果同样显示出合丰55耐盐能力最差。相对株高可以作为大豆耐盐性的一个筛选标准。

图3 不同浓度NaCl对大豆苗期死亡叶面积率的影响Fig.3 Effect of different NaCl concentrations on soybean leaf mortality

图4 盐胁迫下相对株高的变化Fig.4 Change of relative height under salt stress
2.4 不同浓度NaCl对相对电导率的影响
在植物抗逆研究中,细胞膜透性变化已成为一个公认的指标。一般认为耐盐能力强的品种在盐胁迫下,细胞膜透性变化较小,敏感品种则变化较大[12]。Mckay指出可以用相对电导率来表示细胞膜透性的大小,它可以反映植物细胞膜在各种逆境条件下的细胞膜受损程度[3]。
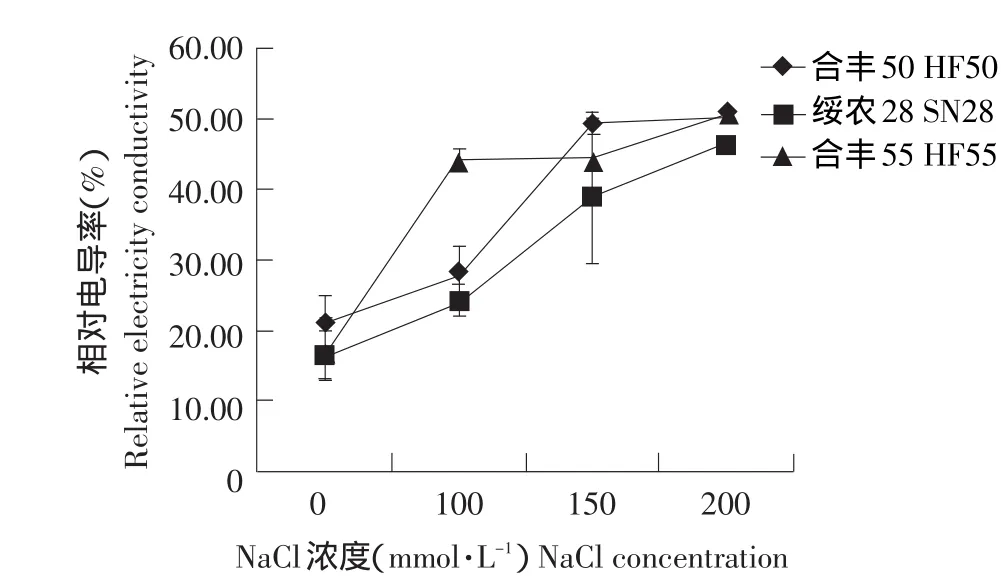
图5 盐胁迫下相对电导率的变化Fig.5 Change of relative electricity conductivity under salt stress
图5列出了不同浓度NaCl处理下的相对电导率,可以看出随着NaCl浓度的增高,叶片相对电导率不断增大。统计分析表明在各个品种中各处理和对照之间都存在着显著差异。结果显示在盐胁迫下合丰55质膜受到的损害最大,其次是合丰50,最小的是绥农28。该结果与死亡叶面积率的分析结果一致。相对电导率可以作为大豆耐盐性的一个筛选指标。
2.5 不同浓度NaCl对丙二醛含量的影响
由图6可知,随着NaCl浓度的增高,丙二醛含量也在增高,说明受到的盐害程度在增大。总体上3个品种间受伤害的程度为:合丰55>合丰50>绥农28。合丰50、合丰55、绥农28分别在200、150、100 mmol·L-1NaCl处理下的丙二醛含量将作为这3个品种耐盐性的一个筛选标准。该结果也与死亡叶面积率等结果一致,同时,从图中可以看出在4个处理浓度下3个品种的变化趋势完全一致。因此,丙二醛含量将作为耐盐性分析的一个理想指标。

图6 盐胁迫下丙二醛含量的变化Fig.6 Change of MDA content under salt stress
2.6 耐盐转基因大豆的筛选
本研究应用该耐盐性鉴定体系,对已经获得的转耐盐基因GsGST14的合丰55的大豆进行耐盐性分析,通过表型试验和生理指标的测定,发现转基因大豆比野生型大豆具有显著的耐盐能力。结果见图7。
从图7中可以看出,受到盐胁迫后,与野生型(合丰55)相比转基因植株的相对电导率和丙二醛含量明显较低,说明转基因大豆植株受到的伤害远远小于非转基因大豆;特别是表型数据相对株高的比较,可以看出,盐胁迫对转基因大豆株高的影响微乎其微,而非转基因大豆株高受到的影响是转基因大豆的几十倍,严重妨害大豆的正常生长和产量。以上结果表明,本文的鉴定体系非常适合于大豆耐盐性鉴定和转基因大豆的筛选。

图7 转基因大豆耐盐性分析Fig.7 Analysis of salt tolerance in transgenic soybean under salt stress
3 讨 论
盐渍土壤是陆地上分布广泛的一种土壤类型,选育具有较高耐盐能力的大豆,对增加粮油需求,改善土壤结构和有机质含量,缓解土壤盐渍化危害具有重要意义。大豆在各个生长阶段对盐胁迫的敏感程度不同,因此,对大豆各生长阶段进行耐盐性分析尤为必要。在大豆发芽期,本研究采用砂培法,整个培养过程中始终使种子处于无菌状态,解决了以往砂培法培养过程中长菌以及用土壤培养法对盐胁迫的缓冲作用。在本研究中采取沙土水溶液法对大豆苗期的耐盐性进行分析,该方法采用疏松的沙土作为营养供给物,用水来传输营养物质并维持不同植株处于相同的生长条件下,在培养过程中通过维持水位一致和电导率一致来保证培养条件的一致性,解决传统水培法需要频繁配制和更换营养液、易长霉菌、植株徒长和工作量大、土培法无法保证土壤环境均一、试验结果重复性较差等问题。
本文采用改良砂培法和沙土水溶液法(结合砂培法和水培法并改进)分别对大豆发芽期与幼苗期的耐盐性分析,结果表明,该方法能有效区分不同品种、不同盐浓度下植株受盐害程度,多个性状和生理指标间具有一致性,说明该方法适合于对大豆进行耐盐性鉴定。随着植物生物技术发展,转基因育种已成为一种快速、有效的手段培育耐逆品种,对这些耐逆转基因品种进行耐逆性分析,是进行推广的前提条件。在本研究中,通过大豆苗期耐盐性分析方法对前期获得的转基因大豆进行耐盐性分析,发现该方法能明显区分转基因大豆和野生型的耐盐能力,进一步证明该方法的可行性。
4 结论
本研究建立大豆耐盐性鉴定体系,其中包括大豆种子发芽期和幼苗期。两个阶段分别采用改良的砂培法、沙土水溶液法,大豆发芽期选取抑制50%大豆萌发的浓度作为评价大豆种子萌发期耐盐性的指标;大豆幼苗期选取死亡叶面积率、相对株高作为形态指标;相对电导率、丙二醛含量作为生理指标;经证明两个方法简单、有效、一致。
[1]孙建昌,王兴盛,杨生龙.植物耐盐性研究进展[J].干旱地区农业研究,2008,26(1):226-230.
[2]郭宝生,翁跃进.大豆耐盐机理及相关基因分子标记[J].植物学通报,2004,21(1):113-120.
[3]Le J D,Dunn S D,Shannon G.Evaluation of a simple method to screen soybean genotypes for salt tolerance[J].Crop Science,2008,48:2194-2200.
[4]刘海坤,卫志明.一种大豆成熟种子的消毒方法[J].植物生理学通讯,2002,38(3):261-263.
[5]Na G Q,He K,Cao M J.Salt and slkaline tolerance evaluation of different soybean varieties at germination stage[J].Soybean Science,2009,28:332-346.
[6]Qi D L,Zhang S Y,Cao G L.Studies on screening methods for alkaline tolerance at germination period and early seedling stage in rice[J].Journal of Plant GenetiResources,2006,7(1):74-80.
[7]Sun X F,Zheng Q S,Liu Y L.Salinity injury to germination and growth of cotton(Gossypium hirsutum L.)at emergence and seedling stages[J].Journal of Lant Resources and Evironment,2000,9(3):22-25.
[8]Patterson B D,Macrea E A,Ferguson I B.Estimation of hydrogen peroxide in plant extracts titanium[J].Analytical Biochemistry,1984,139:487-492.
[9]Zhang J,Jiang C D,Ping J C.Research advances about the effect of salt stress on photosynthesis of plant[J].Journal of Agricultural Sciences,2008,19(3):74-79.
[10]Luo Q Y,Yu B J,Liu Y L.Effect of NaCl on the growth,K+,Na+and Cl-distribution in seedlings of 6 soybean cultivars(Glycine max L.Merrill)[J].Soybean Science,2001,20(3):177-182.
[11]王东明,贾媛,崔继哲.盐胁迫对植物的影响及植物盐适应性研究进展[J].中国农学通报,2009,25(4):124-128.
[12]彭斌.大麦耐盐性研究进展[J].大麦科学,2003(1):26-29.
[13]Mckay H M,Mason W L.Physiologically indicators of tolerance to cold storage in sitka spruce and douglas-fir seedings[J].Canadian Journal Forest Research,1991(21):890-901.
[14]张玉霞,李志刚,李美娟,等.四种草地早熟禾抗盐碱生理生化特性的研究[J].中国农学通报,2004(10):209-213.

