2种氨基酸与葡萄糖美拉德反应产物的抗氧化活性研究
董 乐
(泉州师范学院化学与生命科学学院,福建泉州 362000)
美拉德反应是非酶褐变反应,主要指食品中的氨基化合物与羰基化合物发生的复杂反应。20世纪中叶以来,已有大量关于美拉德反应的文献报道[1-4],主要研究美拉德反应的机理及产物。近20年来,发现美拉德反应产物(Maillard Reaction Products,简称为MRPs)具有一定的抗氧化作用,关于美拉德反应的一大研究领域是其产物的抗氧化性[5]。较完全的美拉德反应生成物有上千种,结构和性质十分复杂,刘平等通过超滤及葡聚糖凝胶色谱技术结合将美拉德产物按分子量大小分级成小于1000、1000~5000和大于5000u三个组分,大于5000u的美拉德产物在较低浓度下DPPH自由基清除率达90%[6-7]。研究者大多用单一的糖与氨基酸反应,通过控制糖、氨基酸种类和反应条件来生成不同组成的美拉德产物混合物。不同反应物和反应条件的美拉德产物的抗氧化性有着明显的差异。郭丽萍等以木糖和甘氨酸为底物,控制不同的物质的量进行美拉德反应,研究了物质的量与MRPs抗氧化能力之间的关系[8]。张严等研究了反应条件对MRPs的褐变程度、荧光吸收强度以及其抗氧化活性的影响[9]。微波加热在食品工业中已广泛应用,但利用微波加热促进美拉德反应鲜见报道。本文通过脯氨酸、L-精氨酸分别与葡萄糖在微波加热下进行美拉德反应,并以抗氧化效果为指标优化美拉德反应条件,为MRPs作为天然抗氧化剂的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
脯氨酸、L-精氨酸、无水葡萄糖、DPPH(1,1-二苯基-2-苦基苯肼)、无水乙醇、盐酸、氢氧化钠等试剂 均为国产分析纯。
格兰仕光波炉 佛山市顺德区格兰仕微波炉电器有限公司;V-1100型可见分光光度计 上海美普达仪器有限公司;微机型台式pH计 上海康仪仪器有限公司;FA2104型电子天平 上海舜宇恒平科学仪器有限公司。
1.2 实验方法
1.2.1 抗氧化活性测定-DPPH法[10]通过比色法来检测MRPs对DPPH自由基(DPPH·)的清除率,用以表征其抗氧化性。由于苯环的共轭和位阻及硝基的电子作用,DPPH·是一种稳定的自由基,其乙醇溶液呈紫色。当DPPH溶液中加入自由基清除剂时,DPPH·的单电子被配对而使其紫色变浅,吸光度变小,而吸光度变小的程度与自由基被清除的程度呈线性关系,因此用其来检测自由基清除情况,以判断MRPs的抗氧化能力。
取MRPs两份,各2mL。一份加入2mL 2×10-4mol/L DPPH溶液,另一份加入2mL无水乙醇;再取2mL 2×10-4mol/L DPPH溶液,加入2mL无水乙醇。常温下反应30min,分别测定其在517nm处的吸光度值,平行测定3次。自由基的清除率计算公式为:

式中:A0为乙醇溶液与DPPH溶液的吸光度值;Ai为MRPs与DPPH溶液的吸光度值;Aj为MRPs与乙醇溶液的吸光度值。
1.2.2 单因素实验
1.2.2.1 反应时间对MRPs抗氧化性的影响 称取脯氨酸1.150g,无水葡萄糖1.980g,使脯氨酸的氨基与葡萄糖的羰基摩尔比为1∶1,将其完全溶解,用NaOH溶液调节溶液pH为9,定容至100mL。称取L-精氨酸1.740g,无水葡萄糖1.980g,使L-精氨酸的氨基与葡萄糖的羰基摩尔比为1∶1,调溶液的pH为10.6,并定容至100mL。分别取15mL反应液于消化管中,置于微波炉,微波功率为800W,加热 1、2、3、4、5、6min后取出,待反应液冷却至室温后测定其对DPPH·的清除率。
1.2.2.2 微波功率对MRPs抗氧化性的影响 称取脯氨酸1.150g,无水葡萄糖1.980g,使脯氨酸的氨基与葡萄糖的羰基摩尔比为1∶1,将其完全溶解,用NaOH溶液调节其 pH为9,定容至100mL。称取L-精氨酸1.740g,无水葡萄糖1.980g,使L-精氨酸的氨基与葡萄糖的羰基摩尔比为1∶1,调溶液pH为10.6并定容至100mL。分别取15mL反应液于消化管中,置于微波炉,调整微波功率分别为160、320、480、640、800W加热,5min后取出,待反应液冷却至室温后测定其对DPPH·的清除率。
1.2.2.3 不同pH对MRPs抗氧化性的影响 称取脯氨酸1.150g,无水葡萄糖1.980g,使脯氨酸的氨基与葡萄糖的羰基的摩尔比为1∶1,将其完全溶解,用NaOH 溶液调节其 pH 分别为 3、5、7、9、11,定容至100mL。称取L-精氨酸1.740g,无水葡萄糖1.980g,使L-精氨酸的氨基与葡萄糖的羰基摩尔比为1∶1,溶解调 pH 分别为 7、8、9、10、11,并定容至 100mL。分别取15mL反应液于消化管中,置于微波炉,微波功率为800W,加热5min后取出,待反应液冷却至室温后测定其对DPPH·的清除率。
1.2.2.4 氨基与羰基比对MRPs抗氧化性的影响 分别称取脯氨酸(0.230、0.230、0.230、0.460、0.575g)、L- 精 氨 酸 (0.348、0.348、0.348、0.696、0.870g) 和 葡 萄 糖 (0.396、0.792、1.188、0.396、0.396g),使脯氨酸、L-精氨酸的氨基与葡萄糖的羰基的摩尔比为 1∶1、1∶2、1∶3、2∶1、2.5∶1,并将其分别完全溶解,脯氨酸组pH调至9并定容至20mL,L-精氨酸组pH调至10.6并定容至20mL。分别取15mL反应液于消化管中,置于微波炉,微波功率为800W,加热5min后取出,待反应液冷却至室温后测定其对DPPH·的清除率。
1.2.3 正交实验设计 通过单因素实验,得出了单个因素的最适条件。选择加热时间(A)、微波功率(B)、pH(C)、氨基与羰基摩尔比(D)4个因素,进行4因素3水平L9(34)3重复正交实验,脯氨酸组和L-精氨酸组的因素水平设计分别见表1、表2。
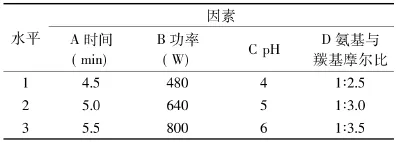
表1 脯氨酸正交实验因素水平表Table1 Experiment factor and level of glucose-proline
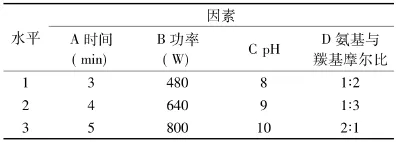
表2 L-精氨酸正交实验因素水平表Table2 Experiment factor and level of glucose-arginine
2 结果与分析
2.1 单因素实验
2.1.1 反应时间对MRPs抗氧化性的影响 由图1可知,在加热时间为1~5min时,MRPs对DPPH·清除率随时间的增加而增加,5min时脯氨酸DPPH·清除率达到最高,随着加热时间的进一步延长,脯氨酸的MRPs对DPPH清除率反而有所下降,这可能是反应体系中的产物随着反应时间的增加而发生了改变,使得抗氧化性减弱。L-精氨酸的MRPs对DPPH·清除率高于脯氨酸,该条件下美拉德反应时间选定5min。
2.1.2 微波功率对MRPs抗氧化性的影响 由图2可知,随着微波功率的增加,MRPs对DPPH·清除率呈现逐渐增大趋势。主要因为微波炉的输出功率大,微波发射次数也多,反应物温度上升较快,高温有利于美拉德反应的进行。微波功率达480W后抗氧化性上升幅度加快,L-精氨酸MRPs的抗氧化性高于脯氨酸近一倍。
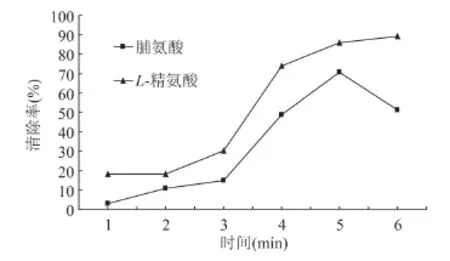
图1 不同加热时间下MRPs对DPPH·清除率的影响Fig.1 Effect of microwave heating time on DPPH radical scavenging activity of MRPs

图2 不同微波功率下MRPs对DPPH·清除率的影响Fig.2 Effect of microwave power on DPPH radical scavenging activity of MRPs
2.1.3 不同pH对MRPs抗氧化性的影响 由图3可知,pH对MRPs抗氧化活性的影响有一定规律,体系pH接近氨基酸的等电点时,其溶解度最小,易形成沉淀物,影响了美拉德反应的进行。在酸性条件下,脯氨酸的MRPs对DPPH·清除率比较强,而在碱性条件下,其清除率有所下降。这可能是因为美拉德反应在酸性条件下生成的一些小分子(如噻吩、噻唑、噁唑、呋喃等)具有抗氧化活性,而在碱性条件下生成的大量吡嗪类小分子却没有抗氧化活性[11]。L-精氨酸的MRPs抗氧化性高于脯氨酸,且随着pH的升高而降低。
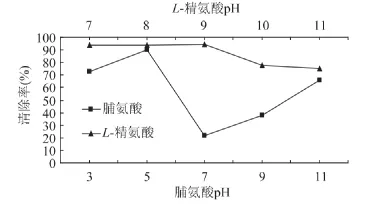
图3 不同pH下MRPs对DPPH·清除率的影响Fig.3 Effect of pH on DPPH radical scavenging activity of MRPs
2.1.4 氨基与羰基比对MRPs抗氧化性的影响 由图 4 可知,在氨基与羰基比 1∶1、1∶2、1∶3 时,随葡萄糖量增加,MRPs对DPPH·清除率也随着增强。当氨基与羰基比1∶3时MRPs的DPPH·清除率最大。氨基与羰基比为2∶1、2.5∶1 时,脯氨酸 MRPs的 DPPH·清除率略有下降,而L-精氨酸MRPs的DPPH·清除率有较大幅度的下降。
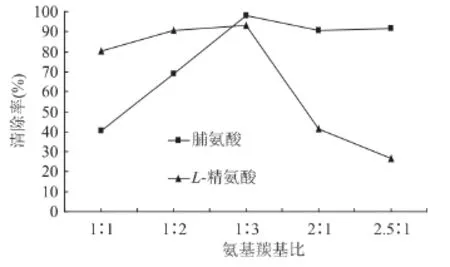
图4 不同氨基与羰基比下MRPs对DPPH·清除率的影响Fig.4 Effect of molar ratios of amine group to carbonyl group on DPPH radical scavenging activity of MRPs
2.2 正交实验
2.2.1 正交实验结果 根据正交实验表,分别在相应条件下反应得到MRPs,并对所得MRPs抗氧化活性进行测定,结果如表3、表4所示。

表3 脯氨酸正交实验结果Table3 The result of glucose-proline orthogonal test
由表3、表4极差结果分析可知:影响MRPs抗氧化活性的最主要因素,脯氨酸美拉德反应是微波功率,其次是时间,再次是pH,影响最小的为比例因素,即主次顺序:B>A>C>D。L-精氨酸美拉德反应影响MRPs抗氧化活性的最主要因素是时间,其次是微波功率,再次是pH,影响最小的为比例因素,即主次顺序:A>B>C>D。脯氨酸和L-精氨酸与葡萄糖反应产生MRPs抗氧化活性的优化水平分别为:A2B3C2D3和A3B3C1D2。
2.2.2 方差分析 根据表5方差分析表,不考虑交互作用,正交实验的正交表没有空白列,所以在方差分析时没有体现出实验模型误差,只有实验误差。F检验结果表明,时间(A)、微波功率(B)、pH(C)、氨基与羰基比(D)4因素对MRPs的抗氧化性质都有极显著影响。
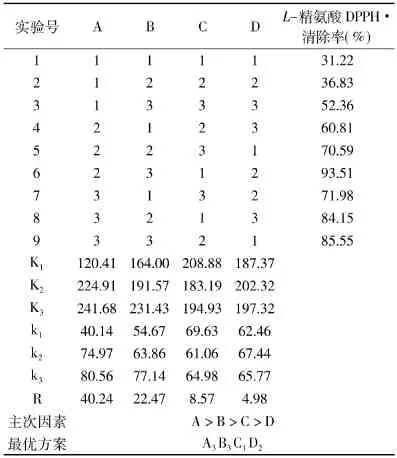
表4 L-精氨酸正交实验结果Table4 The result of glucose-arginine orthogonal test

表5 方差分析表Table5 Results of variance analysis
用最小显著极差法(LSR法)q检验进行各因素各水平均值的清除率差异显著性比较,脯氨酸和L-精氨酸美拉德反应实验各因素中,时间(A)、微波功率(B)、pH(C)选择的水平与其他水平均有显著的差异,脯氨酸美拉德反应实验氨基与羰基比(D)因素的1、3水平间差异不显著,从原料利用率考虑,选择1∶2.5的1水平,最优方案应为 A2B3C2D1。L-精氨酸美拉德反应实验氨基与羰基比(D)因素的2、3水平间差异不显著,同样从原料利用率考虑,选择2∶1的3水平,最优方案应为A3B3C1D3。
按最优组合条件A2B3C2D1、A3B3C1D3进行验证实验,并与参试组合条件下反应所得MRPs比较对DPPH·的清除能力,最优组合条件下脯氨酸和L-精氨酸与葡萄糖反应产生的MRPs对自由基的清除率分别为:98.94%、96.81%,高于参试组合条件反应所得MRPs的最大值97.22% 和93.51%,说明正交实验所得最优组合条件制备的MRPs具有最强抗氧化活性。
3 结论与讨论
本实验以脯氨酸、L-精氨酸和葡萄糖为模型,对微波加热条件下 MRPs的抗氧化性进行研究,用MRPs对DPPH·的清除率来表征其抗氧化性。利用正交实验考察了反应时间、微波功率、反应初始pH、脯氨酸和L-精氨酸与葡萄糖的摩尔比4个因素对MRPs抗氧化活性的影响。结果表明:相比于普通加热方式,微波加热不仅可以缩短加工时间,降低生产成本,而且可提高产率和产品的保藏性[12]。微波加热条件下进行美拉德反应,其反应时间明显快于一般加热方法。鲁伟、张凌燕等对精氨酸与葡萄糖MRPs抗氧化性研究,最佳保温时间是 60~120min[13-14],微波加热只需 5min。微波是否改变了美拉德反应的产物及进程,使其产物更具有抗氧化性还有待于进一步研究。
脯氨酸、L-精氨酸与葡萄糖的MRPs均有较高的抗氧化性,对DPPH·的清除率分别达到98.94%和96.81%。并且是食品加工和储藏过程中产生的一类物质,可以认为是天然的,这给寻找和生产天然抗氧化剂提供了新的思路。
不同反应物反应条件得到的MRPs具有不同程度的抗氧化能力,考察的反应时间、微波功率、反应初始pH、脯氨酸、L-精氨酸与葡萄糖摩尔比4个因素对MRPs抗氧化活性的影响均极显著。影响MRPs抗氧化活性的主次顺序,脯氨酸为:微波功率>加热时间>pH>氨基与羰基比。L-精氨酸为:加热时间>微波功率>pH>氨基与羰基比。MRPs抗氧化活性的最优反应条件,脯氨酸为:微波功率800W,加热时间5min,pH5,氨基与羰基比 1∶2.5。L-精氨酸为:加热时间5min,微波功率800W,pH8,氨基与羰基比2∶1。
[1]Soottawat B,Wittayachai L,Friedrich Br.Antioxidant activity of Maillard reaction productsfrom a porcine plasma protein-sugar model system[J].Food Chemistry,2005,93:189-196.
[2]Jing H,Kitts DD.Antioxidant activity of sugar-lysineMaillard reaction productsin cell free and cell culturesystems[J].Archives of Biochemistry and Biophysics,2004,429:154-163.
[3]Yilmaz Y,Toledo R.Ntioxidant activity of water- solubleMaillard reaction products[J].Food Chemistry,2005,93:273-278.
[4]Ide N,Lau BHS,Ryu K,et al.Antioxidanteffects of fructosyl arginine,a Maillard reactionproduct in aged garlic extract[J].J Nutr Biochem,1999(10):372-376.
[5]毛善勇,周瑞宝,马宇翔,等.美拉德反应产物抗氧化活性[J].粮食与油脂,2003(11):15-16.
[6]Morales FJ,Jimenez-Perez S.Free radical scavenging capacity of Maillard reaction products as related to colourand fluorescence[J].Food Chemistry,2001,72:119-125.
[7]刘平,黄梅桂,张晓鸣,等.不同分子量分布的美拉德产物的呈味特性及抗氧化抗菌活性研究[J].食品工业科技,2012,33(4):64-67.
[8]郭丽萍,王凤舞,刘翠翠.木糖与甘氨酸美拉德反应产物抗氧化性能的研究[J].食品工业科技,2012,33(7):42-44.
[9]张严,汪何雅,钱和.美拉德反应产物的褐变、荧光吸收及抗氧化性的研究[J].食品工业科技,2012,33(6):159-162.
[10]Brand—Williams W,Cuvelier ME,Berset C.Use of a free radical method to evaluate antioxidant activity[J].Llebensm Wiss Technol,1995,28(1):25-30.
[11]邓启辉,余爱农,王发松,等.pH对L-抗坏血酸与L-脯氨酸/L-丙氨酸Maillard反应产物抗氧化活性的影响[J].精细化工,2010,27(10):67-69.
[12]池建伟,魏振承,徐志宏,等.微波技术在食品加工中的应用与发展[J].保鲜与加工,2003(1):7-9.
[13]鲁伟,黄筱茜,柯李晶,等.美拉德反应产物的抗氧化活性研究[J].食品科学,2008,24(4):61-64.
[14]张凌燕,李倩,尹姿,等.3种氨基酸和葡萄糖美拉德产物的物理化学特性及抗氧化活性的研究[J].中国食品学报,2008,8(3):12-22.

