白腐菌发酵培养及诱导剂对漆酶合成的影响
李 鑫,李建科,董 攀,邓文辉
(南昌大学食品科学与技术国家重点实验室,南昌大学生物质转化教育部工程研究中心,江西南昌 330047)
漆酶(Laccasc,EC1.10.3.2.),是一种含铜的多酚氧化酶,1883年首次从日本漆树的汁液中发现[1],随后人们研究发现它广泛存在于植物[2]、昆虫[3]和高等真菌中[4]。漆酶可以催化氧化酚类化合物,脱去羟基上的电子或质子,形成自由基,导致酚类及木素类化合物降解,同时使分子氧被还原为水[5],由于它催化性能特殊,作用底物广泛,引起人们越来越浓厚的兴趣,成为生物、化学和环境领域的研究热点。漆酶最突出的功能是降解纸浆中的木质素、漂白废水、去除废水中的有毒酚类物质,在造纸行业中具有非常大的应用前景。目前,国内外对漆酶的研究有两个方向,一个是寻找合适的载体进行漆酶基因的异源表达,但白腐真菌在活性宿主的高效表达较为困难,使其仍然处于探索阶段[6-8];所以对漆酶的研究主要集中在菌种筛选、培养条件优化、酶的固定化和对污染物的处理等方面[9]。真菌漆酶的合成水平与菌株本身的产酶能力密切相关,同时还受到环境条件的影响,如碳源、氮源、诱导剂等多种因素[10-13],诱导剂添加与否、添加量及添加时间对漆酶酶活的影响十分显著[14]。本实验在液体培养的条件下,研究各种因素对贝壳状革耳菌P.conchatus合成漆酶能力的影响,找出最适合产酶的条件,最大程度的提高漆酶酶活[15-16]。
1 材料与方法
1.1 材料与仪器
贝壳状革耳菌Panus conchatus 由华南理工大学制浆造纸工程国家重点实验室提供;葡萄糖、蔗糖、麦芽糖、可溶性淀粉、酵母膏、蛋白胨、牛肉浸膏 天津市冠前华工经销部;五水合硫酸铜(CuSO4·5H2O)、硫酸铵、苯酚、苯甲酸、尿素 国药集团化学试剂有限公司,分析纯;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、愈创木酚 Sigma公司;豆粉 安阳市奇天生物技术有限公司;麦麸、稻草 购于当地市场。
LRH-250生化培养箱 上海恒一科技有限公司;LS-C50型立式压力蒸汽灭菌器 江阴滨江医疗设备厂;SW-CJ-1FD单人单面净化工作台 苏州净化设备有限公司;UV-7504紫外可见分光光度计 上海欣茂仪器有限公司;PY150-2/2摇床 武汉汇诚生物科技有限公司。
1.2 实验方法
1.2.1 培养基组成及培养条件 液体种子培养基:土豆汁30%,葡萄糖20g/L,蛋白胨1g/L,MgSO43g/L,KH2PO43g/L,pH自然,玻璃珠2颗。在制作种子培养基时,往摇瓶中加2颗玻璃珠,振荡培养时,由于有玻璃珠的存在,菌丝不会长成大颗粒的菌丝球,而是形成浑浊均一的细丝状液体,用移液枪直接吸取定量的菌丝液即可。产酶发酵培养基:土豆汁30%,葡萄糖20g/L,蛋白胨1g/L,MgSO43g/L,KH2PO43g/L,pH自然。培养条件:在250mL三角瓶中,装液量50mL,接种量10mL,培养温度30℃,转速150r/min,振荡培养12d。
1.2.2 培养基优化 碳源筛选:只改变产酶培养基中的碳源种类,浓度均为20g/L,其他条件不变,找出最适合产漆酶的碳源;氮源筛选:只改变产酶培养基中的氮源种类,浓度均为1g/L,其他条件不变,找出最适合产漆酶的氮源;最适C/N:筛选出最适的碳源氮源后,固定碳源浓度为20g/L,改变氮源的含量,使得 C/N 比分别为 5∶1、10∶1、15∶1、20∶1、25∶1。
1.2.3 诱导剂的筛选 在优化后的初始培养基中添加诱导剂,选择麦麸、稻草、Cu2+、ABTS、愈创木酚、苯酚、苯甲酸几种物质作为诱导剂,初步筛选出有诱导效果的诱导剂,并做单因素实验,确定诱导剂的最佳添加量。
1.2.4 Cu2+添加时间及添加量 在初始培养基中首先添加麦麸,然后在不同的培养时间内,添加不同浓度Cu2+,找出Cu2+最适合的添加时间及添加量[14]。
1.2.5 分析测定方法
1.2.5.1 菌丝干重的测定方法 取出250mL的三角瓶中的发酵液,发酵液用8层纱布过滤后,转移至称量瓶,于100~105℃烘箱中烘至绝干,称重。
1.2.5.2 漆酶活力测定漆酶活力的测定 以ABTS为底物,酶液经适当稀释后,用等体积酶液和0.5mmol/L ABTS溶液反应,测定反应前3min内420nm处吸光值的增加量,定义每分钟使1μmol ABTS转化所需要的酶量为1个漆酶活力单位(U)[17]。
2 结果与分析
2.1 接种菌龄的确定
种子质量的优劣直接关系到发酵液中酶活的高低。菌体刚开始时生长缓慢;随着培养时间的增加,菌体吸收培养基中的营养物质,菌丝重量迅速增加,生命力旺盛;继续培养,营养物质消耗,代谢产物开始累积;之后菌体开始衰退。接种时间应选在菌体生命力旺盛的对数时期。如图1所示,为P.conchatus生长曲线。
从图1可以看出,菌体生长的对数期为第3~6d,在第5d菌丝干重急剧增长,此时菌体生命力最旺盛,之后便转入生长稳定期。因此确定菌体的接种种龄为5d。

图1 生长曲线Fig.1 Growth curve
2.2 培养基优化
2.2.1 碳源对漆酶合成的影响 真菌细胞干重的一半是由碳组成的[18],碳源是菌体碳架的来源,并为菌体生长提供能量。考察五种不同的碳源[18-19]对P.conchatus合成漆酶的影响。
从图2可以看出,以葡萄糖为碳源的漆酶酶活最高,达到5693U·L-1。P.conchatus对碳源的利用率依次为葡萄糖>蔗糖、麦芽糖>可溶性淀粉、豆粉。葡萄糖是单糖,蔗糖和麦芽糖是二糖,可溶性淀粉和豆粉是多糖,说明P.conchatus更易利用分子量较小的碳源。
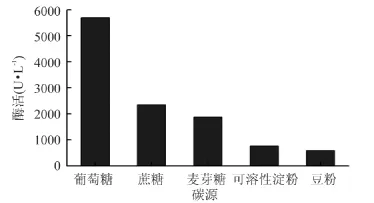
图2 碳源对漆酶合成的影响Fig.2 Effect of carbon source on laccase production
2.2.2 氮源对漆酶合成的影响 氮源对菌体合成蛋白质,核酸等含氮物质有重要作用,直接关系到后期的产酶。不同来源的氮对菌体生长的促进作用不同,考察五种氮源对白腐菌产酶的影响[18-19]。
从图3可以看出,以酵母膏为氮源的漆酶酶活最高,达到6023U·L-1。P.conchatus对氮源的利用率依次为酵母膏>蛋白胨>牛肉浸膏>硫酸铵>尿素。酵母膏是微生物来源的有机氮,蛋白胨和牛肉浸膏是动物来源的有机氮,硫酸铵和尿素是无机氮,总体来说,P.conchatus对有机氮的利用率比对无机氮的利用率高;在有机氮中,微生物来源的氮比动物来源的氮好。
2.2.3 C/N比对产酶的影响 以葡萄糖为碳源,酵母膏为氮源,确定葡萄糖的浓度为20g/L,改变酵母膏的含量,使得 C/N 比分别为 5∶1、10∶1、15∶1、20∶1、25∶1。
从图4可以看出,当C/N比为15时,P.conchatus合成漆酶的酶活最高,达到8795U·L-1。C/N比较小时,氮源充足,发酵液较粘稠,影响菌丝体对氧的吸收;C/N比较大时,碳源充足,对菌丝体生长有利,但不利于菌体产酶;只有当C/N比为15∶1时,菌丝体生长良好,且有利于漆酶分泌。
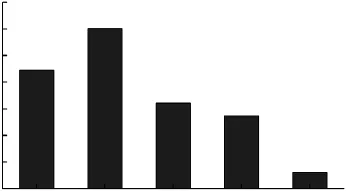
图3 氮源对漆酶合成的影响Fig.3 Effect of nitrogen source on laccase production

图4 C/N比对漆酶合成的影响Fig.4 Effect of C/N on laccase production
2.3 诱导剂对白腐菌分泌漆酶的影响
漆酶是一种能够降解木质素的含铜的多酚氧化酶,在白腐菌产漆酶的过程中,加入一些与木质素有相似结构的化合物,能够诱导漆酶的合成。P.conchatus是一株表达效率较高白腐真菌,它在诱导剂的作用下,能合成高酶活的漆酶,比一般白腐菌合成漆酶的酶活高若干倍。因此选择合适的诱导剂及其用量,是漆酶优化工艺中非常重要的步骤。
2.3.1 诱导剂的筛选 微生物酶类分为组成酶和诱导酶。组成酶是指微生物无论在任何培养基中,总是适量地存在的一些酶类;诱导酶是依赖于酶作用底物或底物结构类似物的存在而合成的酶类。漆酶胞外组成酶产量较低,当添加与木质素或木质素衍生物相关的芳烃类和酚类,能显著提高漆酶酶活[17]。
根据参考的文献资料[20],在优化后的初始培养基中添加诱导剂,选择麦麸、稻草、Cu2+、ABTS、愈创木酚、苯酚、苯甲酸几种物质作为诱导剂,初步筛选出有诱导效果的诱导剂。其中麦麸、稻草的含量为1%,Cu2+、ABTS、愈创木酚、苯酚、苯甲酸的浓度为1mmol/L,同时以不加诱导剂为空白做对比。
从图 5可以看出,麦麸、Cu2+和 ABTS对P.conchatus有显著的诱导效果,其中以Cu2+的效果最为突出,稻草、愈创木酚、苯酚、苯甲酸对P.conchatus的诱导效果不是很明显;而ABTS价格昂贵,所以选择麦麸和Cu2+作为该菌的诱导剂。

图5 诱导剂的筛选Fig.5 Inducers screening
2.3.2 诱导剂添加量单因素实验 麦麸可以作为木质素类似物,能够诱导漆酶的合成,同时,麦麸也作为碳源,为菌丝生长提供能量。通过麦麸添加量的单因素实验,找出麦麸的最适添加量。
从图6可以看出,当麦麸含量为1.5%时,漆酶酶活最高,达到24464U·L-1,漆酶酶活最高;麦麸含量过低,不足以诱导菌体产酶;麦麸含量过高,影响培养基中含氧量,菌体生长欠佳,不利于漆酶合成。
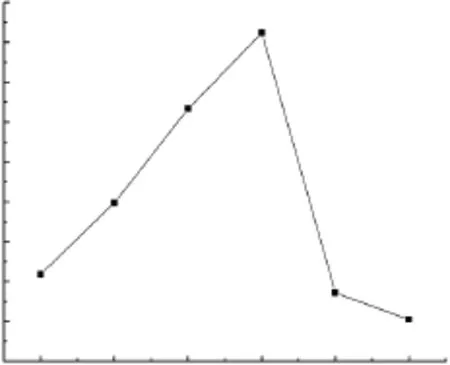
图6 麦麸的添加量对产酶的影响Fig.6 Effect of wheat bran addition on laccase production
漆酶是一种含铜的多酚氧化酶,在培养过程中加入适当浓度的Cu2+,能诱导P.conchatus合成漆酶,显著提高漆酶酶活。
从图7可以看出,当Cu2+浓度为1mmol/L时,漆酶酶活最高,达到 40599U·L-1,在浓度为 0.5~2mmol/L时,对漆酶合成有促进作用;当Cu2+浓度为2mmol/L时,酶活为8903U·L-1,与不加诱导剂时的酶活8795U·L-1相当。过高浓度的Cu2+对菌体有毒性,使得微小的菌丝体难以存活,抑制菌体生长,不但没有促进,反而是抑制了漆酶的合成。此时,Cu2+对P.conchatus诱导合成漆酶的规律是,低浓度具有促进作用,高浓度具有抑制作用。
2.3.3 诱导剂组合实验 选择麦麸和Cu2+的最适添加量(1.5%麦麸与1mmol/L Cu2+搭配),将两者同时添加到初始培养基中,作为组合诱导剂诱导P.conchatus合成漆酶。
从图8可以看出,将麦麸和Cu2+两种诱导剂进行组合,比单独使用一种诱导剂效果更好,两种诱导剂共同作用使酶活达到51004U·L-1。
2.3.4 Cu2+添加时间及添加量 根据2.3.2及2.3.3的实验结果,将麦麸和Cu2+两种诱导剂一起添加到培养基中,能显著提高Panus conchatus合成漆酶的能力,麦麸和Cu2+对Panus conchatus产酶有诱导效果,麦麸可以作为诱导剂添加到培养基中,又可作为培养基的碳源,对漆酶合成没有毒性,但Cu2+对菌丝体生长有毒性,在起始培养基中加入Cu2+时,菌丝体的生长过程受到抑制,微小的菌丝体对Cu2+毒性的耐受度差而死亡,最终使产酶仅由一些较大的菌丝体来完成,若Cu2+浓度超过一定界线,白腐菌合成漆酶的能力反而下降。因此设计实验,在初始培养基中首先添加麦麸,然后在不同的培养时间内,添加不同浓度 Cu2+,找出 Cu2+最适合的添加时间及添加量[14]。
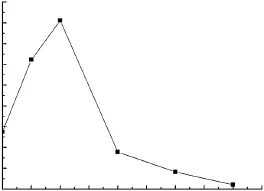
图7 Cu2+浓度对产酶的影响Fig.7 Effect of Cu2+concentration on laccase production
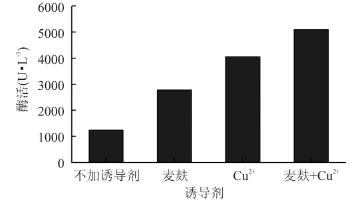
图8 组合诱导剂对合成漆酶的影响Fig.8 Effect of inducers combination on laccase production
从图9可以看出,在发酵第4d,添加Cu2+使其浓度为3mmol/L,漆酶酶活能达到101968 U·L-1。从时间上分析,在第 4d添加 Cu2+酶活最高,此时P.conchatus处于对数期,菌丝体旺盛,生命力强,Cu2+毒性对菌丝体的影响最弱,Cu2+能充分发挥诱导作用;若在起始时添加Cu2+,虽然对漆酶合成有促进作用,但Cu2+的毒性会使一些生命力较弱的菌体死亡,使得发酵液酶活不是很高;在第2d添加Cu2+,菌丝体还处于生长延滞期,Cu2+同样会对菌丝体的生长产生毒性;在第6d添加Cu2+,此时的菌丝体已经即将进入稳定期,开始分泌漆酶,Cu2+的添加不会对菌丝体产生明显的毒性,但是诱导时期偏晚,最终酶活不够高。图7中,在初始培养基(即第0天)中添加1mmol/L Cu2+的酶活最高,为51004U·L-1;图9中改变Cu2+添加时间,Cu2+的最适添加量也随之改变,当Cu2+浓度为3mmol/L时酶活最高,为101968 U·L-1。由此可见,Cu2+不同的添加时间及添加量,对产漆酶酶活有很大影响。

图9 Cu2+添加时间及添加量对合成漆酶的影响Fig.9 Effect of Cu2+add quantity and add time on laccase production
3 结论
3.1 根据P.conchatus的生长曲线可知,该菌株的对数生长期为4~8d,其最适接种种龄为5d。
3.2 P.conchatus的最优碳源是葡萄糖,对碳源的利用顺序依次是单糖>二糖>多糖;最优氮源是酵母膏,对氮源的利用顺序依次是微生物来源氮>动物来源氮>无机氮;最适C/N比为15。
3.3 麦麸、Cu2+和ABTS对P.conchatus诱导作用比较明显;以麦麸为诱导剂,当含量为1.5%时,酶活达到27880U·L-1;以Cu2+为诱导剂,当浓度为1mmol/L时,酶活达到 40599 U·L-1;若将 1.5%麦麸与1mmol/L Cu2+搭配,比单独使用一种诱导剂的效果更好,能达到 51004U·L-1。
3.4 在发酵第4d添加3mmol/L Cu2+,漆酶酶活能达到101968U·L-1,比在初始培养基中添加1mmol/L Cu2+所达到的酶活高了将近两倍。
3.5 Cu2+对P.conchatus合成漆酶具有诱导性和毒性,若在培养初期加入Cu2+,其作用表现为低浓度促进,高浓度抑制;培养一段时间再加入Cu2+,菌丝体耐受力增强,Cu2+毒性减弱,能充分发挥诱导作用。
[1]黄干明.漆酶高产菌株的诱变选育及其酶的分离纯化、性质和基因克隆研究[D].雅安:四川农业大学,2006.
[2]Hüttermann A,Mai C,Kharazipour A.Modification of lignin for the production of new compounded materials[J].Appl Microbiol Biot,2001,55(4):387-394.
[3]Kramer K J,Kanost M R,Hopkins T L,et al.Oxidative conjugation of catechols with proteins in insect skeletal systems[J].Tetrahedron,2001,57(2):385-392.
[4]Raeden U,Broda P.Comparison of the lignin-degrading white-rot fungi Phanerochaete chrysosporium and Sporot richumpulverulentum at the DNA level[J].Current Genetics,1984,8(7):499-506.
[5]Johannes C,Majcherczyk A,Hüttermann A.Oxidation of acenaphthene and acenaphthylene by laccase ofTrametes versicolor in alaccase-mediatorsystem[J].Journalof Biotechnology,1998,61(2):151-156.
[6]Hoshida H,Nakao M,Kanazawa H,et al.Isolation of five laccase gene sequences from the white-rot fungus Trametessanguinea by PCR,and cloning,characterization and expression of the yeast cDNA in yeasts[J].Journal of Bioscience and Bioengineering,2001,92(4):372-380.
[7]Otterbein L,Record E,Longhi S,et al.Molecular cloning of the cDNA encoding laccase from Pycnoporus cinnabarinus I-937 and expression in Pichia pastoris[J].European Journal of Biochemistry,2000,267(6):1619-1625.
[8]司静,李伟,崔宝凯,等.真菌漆酶性质、分子生物学及其应用研究进展[J].生物技术通报,2011(2):48-55.
[9]Couto S R,Toca-Herrera J L.Laccase production at reactor scale by filamentous fung[J].Biotechnology Advances,2007,25(6):558-569.
[10]Manda K,Hammer E,Mikolasch A,et al.Laccase-induced cross-coupling of 4-aminobenzoic acid with para-dihydroxylated compounds 2,5-dihydroxy-N-(2-hydroxyethyl)-benzamide and 2,5 - dihydroxybenzoic acid methyl ester[J].Journal of Molecular Catalysis B:Enzymatic,2005,35(4):86-92.
[11]Gnanamani A,Jayaprakashvel M,Arulmani M,et al.Effect of inducers and culturing processes on laccase synthesis in Phanerochaete chrysosporium NCIM 1197 and the constitutive expression of laccase isozymes[J].Enzyme and Microbial Technology,2006,38(7):1017-1021.
[12]Jaszek M,Grzywnowicz K,Malarczyk E,et al.Enhanced extracellular laccase activity as a part of the response system of white rot fungi:Trametes versicolor and Abortiporus beinnis to paraquat- caused oxidative stress conditions[J].Pesticide Biochemistry and Physiology,2006,85(3):147-154.
[13]胡平平,付时雨,余惠生 .固体培养调节下氮源对P.conchatus酶系及漆酶同工酶的影响[J].纤维素科学与技术,2001(1):1-7.
[14]Galhaup C,Wagnera H,Hinterstoisser B,et al.Increased production of laccase by the wood-degrading basidiomycete Trametes pubescens[J].Enzyme and Microbial Technology,2002,30(4):529-536.
[15]张田田,沈明浩.Plackett-Burman设计和响应面法优化火红密孔菌发酵产漆酶培养基[J].生物工程,2011,32(9):223-226.
[16]付时雨,余惠生.贝壳状革耳菌在固体及液体培养过程漆酶同工酶的产生研究[J].纤维素科学与技术,1998,3(6):32-37.
[17]李慧蓉.白腐真菌生物学和生物技术[M].北京:化学工业出版社,2005:54.
[18]苏东海,苏东民,辛秀兰,等.白腐菌TP21液体培养产漆酶的条件的研究[J].西北农业学报,2009,18(3):249-253.
[19]莫佳琳,付时雨,詹怀宇,等.白腐菌液体培养产生漆酶的研究[J].纤维素科学与技术,2008,1(16):13-19.
[20]高恩丽.云芝漆酶的生产及其应用基础研究[D].杭州:浙江大学,2007.

