用于壳聚糖降解的复合酶制剂产生菌的筛选
阎贺静,胡志平,韩晓红,段春红,王海波,李 佳,梅双喜
(武汉生物工程学院生物工程系,湖北武汉 430415)
壳聚糖在自然界中储量丰富,可再生和可生物降解,由于具有独特的生物活性,广泛应用于食品、化工、医药、纺织及农林牧等领域。但高分子量的壳聚糖水溶性差,溶于弱酸性介质,粘度高,不易吸收,因此壳聚糖的应用开发受到限制。低分子量壳聚糖具有许多高分子壳聚糖无法相比的生理功能和活性,不仅利于人体吸收,还具有抗肿瘤活性、调节肠道菌群、增强免疫力、抵抗微生物感染、促进止血以及诱导植物产生抗毒素等诸多生理活性[1-6]。这些优点使壳低聚糖在食品、生物医药、日用化妆品、农业等方面具有独特的应用价值。目前壳低聚糖的生产方法主要由壳聚糖降解获得,其中以化学法和酶解法为主。酶解法是利用专一性酶或非专一性酶对壳聚糖进行降解的方法。因反应条件温和而被认为极具工业化生产价值。因此,壳聚糖的酶法降解成为目前的研究热点。国内外研究者不断提出采用不同的酶及酶解方法制备高活性的壳寡糖[7-10]。其中,壳聚糖酶(EC.3.2.1.132)被认为是制备壳寡糖最理想的酶制剂,其作用专一,适当控制反应条件即能获得理想分子量的壳寡糖。但由于专一性酶较难获得,成本过高,难以实现商业化。因此,寻找非专一酶来对壳聚糖进行水解就显得尤为重要。目前已发现40多种非专一性酶对壳聚糖具有水解活性。其中,效果较为显著的酶有纤维素酶、果胶酶、脂肪酶、淀粉酶、木瓜蛋白酶等[11-15]。还有研究者发现,采用几种酶例如纤维素酶、α-淀粉酶、蛋白酶等共同作用于壳聚糖,其水解作用比单一酶强[16]。在适当条件下,用这些酶水解壳聚糖可以得到相对分子质量1000~4000的低聚糖[17]。这些非专一性酶来源广泛,价格便宜,成为低聚壳聚糖工业化生产的理想选择。但复合酶的特性及其协同作用的发挥受单一酶的来源及批次的影响很大,最终产品特性随之波动较大,同时也不利于壳聚糖水解条件的控制。因此,制备性质稳定的复合酶制剂有利于生产过程和产品质量的控制。微生物在固态培养条件下酶系较全,生产力高,且许多情况下固态发酵产真菌酶的温度和pH稳定性较高[18-19]。本文利用壳聚糖作为唯一碳源,在固态发酵条件下筛选生产多种壳聚糖降解酶的菌种,并考察了该菌所产复合酶中壳聚糖酶、纤维素酶、α-淀粉酶等酶的酶活,同时确定了该复合酶降解壳聚糖的基本条件,并利用有机溶剂分级沉淀对壳聚糖降解产物进行分析,确定了该菌产复合酶在低聚壳聚糖制备方面的应用潜力。
1 材料与方法
1.1 材料与仪器
土壤样品 采自武汉生物工程学院池塘边、菜地、树林等处;D(+)-Galacturonic acid(半乳糖醛酸) 购于sigma公司;其他试剂 均为分析纯;玉米和豆粕 购于武汉千禾粮贸有限公司;富集培养基1%(NH4)2SO4,0.07%K2HPO4,0.03%KH2PO4,0.5%NaCl,0.05%MgSO4·7H2O,0.1% 葡萄糖,1%胶体壳聚糖,调pH至6.0,壳聚糖单独灭菌(115℃,20min);初筛培养基 1%胶体壳聚糖,0.5%(NH4)2SO4,0.2%K2HPO4,0.5%NaCl,0.1%MgSO4·7H2O,2.0%琼脂,调 pH 至 6.5~7.5,灭菌条件:121℃,20min,壳聚糖胶体液单独灭菌(115℃,20min);复筛培养基 玉米粉∶豆粕 =3∶5;壳聚糖4%;母液(g/L):MgSO40.5,KH2PO40.5,KCl 0.5,FeSO4·7H2O 0.01,ZnSO40.1;(NH4)2SO40.5%;含水量(母液加入量)7mL,121℃灭菌30min。
AB104-N型电子分析天平 上海民桥精密科学仪器有限公司;DJ1C增力电动搅拌器 江苏省金坛市大地自动化仪器厂;722S可见分光光度计 上海市棱光技术有限公司;DK-8D数显恒温水浴锅 金坛市医疗仪器厂;电热恒温干燥箱 天津市泰斯特仪器有限公司;SPX-150B-Z型生化培养箱 上海博迅实业有限公司医疗设备厂;HQ45Z恒温摇床 武汉中科科仪技术发展有限责任公司;净化工作台 济南康宝净化设备有限责任公司;80-2B离心机 常州国华电器有限公司。
1.2 实验方法
1.2.1 产壳聚糖酶菌种的筛选
1.2.1.1 富集培养 取10g土样置于加有90mL无菌生理盐水浸泡1h,温室振荡30min,将样品充分打散。静置后吸1.0mL悬液于液体培养基中30℃振荡培养48h。
1.2.1.2 初筛 将富集培养液进行梯度稀释后,均匀涂布于以壳聚糖为唯一碳源的初筛培养基中。于30℃培养3d。选择平板中菌落周围透明圈直径与菌落直径比值较大的菌落进行第二次平板筛选。
将第一次初筛菌种,点接至初筛平板中,每个平板接种4个点,于30℃中培养3d后,选择透明圈直径与菌落直径比值较大者进行斜面保藏用于复筛。
1.2.1.3 复筛 将初筛菌种孢子制备成孢子悬液,接入到复筛固态培养基中,于30℃培养5d。用醋酸缓冲液浸提酶曲4h,过滤得粗酶液,测定粗酶液中壳聚糖酶酶活。
1.2.1.4 复筛菌种初步鉴定 将复筛菌种接种至初筛平板中,30℃培养3d,每天观察菌落形态并进行记录。挑取培养3d的菌丝和孢子进行乳酸石碳酸棉兰染色,显微镜观察菌丝和孢子形态并记录。根据菌株的形态学特征,参照真菌鉴定手册对该菌株进行初步鉴定。
1.2.2 复合酶产生菌各种酶酶活测定 将筛选获得的菌株接入到复筛固态培养基中,一定条件培养3d后,用醋酸缓冲液浸提酶曲4h,过滤得粗酶液,测定粗酶液中壳聚糖酶、纤维素酶酶活、α-淀粉酶、果胶酶、蛋白酶、木聚糖酶和脂肪酶的酶活。
1.2.3 复合酶对壳聚糖的降解作用
1.2.3.1 复合酶降解壳聚糖的温度 将壳聚糖溶于1%的pH5.0 NaAc-HAc溶液中,配成1%壳聚糖溶液,在不同温度(40、45、50、55、60℃)下进行酶解,反应时间60min,测定酶解液中还原糖的量。
1.2.3.2 复合酶降解壳聚糖的pH 分别以NaAc-HAc缓冲溶液配制浓度均为1%的pH为3.8、4.4、5.0、5.6、6.2的壳聚糖溶液,在50℃进行酶解,反应时间60min,酶解完成后测定酶解液中还原糖的量。
1.2.3.3 复合酶降解壳聚糖时间的确定 将壳聚糖溶于1%的pH5.0 NaAc-HAc溶液中,配成1%壳聚糖溶液,在50℃进行酶解,测定不同酶解时间(1、2、3、4、5h)酶解液中的还原糖的量。
1.2.4 复合酶降解壳聚糖终产物的分级沉淀 采用甲醇-丙酮分级沉淀法[20]。
1.3 检测方法
1.3.1 酶活测定 壳聚糖酶酶活根据Yasushi报道的方法测定[21];纤维素酶酶活根据Bailey报道的方法测定[22];α-淀粉酶酶活测定在 Fisher等所报道方法进行[23];果胶酶酶活根据Brühlmann报道的方法测定[24];木聚糖酶酶活根据 Bailey 的方法测定[25];蛋白酶酶活采用Foline试剂显色法测定[26];脂肪酶酶活根据文献报道的方法测定[27]。
1.3.2 还原糖的测定 用DNS显色法测定酶解液中还原糖的量。
1.3.3 蛋白质含量测定 根据Bradford法测定[28]。
以上实验所有数据均为三次重复实验的平均值。
2 结果与讨论
2.1 产酶菌株的初筛
壳聚糖不溶于水,以壳聚糖为唯一碳源的平板培养基为非透明状,壳聚糖水解后会使培养基变透明,由此初步判定该菌产的酶能够降解壳聚糖。从采集的10种土壤样品中,筛选到6株产酶能力较强的菌株。其菌落周围透明圈直径与菌落直径的比值(D/d)介于0.6~0.9,C-1、C-2 和 C-3 菌株的透明圈较大,结果见表1。

表1 产酶菌株初筛结果Table1 Primary screening results for enzyme production strain
2.2 产酶菌株的复筛
在固态培养基中,微生物产酶量高且酶种类丰富。为了筛选出壳聚糖降解复合酶产生菌,将初筛菌株中透明圈较大者C-1、C-2和C-3接入固态复筛培养基中,发酵后测粗酶液中壳聚糖酶酶活,结果如表2所示。

表2 固态培养复筛结果Table2 Secondary screening results based on solid state fermentation
由表2可见,C-3菌株产壳聚糖酶酶活较高,所以选择C-3作为进一步研究的对象。
2.3 产酶菌株的形态鉴定
C-3菌株在初筛培养基上培养一段时间后,其菌落形态特征如图1所示。

图1 菌落形态特征Fig.1 Colonial morphology of C-3 strain on solid medium
由图1可见,菌株C-3菌落较大,白色,边缘呈绒毛状和絮状,质地疏松,外观干燥,不透明,菌丝白色,产绿色孢子,后期呈黑褐色,菌落与培养基间连接紧密,不易被挑取。
进一步对C-3菌株进行乳酸石碳酸棉兰染色,结果见图2。在显微镜下可见分生孢子头,顶囊呈绿色烧瓶状,小梗单层,排列成木栅状,布满顶囊表面。顶端有链形排列的球状分生孢子,壁表面光滑,在营养菌丝内可见到明显的隔。参照真菌鉴定手册初步判定该菌株为曲霉属。

图2 C-3菌株显微镜检结果Fig.2 C-3 microscope examination results
2.4 C-3产复合酶中各种酶酶活
一般情况下,微生物在固态培养基中的酶系比较丰富。测定C-3固态发酵产复合酶中蛋白质的含量和各种酶的酶活,有利于考察该复合酶的主要酶组分和其含量。C-3复合酶酶液中各酶活及比活力结果如表3所示。
由表3可见,菌株C-3固态发酵酶液中含有多种酶。其中,α-淀粉酶酶活最大为3.229U/mL,壳聚糖酶和纤维素酶的酶活分别为2.206、0.790U/mL。值得注意的是,表3中壳聚糖的水解活性并不是指壳聚糖酶酶活,而是复合酶对壳聚糖降解作用的综合酶活。是复合酶中纤维素酶、淀粉酶、果胶酶等降解壳聚糖的协同作用的表现。据文献报道,纤维素酶来源广泛,且对壳聚糖具有较好的水解作用[11];同时 Pan Sai-kun[14]的报道表明,α-淀粉酶对壳聚糖也有一定的降解作用;其次,果胶酶、脂肪酶及蛋白酶对壳聚糖的降解作用也有报道[12-13]。另外,有研究表明,将纤维素酶、α-淀粉酶、蛋白酶等共同用于壳聚糖的降解,其作用优于单一酶[16]。由此可见,C-3产复合酶中的主要酶制剂均是对壳聚糖有较好降解作用的非专一性酶。由此可以初步推断,C-3复合酶应对壳聚糖有一定的降解作用。
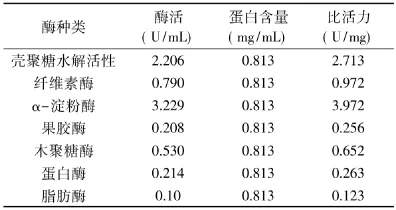
表3 C-3固态发酵酶液中不同酶的酶活及比活力Table3 Different enzymes activity and its specific activity in C-3 solid state fermentation enzyme preparation
2.5 C-3复合酶降解壳聚糖的作用条件
2.5.1 复合酶降解壳聚糖的温度 由图3可知,在实验温度范围内,随温度的升高还原糖的量迅速增加,50℃时达到最高。之后随温度的升高,还原糖的量显著降低。表明,该复合酶降解壳聚糖的最适温度为50℃。

图3 温度对C-3复合酶降解壳聚糖的影响Fig.3 Effect of temperature on chitosan degradation for C-3 complex enzymes
2.5.2 复合酶降解壳聚糖的pH 由图4可见,反应pH由3.8增至5.6时,还原糖的量明显增加;在pH5.6~6.2范围内,反应体系产还原糖的量变化不大。说明此复合酶在pH5.6到pH6.2范围内较为稳定。由于壳聚糖溶于微酸环境,继续增加反应pH将无法保证酶促反应的顺利进行。因此,确定C-3复合酶降解壳聚糖的适宜pH为5.6~6.2。
2.5.3 复合酶降解壳聚糖的酶解时间 对C-3复合酶降解壳聚糖的酶解时间的考察发现,在酶解初期还原糖释放量迅速增加,但酶解时间达到4h后,继续延长时间,反应体系中还原糖的量增加趋缓。这可能是由于酶的失活或底物的减少及产物的增加所造成的。因此,酶解时间以4h为宜。
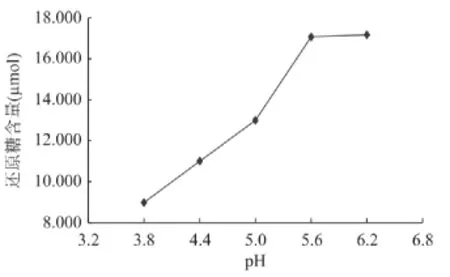
图4 pH对C-3复合酶降解壳聚糖的影响Fig.4 Effect of pH on chitosan degradation for C-3 complex enzymes
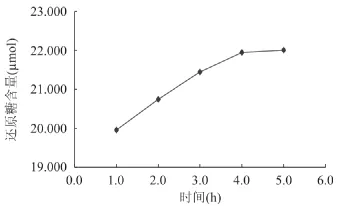
图5 C-3复合酶酶解时间对壳聚糖降解的影响Fig.5 Effect of inculbation time on chitosan degradation for C-3 complex enzymes
2.5.4 复合酶降解壳聚糖终产物分析 分子量对壳聚糖的性质有很大影响,不同分子量的壳聚糖性质差异很大,壳聚糖的许多独特功能只有在分子量降低到一定程度时才表现出来。壳聚糖酶解产物是判断C-3复合酶是否具有应用价值的依据之一。据Muraki报道,DP>16的低聚壳聚糖不溶于50%的甲醇溶液,8<DP<16的低聚壳聚糖溶于50%甲醇溶液而不溶于90%甲醇溶液,同时DP<8的低聚壳聚糖溶于90%甲醇溶液而不溶于90%丙酮溶液[20]。本实验采用甲醇-丙酮分级沉淀可以考察酶解产物中各种低聚壳聚糖的含量,结果如表4所示。

表4 C-3复合酶降解壳聚糖产物的含量Table4 Components of the products from chitosan degradation with C-3 complex enzymes
使用的壳聚糖原材料的聚合度(DP)约为500,由表4可知,壳聚糖经C-3复合酶降解后,8<DP<16和DP<8的产物量分别占总产物的27.9%和41.16%。许多研究表明,聚合度为2~10的壳聚糖具有许多独特的新功能,特别是聚合度6~8的壳寡糖具有高活性的抗肿瘤作用[29]。聚合度3~7的壳寡糖可以增加钙的吸收,从而降低粪便钙的排泄[30]。另外,有研究认为,分子量1500左右的壳寡糖抗菌活性大大高于高分子量的壳聚糖[31]。由此可推断,C-3复合酶在低聚壳聚糖生产方面具有一定的应用潜力。
3 结论
从土壤中筛选出一株降解壳聚糖的复合酶产生菌C-3,该菌株初步鉴定为曲霉菌。C-3复合酶中以壳聚糖酶、纤维素酶、α-淀粉酶为主,它们的酶活分别为2.206、0.790、3.229U/mL。该复合酶降解壳聚糖的条件为温度50℃,pH5.6,酶解时间为4h。该复合酶降解壳聚糖的酶解产物中以DP<16的壳寡糖为主,表明该复合酶在壳寡糖制备方面具有一定应用潜力。
[1]张丽,吴秀刚.壳寡糖的动物营养功能研究进展[J].中国动物保健,2012,14(5):18-19.
[2]刘弘,张艳,汪小伟,等.壳寡糖处理对翠冠梨果实贮藏品质的影响[J].西南大学学报:自然科学版,2012,34(6):30-35.
[3]李昱,许青松,彭强,等.壳寡糖抗炎作用研究进展[J].中国生化药物杂志,2012,33(3):326-328.
[4]曲婉秋,唐晓琳,王秀武.壳寡糖螯合铬对糖尿病小鼠降血糖作用的研究[J].天然产物研究与开发,2012,24(5):605-609.
[5]刘含亮,孙敏敏,王红卫,等.壳寡糖对虹鳟生长性能、血清生化指标及非特异性免疫功能的影响[J].动物营养学报,2012,24(3):479-486.
[6]党一兵,邹明明,王文霞,等.两种不同相对分子质量的壳寡糖对小鼠免疫功能的影响[J].中国海洋药物杂志,2011,30(6):36-39.
[7]Fernandes de Assis C,Araújo A K,Pagnoncelli M G B,et al.Chitooligosaccharides enzymatic production by Metarhizium anisopliae[J].Bioprocess Biosyst Eng,DOI 10.1007/s00449-010-0412-z.
[8]Yao D R,Zhou M Q,Wu S J,et al.Depolymerization of chitosan by enzymes from the digestive tract of sea cucumber Stichopus japonicus[J].African Journal of Biotechnology,2012,11(2):423-428.
[9]Xie H F.Preparation of low molecular weight chitosan by complex enzymeshydrolysis[J].InternationalJournalof Chemistry,2011,3(2):180-186.
[10]窦屾,廖永红,杨春霞,等.酶法降解壳聚糖及产物应用研究[J].食品工业科技,2011,32(12):537-543.
[11]Xia W H,Liu P,Liu J.Advance in chitosan hydrolysis by non-specific cellulase[J].Bioresourece Tecchnol,2008,99:6751-6762.
[12]Kittur F S,Kumar A B V,Varadaraj M C,et al.Chitooligosaccharides-preparation with the aid of pectinase isozyme from Aspergillus niger and their antibacterial activity[J].Carbohydr Res,2005,34:1239-1245.
[13]Lee D X,Xia WS,Zhang J L.Enzymatic preparation of chitooligosaccharides by commercial lipase[J].Food Chem,2008,111(2):291-295.
[14]Pan S K,Wu S J,Kim J M.Preparation of glucosamine by hydrolysisofchitosan with commercialα-amylase and glucoamylase[J].Zhejing Uinv-Sci B(Biomed & Biotechnol),2011,12(11):931-934.
[15]Vishu Kumar A B,Varadaraj M C,Gowd L R,et al.Characterization ofchito-oligosaccharides prepared by chitosanolysis with the aid of papain and Pronase,and their bactericidal action against Bacillus cereus and Escherichia coli[J].Biochem J,2005,391:167-175.
[16]Zhang H,Du Y G,Yu X J,etal.Preparation of chitooligosaccharides from chitosan by a complex enzyme[J].Carbohydr Res,1999,320:257-260.
[17]Xie H F.Preparation of low molecular weight chitosan by complex enzymes hydrolysis[J].InternationalJournalof Chemistry,2011,3(2):180-186.
[18]Holker U,Lenz J.Solid-state fermentation are there any biotechnological advantages? [J].Curr Opn Microbiol,2005,8(3):301-306.
[19]Mateos D J,Rodriguez J A,Roussos S,et al.Lipase from the thermotolerant fungus Rhizopus homothallicus is more thermostable when produced using solid state fermentation than lipuid fermentation procedures[J].Enzyme Microb Technol,2006,39(5):1042-1050.
[20]Muraki E.Preparation and crystallization of D-glueosamine oligosaccharides with dp 6-8[J].Carbohydr Res,1993,239(1):227-237.
[21]Yasushi U,Akira O.Chitosanase from Bacillus species[J].Method Enzymol,1988,161:501-505.
[22]Bailey M J,Nevalainen K M H.Induction,isolation and testing of stable Trichoderrna reesei mutants with improved production of solubilizing cellulose[J].Enzyme Microb Technol,1981(3):153-157.
[23]Fischer E H,Stein E A.α-amylase from human saliva[J].Biochem Prep,1961(8):27-35.
[24]Brühlmann F,Kim K S,Zimmerman W,et al.Pectinolytic enzymes from actinomycetes for the degumming of ramie bast fibers[J].Appl Environ Microbiol,1994,60:2107-2112.
[25]Bailey M J,Biely P,Poutanen K.Interlaboratory testing of methods for assay of xylanase activity[J].J Biotechnol,1992,23:257-270.
[26]邓小雁,朱建兰.Dh菌株胞外蛋白酶及几丁质酶的活性测定[J].细胞农业学报,2006,15(5):128-131,135.
[27]Macedo G A,Park Y K,Pastore G M.Partial purification and characterization of an extracellular lipase from a newly isolated strain of Geotrichum sp.[J].Rev Microbiol,1997,28(2):1-10.
[28]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein- dye binding[J].Anal Biochem,1976,72(1):248-254.
[29]Suzuki K,Mikami K,Okawa Y,et al.Antitumor effect of hexa-N- acetyl chitohexaose and chitohexaose[J].Carbohydr Res,1986(151):403-408.
[30]夏文水,吴焱楠.甲壳低聚糖功能性质[J].无锡轻工大学学报,1996,15(4):297-302.
[31]王秀武,林欣,张丽,等.壳寡糖对肉仔鸡生产性能、小肠组织结构和肌组织矿物质元素含量的影响[J].中国粮油学报,2005,20(2):83-88.

