交联大豆分离蛋白的制备及流变学性质
姜 畔,赵新淮
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨 150030)
酶法交联修饰因其反应条件温和、反应程度易于控制,而被广泛地用于改善蛋白质的功能性[1]。可催化食物蛋白交联的酶类主要有转移酶中的转谷氨酰胺酶[2],以及氧化酶中的酪氨酸酶[3]、葡萄糖氧化酶[4]和过氧化物酶[5]。Mattinen 等[6]研究证实,酪氨酸酶可以导致牛血清白蛋白和β-酪蛋白的交联。Bonet等[4]利用葡萄糖氧化酶交联谷蛋白改善生面团流变学特性,从而改善面包的烘焙特性。Færgemand 等[7]对在 H2O2存在时,辣根过氧化物酶聚合乳清蛋白进行了研究,发现辣根过氧化物酶可促使乳清蛋白中的β-乳球蛋白发生交联从而导致蛋白聚合体生成。在H2O2存在的情况下,辣根过氧化物酶可使蛋白质中酪氨酸残基氧化,进而形成二酪氨酸使蛋白质分子得以交联[8-9]。通过辣根过氧化物酶修饰后,蛋白质的表面疏水性、乳化性及表观黏度等功能性质有显著改善[10]。利用一种氧化酶修饰食品蛋白质的研究已有很多,但利用两种氧化酶协同修饰食品蛋白质的研究还很少见。为此,本研究利用葡萄糖氧化酶氧化葡萄糖产生H2O[11]2,再利用辣根过氧化物酶和H2O2对大豆分离蛋白进行修饰;以修饰产物中相对二酪氨酸含量为指标,采用单因素实验确定一步法处理的适宜条件,并对反应产物及产物酸凝胶的流变学性质进行评价,为蛋白质修饰技术新方法的开发提供初步依据。
1 材料与方法
1.1 材料与仪器
脱脂蛋白粉 哈尔滨高科技蛋白有限公司;葡萄糖氧化酶 西格玛奥德里奇中国有限公司;葡萄糖 天津基准化学试剂有限公司;辣根过氧化物酶上海国源生物技术有限公司;葡萄糖-δ-内酯 郑州阳光化工产品有限公司;盐酸 天津市耀华化工厂;氢氧化钠 北京益利精细化学品有限公司;硼酸 天津市东丽区天大化学试剂厂;碳酸氢钠、无水碳酸钠 天津市巴斯夫化工有限公司。
F-4500型荧光分光光度计 日本日立公司;Gemini II高级流变仪 英国Malvern公司;HZQF160型全温振荡培养箱 哈尔滨东联电子技术开发有限公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白的制备 大豆分离蛋白的制备参照 Zhang 等人[12]的方法。
1.2.2 一步法交联处理适宜条件的选择 配制蛋白质浓度约为4%(w/v)的大豆分离蛋白母液,用0.2mol/L NaOH调节pH至7.0后在92℃水浴加热10min,使蛋白质完全变性。采用单因素实验,通过测定反应后交联产物的相对荧光强度(即相对二酪氨酸含量),考察葡萄糖添加量、葡萄糖氧化酶、辣根过氧化物酶和反应时间对交联产物中相对二酪氨酸含量的影响。反应体系大豆分离蛋白终浓度为3%(w/v),葡萄糖添加量分别为0.18%、0.90%、1.8%、3.6%和7.2%,葡萄糖氧化酶添加量分别为1、2、4、6、8U/g蛋白质,辣根过氧化物酶添加量分别为100、200、300U/g蛋白质。反应混合物置于37℃恒温培养箱内振荡培养,反应时间分别为 0.5、1、2、3、4h。反应结束后,85℃水浴灭酶10min。待反应液冷却至室温后测定其相对荧光强度。
1.2.3 蛋白质含量的测定 采用凯氏定氮法(GB/T 5009.5-2003);盐酸标准滴定溶液配制方法-GB/T 5009.1-2003;溴甲酚绿-甲基红混合指示剂配制方法-GB/T 5009.1-2003。
1.2.4 交联蛋白及其酸凝胶的制备 在一步法交联处理选择的适宜条件下,制备一步法处理和两步法处理的交联蛋白样品,在两步法处理中,首先使用葡萄糖和葡萄糖氧化酶对大豆分离蛋白处理1h后再加入辣根过氧化物酶继续处理2h,反应结束后,85℃水浴灭酶10min,待样品冷却后冻干。
酸化凝胶的制备及其流变学测定参照Li等人的方法[13]。配制质量分数为4%(w/v)的大豆分离蛋白和两种交联蛋白的分散液,调节pH至6.8,40℃下添加葡萄糖-δ-内酯(添加量为0.15g/g蛋白质)后搅拌2min,使其充分混合,40℃下保温2h,形成酸化凝胶(反应后凝胶的终pH约为4.3)。
1.2.5 流变学性质分析 分别配制质量分数为10%的大豆分离蛋白和两种交联蛋白的分散液,调节pH至7.0,选用夹具为锥板(PP40/4°)。将样品分散液缓慢倾注充满夹具,溢出的多余部分用专用的塑料刮勺刮去,盖好保温套,在测量温度25℃下平衡5min。
表观黏度测定:剪切速率的范围为0.1~100s-1,取30个点进行测试。
黏弹性测定:在频率为1Hz下进行振幅扫描,选定应变为0.28%,以保证所测试样品在线性黏弹区域内;然后在0.1~10Hz下进行频率扫描[13]。
葡萄糖-δ-内酯酸化凝胶的流变学测试采用下述条件和方法。选用夹具为平板PP60,测试间距为1mm,上述分散液添加葡萄糖-δ-内酯(添加量为0.15g/g蛋白质)后搅拌2min,再将样品分散液缓慢倾注充满夹具,溢出的多余部分用专用的塑料刮勺刮去,盖好保温套,于测量温度40℃平衡5min。
时间扫描:测定参数条件为频率1Hz,测试应变为1%,测试时间120min。
温度扫描:测定参数条件为加热温度变化40~85℃,加热速率0.5℃/min,测试应变为1%。
1.2.6 相对二酪氨酸含量测定 将样品用0.2mol/L的碳酸盐缓冲溶液(pH9.5)稀释到0.5g/L,在激发波长320nm,发射波长410nm,间隙500μm下测定相对荧光强度(即相对二酪氨酸含量)[14]。
1.2.7 数据统计分析 采用SPSS13.0软件中Duncan’s多重比较对实验数据进行统计分析(α=0.05),利用Excel 2003软件绘图报告结果,其中每组实验或分析重复数为3次。
2 结果与讨论
2.1 葡萄糖添加量对相对二酪氨酸含量的影响
由图1可见,在反应条件为蛋白质分散液质量分数为3%、葡萄糖氧化酶添加量4U/g蛋白质、辣根过氧化物酶添加量200U/g蛋白质、反应时间3h时,随着葡萄糖添加量从0增加到1.8%,交联蛋白中的相对二酪氨酸含量呈显著升高趋势;当葡萄糖添加量高于1.8%时,交联蛋白中的相对二酪氨酸含量随着葡萄糖添加量的增加反而呈显著降低趋势;因此,适宜的葡萄糖添加量为1.8%。
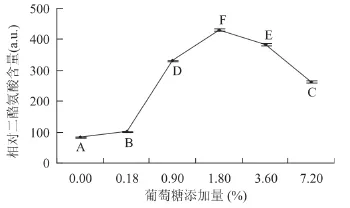
图1 葡萄糖添加量对交联蛋白中的相对二酪氨酸含量的影响Fig.1 Impacts of glucose addition on relative dityrosine content of the cross-linked proteins
2.2 葡萄糖氧化酶添加量对相对二酪氨酸含量的影响
由图2可见,在反应条件为蛋白质分散液质量分数为3%、葡萄糖添加量1.8%、辣根过氧化物酶添加量200U/g蛋白质、反应时间3h时,当葡萄糖氧化酶添加量小于4.0U/g蛋白质时,随着葡萄糖氧化酶添加量的增加,交联蛋白中的相对二酪氨酸含量呈显著升高趋势;但当葡萄糖氧化酶添加量高于4.0U/g蛋白质时,交联蛋白中的相对二酪氨酸含量随着葡萄糖添加量的增加而呈显著降低趋势。因此,适宜的葡萄糖氧化酶添加量为4.0U/g蛋白质。
2.3 辣根过氧化物酶添加量对相对二酪氨酸含量的影响
由图3可见,在反应条件为蛋白质分散液质量分数为3%、葡萄糖添加量1.8%、葡萄糖氧化酶添加量4U/g蛋白质、反应时间3h时,随着辣根过氧化物酶添加量的增加,交联蛋白中的相对二酪氨酸含量呈显著升高趋势。在辣根过氧化物酶添加量从200U/g蛋白质增加到300U/g蛋白质时,添加量增加50%,而交联蛋白的相对荧光强度只增加3%。考虑辣根过氧化物酶的成本,故此,选择辣根过氧化物酶添加量为200U/g蛋白质。
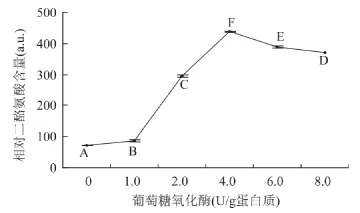
图2 葡萄糖氧化酶对交联蛋白中的相对二酪氨酸含量的影响Fig.2 Impacts of glucose oxidase addition on relative dityrosine content of the cross-linked proteins
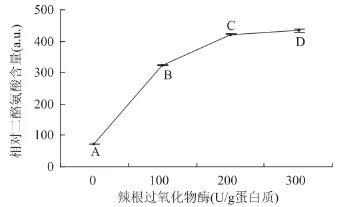
图3 辣根过氧化物酶对交联蛋白中的相对二酪氨酸含量的影响Fig.3 Impacts of HRP addition on relative dityrosine content of the cross-linked proteins
2.4 反应时间对相对二酪氨酸含量的影响
由图4可见,在反应条件为蛋白质分散液质量分数为3%、葡萄糖添加量1.8%、葡萄糖氧化酶添加量4U/g蛋白质、辣根过氧化物酶添加量200U/g蛋白质,当反应时间小于3h时,随着反应时间的延长,交联蛋白的相对荧光强度呈显著升高趋势;当反应时间大于3h时,交联蛋白的相对荧光强度呈降低趋势。故此,适宜的反应时间为3h。
综上,在蛋白质分散液质量分数为3%时,一步法交联反应的适宜条件为葡萄糖添加量为1.8%、葡萄糖氧化酶添加量为4.0U/g蛋白质、辣根过氧化物酶添加量为200U/g蛋白质和反应时间为3h;一步法和二步法处理的交联蛋白,其相对二酪氨酸含量分别为414和381。因此,一步法处理比二步法处理更能促进大豆分离蛋白交联。
2.5 交联产物的性质表征
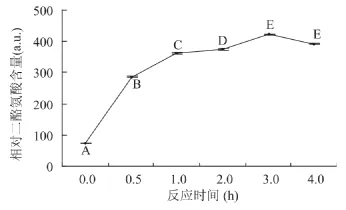
图4 反应时间对交联蛋白中的相对二酪氨酸含量的影响Fig.4 Impacts of reaction time on relative dityrosine content of the cross-linked proteins
2.5.1 剪切速率对表观黏度的影响 从图5可以看出,原料蛋白及2个交联蛋白的分散液皆表现出剪切变稀现象。二元酶系处理的交联蛋白分散液的表观黏度皆高于原料蛋白分散液,并且一步法处理的效果要高于二步法处理。Rha[15]等的研究证明:大豆分离蛋白为牛顿流体,表现为剪切变稀;这与本研究一致。Færgemand[7]等证明交联会导致蛋白中形成大分子物质,使其表观黏度升高。Hiller和Lorenzen[16]对酪蛋白的交联研究进一步证明交联处理会引起表观黏度增加。
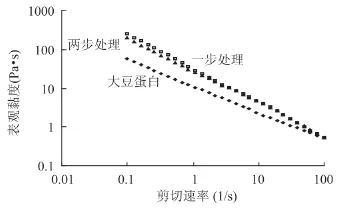
图5 剪切速率对交联蛋白分散液表观黏度的影响Fig.5 Impacts of shear rates on apparent viscosity of the dispersion of the cross-linked proteins
2.5.2 交联处理对黏弹性的影响 从图6中的结果可以看出,3种蛋白质样品分散液的黏性模量、弹性模量由大到小依次为:一步法交联蛋白分散液、二步法交联蛋白分散液、大豆分离蛋白分散液。
蛋白质分散液的表观黏度与蛋白质分子大小、溶剂与蛋白质间的相互作用以及蛋白质与蛋白质间的相互作用有关[17]。Chang等的研究证明,经二元酶系(葡萄糖氧化酶、辣根过氧化物酶)和葡萄糖处理,酪蛋白中有大分子物质形成,并导致其表观黏度、黏性模量和弹性模量增加[18]。因此,本研究得到的交联蛋白具有更好的流变学性质。
2.5.3 交联处理对酸化凝胶弹性模量影响 图7给出了大豆分离蛋白、一步法交联蛋白、二步法交联蛋白在形成酸化凝胶时,时间扫描和温度扫描结果。由此得到的成胶时间、成胶温度分别列于表1。
表1数据显示,二元酶系(葡萄糖氧化酶、辣根过氧化物酶)和葡萄糖处理可以显著降低大豆蛋白酸凝胶的胶凝温度和胶凝时间。葡萄糖-δ-内酯可以降低蛋白体系的pH至蛋白的等电点,从而使蛋白相互聚集,溶解度下降,最终形成凝胶。杨国龙[19]等的研究表明:在pH4.3时(等电点附近),蛋白质分子间的静电相互作用很弱,蛋白质-蛋白质间还有疏水相互作用,疏水相互作用越强,凝胶化温度越低,凝胶化时间越短。而酪蛋白经二元酶系(葡萄糖氧化酶、辣根过氧化物酶)和葡萄糖处理后疏水性增强[20]。所以,二元酶系交联处理有利于大豆蛋白分子之间形成网络结构。因此,降低了凝胶化温度、缩短了凝胶化时间。
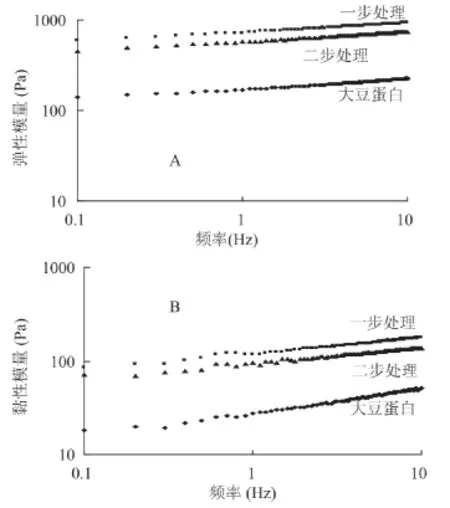
图6 交联处理方法对交联蛋白黏弹性的影响Fig.6 Impacts of cross-linking treatment on viseoelastieity of the dispersion of the cross-linked proteins
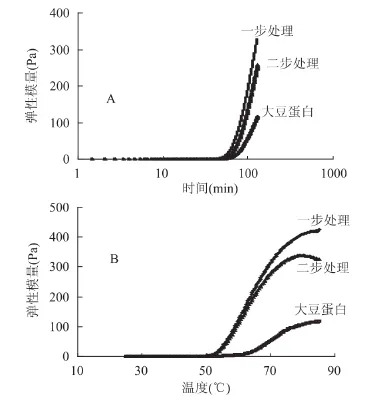
图7 处理方法对酸化蛋白质凝胶弹性模量影响Fig.7 Impacts of cross-linking treatment on elastic modulus of the acid-induced protein gels

表1 交联处理对大豆分离蛋白成胶温度和成胶时间的影响Table1 Impacts of cross-linking treatment on gelation temperature and gelation time of the soybean protein isolate
3 结论
3.1 采用一步法,制备交联大豆分离蛋白的适宜条件为:葡萄糖添加量为1.8%,葡萄糖氧化酶添加量4.0U/g蛋白质,辣根过氧化物酶添加量200U/g蛋白质,反应时间3h。
3.2 经二元酶系处理后的大豆分离蛋白,其弹性模量和黏性模量提高。
3.3 与大豆分离蛋白相比,经二元酶系一步法和二步法处理后,交联蛋白酸凝胶的成胶时间分别缩短15.3%和20.8%,而成胶温度分别降低14.5%和16.1%。
[1]Mannheim A,Cheryan M.Enzyme-modified proteins from corn gluten meal:preparation and functional properties[J].Journal of American Oil Chemists’Society,1992,69(12):1163-1169.
[2]梁华民,田少君,周怡,等.转谷氨酞胺酶对大豆分离蛋白交联聚合作用研究[J].粮食油脂,2004,1(2):3-6.
[3]Partanen R,Torkkeli M,Hellman M,et al.Loosening of globular structure under alkaline pH affects accessibility of βlactoglobulin to tyrosinase-induced oxidation and subsequent cross- linking[J].Enzyme and Microbial Technology,2011,49(2):131-138.
[4]Bonet A,Rosell C M,Caballero P A,et al.Glucose oxidase effect on dough rheology and bread quality:a study from macroscopic to molecular level[J].Food Chemistry,2006,99(2):408-415.
[5]Heijnisa W H,Wierenga P A,Janssen A E M,et al.In-line quantification ofperoxidase-catalyzed cross-linking of(-lactalbumin in a microreactor[J].Journal of Chemical Engineering,2010,157(2):189-193.
[6]Mattinen L M,Lantto R,Selinheimo E,et al.Oxidation of peptides and proteins by Trichoderma reesei and Agaricus bisporus tyrosinases[J].Journel of Biotechnol,2008,133(3):395-402.
[7]Færgemand M,Otte J,Qvis K B,et al.Cross-linking of whey proteins by enzymatic oxidation[J].Journal of Agricultural and Food Chemistry,1998,46(4):1326-1333.
[8]Stahmann M A,Spencer A K,Honold G R,et al.Cross linking of proteins in vitro by peroxidase[J].Biopolymers,1977,16(6):1307-1318.
[9]Matheis G,Whitaker J R.Peroxidase-catalyzed cross linking of proteins[J].Journal of Protein Chemistry,1984,3(1):35-48.
[10]Hiller B,Lorenzen P C.Properties of set- style skim milk yoghurt as affected by an enzymatic or Maillard reaction induced milk protein oligomerisation[J].Journal of Food Science and Technology,2011,44(4):811-819.
[11]Rasiah I A,Sutton K H,Low F L,et al.Cross-linking of wheat dough proteins by glucose oxidase and the resulting effects on bread and croissants[J].Food Chemistry,2005,89(4):325-332.
[12]Zhang Y N,Liu N,Zhao X H.A study on the preparation and some functional properties of a cross-linked casein-gelatin composite by a microbial transglutaminase[J].International Journal of Food Science and Technology,2011,46(12):2641-2647.
[13]Li F,Kong X Z,Zhang C M,et al.Gelation behaviour and rheological properties of acid-induced soy protein-stabilized emulsion gels[J].Food Hydrocolloids,2012,29(2):347-355.
[14]Davies K J,Delsignore M E,Lin S W,et al.Protein damage and degradation by oxygen radicals.II.modification of amino acids[J].Journal of Biological Chemistry,1987,262(20):9902-9907.
[15]Rha C K.Rheology of fluid foods[J].Food Technology,1978,32(7):77-82.
[16]Hiller B,Lorenzen P C.Functional properties of milk proteins as affected by enzymatic oligomerisation[J].Food Research International,2009,42(8):899-908.
[17]Jiang S J,Zhao X H.Transglutaminase- induced crosslinking and glucosamine conjugation of casein and some functional properties of the modified product[J].International Dairy Journal,2011,21(4):198-205.
[18]Damodaran S.Amino acids,peptides,and proteins[M].In Food Chemistry(3rd edition);Fenema O R;Eds.;Marcel Dekker,Inc.:New York,USA,1996,321-429.
[19]杨国龙,赵谋明,杨晓泉,等.改性大豆蛋白的凝胶流变性[J].中国粮油学报,2007,22(6):43-46.
[20]Chang C H,Zhao X H.In vitro digestibility and rheological properties of the caseinates treated by an oxidative system containing horseradish peroxidase,glucose oxidase and glucose[J].International Dairy Journal,2012,27(1-2):47-52.

