土著菌根真菌和混生植物对羊草生长和磷营养的影响
雷 垚,郝志鹏,陈保冬
(中国科学院生态环境研究中心,城市与区域生态国家重点实验室,北京 100085)
生活于同一生境中的植物在不同物种间存在着复杂的相互作用。尽管农业栽培间套作模式中种间促进作用得到了广泛认识[1],但自然生态系统中植物种间相互作用则多表现为争夺空间和资源而直接或间接抑制彼此生长的竞争现象[2]。近年来,植物种间相互作用研究的重点由最初的地上部相互作用[3]向地下部相互作用转移[4-7]。植物在养分胁迫条件下,可以通过其根系发育所具有的高度可塑性,改变根系形态结构,提高其自身对土壤中养分的吸收利用能力[8-9],而植物种间相互过程中根系形态发生改变也是植物适应竞争的重要机制[10-11]。
另一方面,很多研究表明土壤关键功能微生物对植物个体生长和群落演替具有着重要的影响[12]。作为迄今发现的与植物关系最为密切的土壤微生物之一,丛枝菌根真菌(arbuscular mycorrhizal fungi,简称AMF)在自然界中广泛存在,能与绝大多数陆地高等植物形成共生体系[13]。菌根可改善植物对土壤中弱移动性矿质养分(如磷素)的吸收,促进植物的生长。菌根根外菌丝可以在不同植物间中形成菌丝网络,即使非菌根植物也会受菌根真菌的影响[14]。菌根真菌具有改变植物间资源分配,影响植物种间相互作用的潜力[15],其在不同植物个体之间的养分交换、能量流动、信息传递,以及维持生态系统生产力、多样性和系统稳定性方面都具有潜在重要作用[16-17]。
由于环境变化和人类活动的干扰,我国北方草地生态系统普遍面临着严重的退化问题。基于植物种间关系和菌根共生体系对植物群落结构和生产力的潜在影响,本研究以我国北方草甸草原优势植物羊草(Leymus chinensis(Trin.ex Bunge)Tzvelev)为研究对象,以豆科植物紫花苜蓿(Medicago sativa L.)[18]及十字花科植物独行菜(Lepidium spetalum L.)[19]为混生植物进行模拟盆栽试验,以土壤灭菌处理为参照,着重考察土著菌根真菌和不同混生植物对羊草生长及磷营养的影响,旨在全面认识菌根真菌在维持草地植物群落结构和生产力方面的重要作用,为科学管理草地生态系统提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 培养基质
供试土壤采自中国科学院植物研究所多伦恢复生态学试验示范研究站(42.18°N,116.48°E)。土壤理化性质按鲍士旦主编《土壤农化分析》(第三版)所述方法测定[20],具体如下:pH值(水土比1∶2.5)7.02,速效磷(0.5 mol/L NaHCO3提取,钼锑抗比色)6.73 mg/kg,速效氮(碱解氮)8.46 mg/kg。土壤过2 mm筛待用。未灭菌原始土壤菌根真菌孢子密度为17个孢子/g。去除土著菌根真菌处理采用辐射灭菌(25 kGy,中国农业科学院原子能所辐照中心),而后添加土壤微生物滤液[21]以保障除菌根真菌之外灭菌土和原始土具有基本一致的微生物区系。土壤微生物滤液由土壤与灭菌水按体积1∶40比例混合后,于100 r/min匀速振荡30 min,然后经双层滤纸(孔径2—4 μm)过滤获得。试验时过滤液与灭菌土壤按照体积1∶40比例添加。
1.1.2 供试植物
供试植物为羊草(L.chinensis)、紫花苜蓿(M.sativa)和独行菜(L.spetalum)。挑选大小一致且籽粒饱满的种子,用10%H2O2对种子进行表面消毒10 min,再以蒸馏水冲洗多次后于恒温培养箱25°C催芽,出芽后播种。
1.2 试验设计
试验共包括两种土壤处理:保留土著菌根真菌(+M)和去除土著菌根真菌(-M);3种植物组合:羊草和羊草(L.c+L.c)、羊草和紫花苜蓿(L.c+M.s),以及羊草和独行菜(L.c+L.s)混种。试验共6个处理,每个处理设4个重复。
1.3 试验实施
试验中采用容积800 mL的塑料盆(上口径15 cm,下口径10 cm,高13 cm)作为培养容器,每盆装土1 kg。每盆中外围种植优势植物羊草,出苗两周后间苗,每盆留30株。中间定植5株紫花苜蓿或独行菜,并以中间定植羊草为对照处理。考虑到自然条件下优势植物和混生植物种群密度的差异,中间定植羊草株数(10株)设定为两种混生植物的2倍。
试验在中国科学院生态环境研究中心人工智能温室中进行。试验期间保持室内温度为15—25℃,空气湿度为60%。植物生长期间定期浇用去离子水,称重法保持土壤重量含水量在15%(田间持水量70%左右)。植物生长13周后收获。
1.4 收获与分析测定
将植株地上部分和根系分别收获,用自来水和去离子水冲洗干净。根据3种植物的根系形态特征区分和分离不同根系,采用扫描仪(Epson V700,Japan)分别将不同植物根系扫描成电子图像后,应用Win-Rhizo(Regent,Canada)软件分析植物根长和根面积。每种植物的生物量、根长和根面积均以每盆总量为单位进行分析。选取部分根样剪成1cm左右根段,采用曲利苯蓝-根段法测定根系菌根侵染率[22]。剩余根系样品和植株地上部分置80°C烘箱中烘48h后称取植物干重(用于测定菌根侵染率的根系样品根据鲜重折算为干重后计入根系总干重),使用球磨仪(Retsch-MM400,Germany)粉碎后待用。然后准确称取约0.5000 g粉碎植物样品,加入10 mL优级纯硝酸,微波消解萃取仪(CEM-MARS,France)消解,50 mL容量瓶定容,定量滤纸过滤,最后用全谱直读等离子体发射光谱仪(Leeman-Prodigy,USA)测定植物全磷含量。
1.5 数据分析
所有试验数据用Microsoft Excel进行均值和标准误计算并作图,菌根侵染率通过反正弦(arcsin)转化,使用SPSS统计软件(SPSS 16.0 for Windows,SPSS Inc,Chicago,USA)对数据进行统计分析。对羊草相关数据采用双因素方差分析,根据方差分析结果对各处理进行多重比较。通过配对T检验分析每种混生植物观测指标在不同接种处理之间的差异显著性。
2 结果与分析
2.1 菌根侵染率
土壤未灭菌情况下,羊草根系可检测到典型的菌根共生结构,菌根侵染率均在10%以上(表1)。混生植物紫花苜蓿与土著菌根真菌亦形成良好共生,而非菌根宿主植物独行菜鲜见菌根真菌侵染。植物组合对菌根侵染具有显著影响(表1,表2)。与混种羊草相比,混种独行菜情况下羊草菌根侵染率显著升高,而混种紫花苜蓿则无显著变化。去除菌根真菌处理中羊草和混生植物根中基本未见菌根真菌侵染迹象。
2.2 植株生长
土著菌根真菌和混生植物均能影响羊草的生长,且二者存在显著交互作用(图1,表2)。土著菌根真菌对羊草生长存在着显著的负效应。混种独行菜显著降低了羊草的生物量。各处理之间羊草根系生物量与地上部生物量表现出类似的变化趋势。
土著菌根真菌对混生植物的生长具有不同影响(图1):显著降低了羊草的根系生物量(降低了62.5%),地上部生物量也表现出相似的趋势,但差异不显著;显著提高了紫花苜蓿地上部和根系生物量(分别增加87.9%和27.8%);显著降低了独行菜地上部和根系生物量(分别降低了71.8%和53.6%)。

表1 优势植物与混生植物的菌根侵染率Table 1 Mycorrhizal colonization rates of dominant and neighboring plants
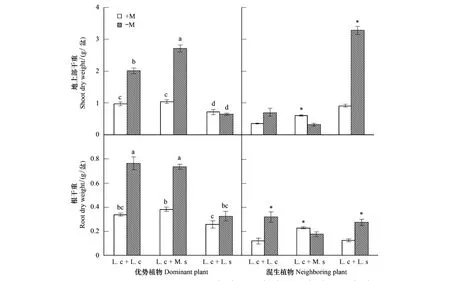
图1 优势植物与混生植物的地上部和根系干重Fig.1 Shoot and root dry weights of dominant and neighboring plants
2.3 植物根系形态
不同混生植物对羊草根系形态指标影响不显著,且与菌根真菌不存在交互效应(表2),而土著菌根真菌显著降低了羊草的根系长度和根表面积(图2)。土著菌根真菌显著降低了混生羊草和独行菜的根系长度和根表面积,对混生紫花苜蓿则无显著影响。
2.3 植株磷含量
土著菌根真菌和植物种间相互作用对优势植物羊草磷含量没有显著影响(图3,表2),而土著菌根真菌对混生植物植株磷含量存在不同的影响(图3):对混生羊草磷含量无显著影响;显著提高了紫花苜蓿的地上部和根系磷含量(分别增加17.14%和91.43%);显著降低了独行菜的地上部磷含量(降低60.08%)。

图2 优势植物与混生植物的根长和根面积Fig.2 Root length and surface area of dominant and neighboring plants
2.4 植物单位根重的根长(比根长)和单位根表面积吸磷量(相对吸磷效率)
土著菌根真菌对优势植物羊草的比根长和根系相对吸磷效率的影响均不显著,且与混生植物不存在交互作用,而不同混生植物显著影响羊草的单位根干重的根长和单位根表面积吸磷量(图4,表2)。
土著菌根真菌对混生植物比根长无显著影响,但与其它混生植物相比,单位重量羊草根系具有较长的根长(图4)。土著菌根真菌显著增加了紫花苜蓿的根系相对吸磷效率(图4)。
3 讨论
羊草是我国北方草甸草原主要建群种之一,对于草原生态系统结构和功能稳定具有重要意义。本试验采用控制模拟试验,证实了丛枝菌根真菌和混生植物可共同影响羊草的生长和根系形态,揭示了丛枝菌根真菌在草原植物群落生态中的潜在作用。研究结果为应用菌根技术促进退化草地生态恢复及草地生态系统科学管理提供了理论依据。
本研究采用土壤灭菌后回接土壤微生物滤液的方法构建去除土著菌根真菌处理,该处理中的优势植物及混生植物均未形成菌根共生(表1),表明试验处理达到了预期效果。土著丛枝菌根真菌菌群对羊草、紫花苜蓿和独行菜3种植物的侵染率存在显著差异,这在一定程度上是由植物种类自身的特性及其与菌根真菌的适合性所决定的。紫花苜蓿是典型的多年生豆科牧草,通常情况下具有较强的菌根依赖性,并被用作菌根研究的一种模式植物。本试验中紫花苜蓿菌根侵染率明显高于羊草,也对菌根共生表现出积极的生长响应。羊草的菌根侵染率低于紫花苜蓿,而且菌根侵染导致其生物量降低,这与羊草具有发达的根系和较强的养分获取能力相关。对于典型非菌根宿主植物独行菜而言,尽管其基本未受菌根侵染,但和其它植物共存在菌根际(mycorrhizoshpere)环境之中,因此其生长和矿质营养也受到菌根的深刻影响。与此同时,混生植物也能够影

图3 优势植物与混生植物的地上部和根系磷含量Fig.3 Shoot and root phosphorus concentration of dominant and neighboring plants
响到羊草菌根的形成和发育。本试验结果显示混种独行菜显著促进了菌根真菌对羊草根系的侵染(表1),这与一些研究中前茬种植十字花科植物会降低后茬植物菌根侵染率的结果不相符[23],但Neumann和 George的研究结果表明菌根真菌缺陷型突变体会促进混种的野生型番茄的菌根侵染[24],也有研究表明十字花科植物根系分泌物同样可以促进菌根的孢子萌发和共生的形成[25]。
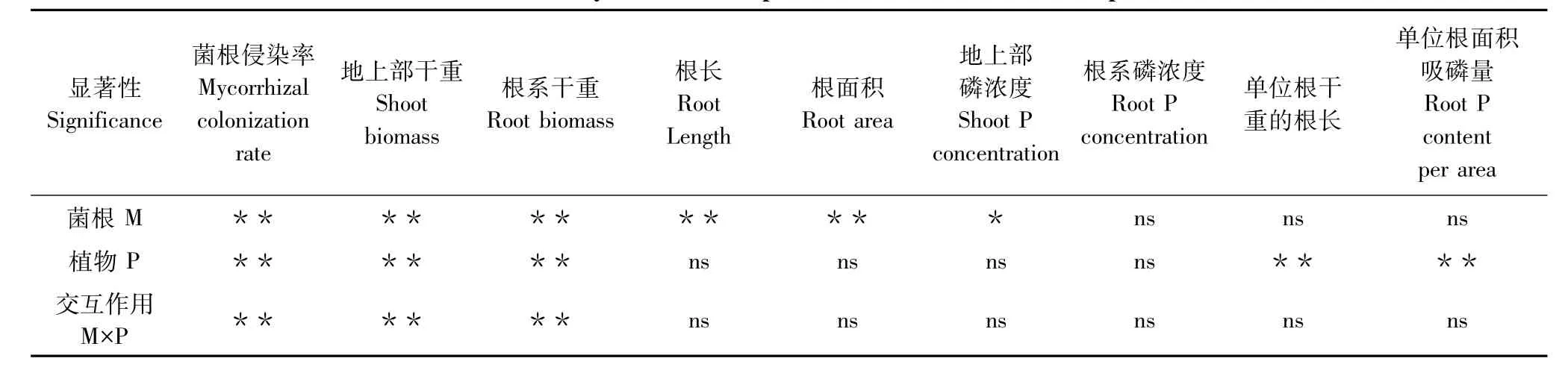
表2 优势植物羊草试验数据的双因素方差分析Table 2 Two-way ANOVA of experimental dada from dominant plants
不同植物对菌根真菌的依赖性存在很大差异,其菌根效应可以是正的、中性的或负的。本研究中供试土壤P元素基本能够满足植物生长需要(图3),土著菌根真菌对优势植物羊草的生长和养分吸收表现出显著的负效应(图1)。菌根真菌与宿主植物间的共生关系是建立在互惠互利基础上的,即菌根真菌向宿主植物提供养分,而从植物那里获得生长所需的光合产物。当土壤有效养分供应充足情况下,宿主植物和菌根真菌之间的互惠共生关系可能就转变为一种偏利共生关系:菌根真菌从宿主植物获取光合产物,但其帮助宿主植物吸收的矿质养分对于植物生长已是无足轻重,因而菌根共生对植物生长没有积极影响,甚至会导致植物生物量下降。同时,植物的菌根依赖性也与植物自身的许多特性相关,如须根系和根毛数量等,须根系和根毛发达的植物其菌根依赖性也相对较弱[26]。本研究中根系形态分析结果同样表明羊草具有较高的比根长,其生长对菌根真菌也表现出负向响应(图2,图4)。相比之下,紫花苜蓿则表现出了较高的菌根依赖性,这与之前的很多研究结果(如黄晶等[27])是一致的。
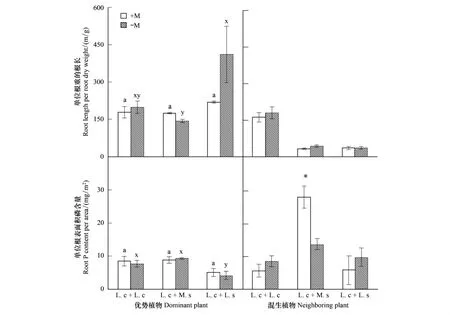
图4 优势植物与混生植物的比根长和单位根表面积吸磷量Fig.4 Specific root length and phosphorus uptake efficiency of dominant and neighboring plants
植物种间相互作用受多种因素的综合影响,如养分竞争、根系分泌物的化感作用、根系自身识别机制等[10,28],其中土壤微生物在其中的作用也受到越来越多的关注[12]。很多研究表明,丛枝菌根真菌能对植物多样性、群落结构、资源分配和系统生产力产生显著影响[14-16]。丛枝菌根真菌与宿主之间较弱的选择性使其在植物群落中可同时侵染多个宿主,并通过菌丝网络将整个植物群落联系在一起,从而影响植物系统内的资源配置,进而调节植物种间相互作用。van der Heijden等发现,不同的AMF能够显著影响禾本科羽状短柄草Brachypodium pinnatum和唇形科夏枯草Prunella vulgaris的共存方式和P资源在两种宿主间的分配[29]。本研究中不同混生植物的菌根依赖性存在明显差异,因此当其与优势植物羊草共存时,菌根真菌也表现出不同的效应。其中,混种独行菜处理显著降低了优势植物羊草的生物量,土著菌根真菌的存在则较好的维持了优势植物羊草的生物量,或者说抵消了独行菜对羊草生长的抑制效应。这项结果证实了丛枝菌根真菌可以调节植物种间相互作用,对不同植物种间获得的资源进行平衡分配,降低某些物种的优势度,促进更多植物物种共存,从而增加植物群落的稳定性和生产力[14]。
本研究证实了土著菌根真菌和混生植物会深刻影响到草原优势植物羊草的生长,同时菌根真菌可以平衡优势物种与邻近物种间的竞争,进而协调植物种间关系。针对菌根在植物个体、群落以及生态系统等不同层次的具体表现,深入分析菌根在植物群落演替中的作用、进一步阐明其在整个生态系统中的功能和生态意义,对于科学管理草地生态系统,保持系统稳定性和生产力具有重要意义。
致谢:吉林省吉生羊草良种站成文革先生为本试验提供羊草种子,北京城市学院吕英硕和王娜娜同学协助完成根系扫描测定,特此致谢。
[1]Li L,Li S M,Sun J H,Zhou L L,Bao X G,Zhang H G,Zhang F S.Diversity enhances agricultural productivity via rhizosphere phosphorus facilitation on phosphorus-deficient soils.Proceedings of National Academy of Sciences USA,2007,104(27):11192-11196.
[2]Semchenko M,Zobel K,Hutchings M J.To compete or not to compete:an experimental study of interactions between plant species with contrasting root behaviour.Evolutionary Ecology,2010,24(6):1433-1445.
[3]Faurie O,Sinoquet H.Radiation interception,partitioning and use in grass-clover mixture.Annals of Botany,1996,77(10):35-45.
[4]O'Brien E,Gersani M,Brown J S.Root proliferation and seed yield in response to spatial heterogeneity of below-ground competition.New Phytologist,2005,168(2):401-412.
[5]Hodge A.Root decisions.Plant Cell and Environment,2009,32(6):628-640.
[6]Murphy G P,Dudley S A.Above-and below-ground competition cues elicit independent responses.Journal of Ecology,2007,95(2):261-272.
[7]Schenk H J.Root competition:beyond resource depletion.Journal of Ecology,2006,94(4):725-739.
[8]Hodge A.Plastic plants and patchy soils.Journal of Experimental Botany,2006,57(2):401-411
[9]Fang S,Gao X,Deng Y,Chen X,Liao H.Crop root behavior coordinates phosphorus status and neighbors:from field studies to three-dimensional in situ reconstruction of root system architecture.Plant Physiology,2011,15(3):1277-1285.
[10]Craine J.M.Competition for nutrients and optimal root allocation.Plant and Soil,2006,285(1/2):171-185.
[11]McNickle G G,St Clair C C,Cahill J F Jr.Focusing the metaphor:plant root foraging behavior.Trends in Ecology and Evolution,2009,24(8):419-426.
[12]Wolfe B E,Husband B C,Klironomos J N.Effects of a belowground mutualism on an aboveground mutualism.Ecology Letters,2005,8(2):218-223.
[13]Li X L,Feng G.Eco-physiology of arbuscular mycorrhiza.Beijing:Sino-Culture Press,2001:178-199.
[14]Klironomos J,Zobel M,Tibbett M,Stock W D,Rillig M C,Parrent J L,Moora M,Koch A M,Facelli J M,Facelli E,Dickie I A,Bever J D.Forces that structure plant communities:quantifying the importance of the mycorrhizal symbiosis.New Phytologist,2011,189(2):366-370.
[15]Bever J D.Host-specificity of AM fungal population growth rates can generate feedback on plant growth.Plant and Soil,2002,244(1/2):281-290.
[16]Hart M M,Reader R J,Klironomos J N.Plant coexistence mediated by arbuscular mycorrhizal fungi.Trends in Ecology and Evolution,2003,18(8):418-423.
[17]van der Heijden,M G A,Klironomos J N,Ursic M,Moutoglis P,Streitwolf-Engel R,Boller T,Wiemken A,Sanders I R.Mycorrhizal fungal diversity determines plant biodiversity,ecosystem variability and productivity.Nature,1998,396(6706):69-72.
[18]Hou Z A,Li P F,Guo S W,Ye J.Effect of NaCl stress on growth and water use efficiency of Aneurolepidium Chinense and Medicago sativa L.in drying soil.Scientia Agricultura Sinica,2002,35(7):894-900.
[19]Chun L.The comparative study on soil characteristics and the characteristics of plant communities under different patterns of uses-as Mongolia Altiplano typical steppe example.MA.Sc.dissertation of Inner Mongolia Agricultural University,2009,26-27.
[20]Bao S D.Soil and Agrochemical analysis(3rd edition).Beijing:China Agriculture Press,2000.
[21]Marschner P,Baumann K.Changes in bacterial community structure induced by mycorrhizal colonization in split-root maize.Plant and Soil,2003,251(2):279-289.
[22]Biermann B J,Linderman R G.Quantifying vesicular-arbuscular mycorrhizae:a proposed method towards standardization.New Phytologist,1981,87(1):63-67.
[23]Schreiner R P,Koide R T.Antifungal compounds from the roots of mycotrophic and non-mycotrophic plant species.New Phytologist,1993,123(10):99-105.
[24]Neumann E,George E.Does the presence of arbuscular mycorrhizal fungi influence growth and nutrient uptake of a wild-type tomato cultivar and a mycorrhiza-defective mutant,cultivated with roots sharing the same soil volume?New Phytologist,2005,166(2):601-609.
[25]Giovannetti M,Sbrana C.Meeting a non-host:the behavior of AM fungi.Mycorrhiza,1998,8(3):123-130.
[26]Janos,D.P.Plant responsiveness to mycorrhizas differ from dependence upon mycorrhizas.Mycorrhiza,2007,17(2):75-91.
[27]Hang J,Ling W T,Sun Y D,Liu J.Impacts of arbuscular mycorrhizal fungi inoculation on the uptake of cadmium and zinc by alfalfa in contaminated soil.Journal of Agro-Environment Science,2012,31(1):99-105.
[28]Falik O,Reides P,Gersani M,Novoplansky A.Self/non-self discrimination in roots.Journal of Ecology,2003,91(4):525-531.
[29]van der Heijden M G A,Wiemken A,Sanders I R.Different arbuscular mycorrhizal fungi alter coexistence and resource distribution between cooccurring plants.New Phytologist,2003,157(3):569-578.
参考文献:
[13]李晓林,冯固著.丛枝菌根生理生态.北京:华文出版社,2001:178-199.
[18]侯振安,李品芳,郭世文,冶军.NaCl胁迫对苜蓿和羊草生长与水分利用的影响.中国农业科学,2002,35(7):894-900.
[19]春兰.不同利用方式下土壤特性及植被群落特征对比研究——以蒙古高原典型草原为例.内蒙古农业大学硕士学位论文,2009,26-27.
[20]鲍士旦.土壤农化分析(第三版).北京:中国农业出版社,2000.
[27]黄晶,凌婉婷,孙艳娣,刘娟.丛枝菌根真菌对紫花苜蓿吸收土壤中镉和锌的影响.农业环境科学学报,2012,31(1):99-105.

