马鹿角蛋白酶解物的抗氧化、抗疲劳和免疫活性
侯 潇,高 建,李春雨,王 铮,金莉莉,王秋雨*
(辽宁大学生命科学院,辽宁 沈阳 110036)
马鹿茸、马鹿骨为可用于保健食品的生物资源。马鹿角为已骨化的鹿茸或锯茸后翌年春季脱落的角基,具有温肾阳、强筋骨、行血消肿的功效[1]。马鹿角胶为马鹿角煎熬而成的胶块,主要成分是蛋白质,含量为83.81%[2],有补肾阳、益精血和抗疲劳及增强机体免疫能力的作用[3-4]。马鹿角胶的蛋白质分子质量大,难以透过生物膜,生物利用度低,通过化学、物理或酶解方法,降低蛋白质分子质量,可提高蛋白质的吸收率和保健功能[5]。据报道[2]鹿角胶经中性蛋白酶水解后能显著提高正常雄性大鼠血清中睾酮水平,提高了鹿角蛋白的功能。大豆蛋白、牛乳酪蛋白、鸡蛋清等通过酶法水解制备的多肽具有良好的免疫活性[6]。
为提高马鹿角的生物利用率和生理药理活性,本实验组在前期工作中研究了马鹿角蛋白的提取和最佳酶解工艺[7]。马鹿角粉碎后,经80~90℃水浸法提取蛋白,3000r/min离心除去不溶物,上清液经浓缩干燥得到马鹿角蛋白。采用1kD超滤膜截留未酶解的蛋白,经浓缩、冷冻干燥得到白色粉末状的马鹿角蛋白酶解物。酶解物易溶于水,多肽含量99%,Tricine-SDS-PAGE鉴定分子质量小于3kD。采用BCA试剂盒测定马鹿角蛋白和酶解物的蛋白含量。本实验研究该酶解物的抗氧化、抗疲劳和免疫活性,并与未水解的马鹿角蛋白进行比较,以期为马鹿角蛋白的精深加工和高效利用提供参考。
1 材料与方法
1.1 动物、材料与试剂
体质量为28~30g的30日龄、清洁级昆明小鼠100只,雌雄各半,购自辽宁中医药大学实验动物部。
马鹿角购于铁岭西丰鹿产品交易中心;马鹿角蛋白及酶解物在本实验室制备得到[7]。
丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒 南京建成生物工程研究所;刀豆蛋白A (ConA) 美国Sigma公司;香菇多糖 浙江普洛康裕天然药物有限公司;其他试剂均为分析纯。
1.2 方法
1.2.1 体外抗氧化活性的测定
将VC配制成质量浓度分别为0.1、0.2、0.4、0.6、0.8mg/mL的溶液,将马鹿角蛋白和马鹿角酶解物分别稀释成10、20、30、40、50mg/mL的溶液。作为待测液备用。
清除O2-·活性的测定采用邻苯三酚自氧化法;清除·OH活性的测定采用水杨酸法;总还原力的测定采用铁氰化钾法[8-10]。

式中:ΔA对照为对照组邻苯三酚自氧化时吸光度每分钟变化量;ΔA样品为样品组邻苯三酚自氧化时吸光度每分钟变化量。

式中:A0为对照组的吸光度;A1为样品组的吸光度。
1.2.2 体内抗氧化活性的测定
30只昆明小鼠,随机分为3组:空白对照组(同体积生理盐水)、马鹿角蛋白组(500mg/(kg·d))、马鹿角蛋白酶解物组(500mg/(kg·d))。实验组蛋白和酶解物灌胃剂量参考海参肽功能研究使用剂量[11]。连续灌胃30d后,摘眼球取血,1500r/min离心取血清,检测马鹿角蛋白酶解前后对血清中SOD活性和MDA含量的影响。具体操作按试剂盒说明书进行[12]。
1.2.3 抗疲劳活性研究
30只昆明小鼠随机分为3组:空白对照组(同体积生理盐水)、马鹿角蛋白组(500mg/(kg·d))、马鹿角蛋白酶解物组(500mg/(kg·d))。连续灌胃给药30d后进行负重游泳、肝糖原、血乳酸3项指标的测定。负重游泳实验:在末次灌胃后30min后,将小鼠的尾部负荷5%体质量的铅皮然后放入水深30cm、水温(25±1)℃的游泳箱中游泳,记录小鼠力竭游泳时间,即从入水至沉入水下10s不能浮出水面的时间[13]。血乳酸测定:小鼠于末次给予受试物30min后,在水深30cm、水温30℃的游泳箱中不负重游泳10min后,眼球采血测定血清血乳酸含量[14]。肝糖原测定:小鼠于末次给予受试物30min后,30℃水箱中游泳10min,颈椎脱臼处死,取肝脏100mg,用蒽酮法测定肝糖原含量[15]。
1.2.4 免疫活性研究
40只昆明小鼠随机分为4组:空白对照组(同体积生理盐水)、阳性香菇多糖组(145mg/(kg·d))、马鹿角蛋白组(500mg/(kg·d))、马鹿角蛋白酶解物组(500mg/(kg·d))。连续灌胃给药30d后进行小鼠碳廓清率和淋巴细胞转化指标的测定[11,16]。
1.2.4.1 小鼠碳廓清率测定
小鼠连续给药30d,按10mL/kg尾静脉注射稀释4倍的印度墨汁,注射后开始计时,分别于2、10min时眼眶取血20μL,立即置于盛有2mL 0.1% Na2CO3溶液的试管中。在波长600nm处测其光密度OD1和OD2,测其吞噬指数α,以表示碳廓清率。

式中:t1、OD1为给墨汁后第一次取血的时间及所测OD值;t2、OD2为给墨汁后第二次取血的时间及所测OD值。
1.2.4.2 ConA诱导小鼠脾淋巴细胞转化实验
小鼠连续给药30d后, 脱颈处死,75%酒精浸泡消毒3min后无菌取脾,将脾磨碎,200目筛网过滤,Hanks液清洗2次,每次洗后1000r/min离心10min,制备单细胞悬液,用RPMI1640培养液调整细胞浓度为3×106个/mL,台酚兰染色应使活细胞数量在95%以上。将一份脾细胞悬液分两孔加入24孔板,每孔1mL,一孔加75μL ConA,另一孔对照,培养68h时每孔吸去0.7mL上清液,加入0.7mL不含血清培养液,同时每孔加入5mg/mL MTT 50μL,继续培养4h。结束后加入1mL酸性异丙醇吹打混匀。测每一份脾细胞悬液在570nm波长处的OD值,脾淋巴细胞增殖能力用OD实验组与OD对照组的差值表示。
1.2.5 数据统计
采用SPSS17.0软件进行单因素方差分析。
2 结果与分析
2.1 马鹿角蛋白酶解物的体外抗氧化能力

图 1 马鹿角蛋白和马鹿角蛋白酶解物的O2-·清除能力(n=3)Fig.1 Comparison of superoxide anion radical scavenging activity between red deer antler protein and hydrolysate(n=3)
由图1可知,马鹿角蛋白酶解物对O2-·的清除能力明显高于同等质量浓度的马鹿角蛋白,随着测试质量浓度的增加而增大。马鹿角蛋白的半清除质量浓度(IC50)为45.57mg/mL,而马鹿角酶解物IC50为10.59mg/mL。阳性照组VC的IC50为0.42mg/mL。

图 2 马鹿角蛋白和马鹿角蛋白酶解物的·OH清除能力(n=3)Fig.2 Comparison of hydroxyl radical scavenging activity between red deer antler protein and hydrolysate (n=3)
由图2可知,马鹿角蛋白酶解物对·OH的清除能力与同等质量浓度的马鹿角蛋白相比,差异极显著,随着质量浓度的增加,其清除能力呈增大的趋势。马鹿角蛋白的半清除质量浓度(IC50)为45.20mg/mL,而酶解物的IC50为7.63mg/mL。阳性对照组VC的IC50为0.28mg/mL。
由图3可知,马鹿角蛋白和酶解物均具有还原能力,且随着质量浓度增加而增大。同等质量浓度的马鹿角蛋白酶解物的还原力高于马鹿角蛋白,统计结果显示两者差异极显著。
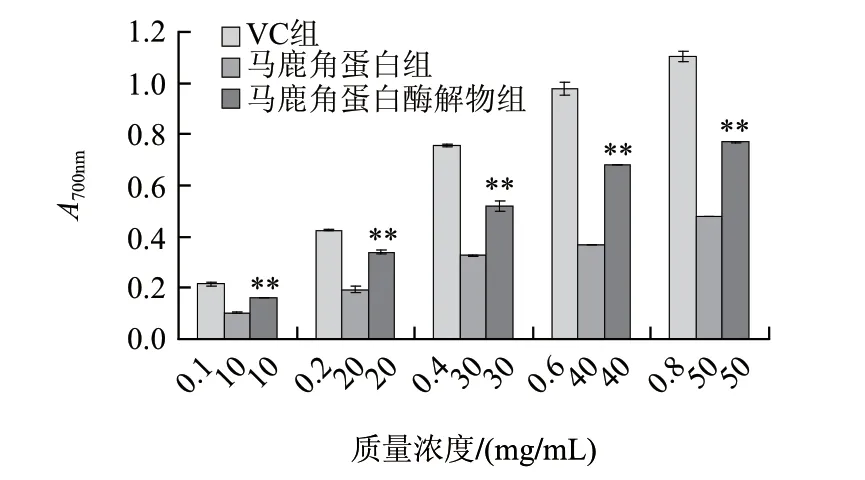
图 3 马鹿角蛋白和马鹿角蛋白酶解物的总还原能力(n=3)Fig.3 Comparison of total reducing power between red deer antler protein and hydrolysate (n=3)
2.2 马鹿角蛋白酶解物的体内抗氧化能力

图 4 马鹿角蛋白和马鹿角蛋白酶解物对小鼠血清中SOD(A)、MDA(B)的影响(n=10)Fig.4 Comparative effects of red deer antler protein and hydrolysate on serum SOD activity (A) and MDA content (B) in mice (n=10)
由图4可知,饲喂马鹿角蛋白组、马鹿角蛋白酶解物组的小鼠SOD活性和MDA含量与空白对照组相比均有极显著差异性,显示抗氧化功能显著,且酶解物组SOD的活性和MDA的减少量均好于马鹿角蛋白组,并具有显著性差异。
2.3 马鹿角蛋白酶解物的抗疲劳活性


图 5 马鹿角蛋白及马鹿角蛋白酶解物对小鼠负重游泳时间(A)、血乳酸含量(B)和肝糖原含量(C)的影响(n=10)Fig.5 Comparative effects of red deer antler protein and hydrolysate on weight-loaded swimming time (A) and blood lactic acid (B) and liver glycogen contents (C) in mice(n=10)
由图5可知,与空白对照组相比,马鹿角蛋白组和酶解物组的小鼠游泳时间延长,乳酸含量降低,肝糖原含量增加,均有显著性或极显著性差异,酶解物的抗疲劳活性更强。
2.4 马鹿角蛋白酶解物的免疫活性

图 6 马鹿角蛋白和马鹿角蛋白酶解物对小鼠碳廓清吞噬指数α(A)和脾淋巴细胞增殖能力(B)的影响(n=10)Fig.6 Comparative effects of red deer antler protein and hydrolysate on carbon clearance index (A) and lymphocyte proliferation (B) in mice (n=10)
由图6可知,马鹿角蛋白和马鹿角蛋白酶解物能提高小鼠碳廓清吞噬指数α和脾淋巴细胞增殖能力,与空白对照组比较差异极显著,且马鹿角蛋白酶解物组活性高于马鹿角蛋白组,具有显著性差异。
3 讨 论
O2-·和·OH是生物体内主要的活性氧自由基,它们可以引起体内脂质过氧化。而使用生物抗氧化剂切断过氧化链式反应,可以抑制机体的自由基损伤,从而保持最佳健康状态和防治相关疾病,延缓衰老[17-18]。SOD对机体的氧化与抗氧化平衡起着至关重要的作用,可专一性清除O2-·,保护细胞免受损伤,MDA含量可以间接反映出机体脂质过氧化的程度[19]。本研究通过对以上指标的检测,显示马鹿角蛋白及其酶解物具有清除O2-·、·OH的能力和总还原力,可提高受试小鼠血清SOD活力并降低MDA含量,与空白对照组相比差异显著,且酶解物组活性高于未酶解的马鹿角蛋白。研究结果表明马鹿角蛋白酶解物具有显著的抗氧化活性。
在抗疲劳实验中,本实验选择测定了受试小鼠负重游泳时间、能量物质肝糖原和代谢产物血乳酸三项指标。各指标在运动时的变化程度与运动负荷强度一致的条件下,可作为动物疲劳的评价指标[20]。力竭游泳时间的长短可以反应受试动物运动抗疲劳的能力[21],疲劳发生的早晚与糖原的储备直接相关,乳酸作为肌肉活动的主要代谢产物,可以通过肌肉乳酸的含量来评价疲劳的程度[22]。持续运动后血乳酸的数值越低,表明疲劳消除越快。通过对以上指标进行实验测定,表明马鹿角蛋白及其酶解物具有抗疲劳功效,与空白对照组比较差异显著,马鹿角蛋白酶解物的抗疲劳作用更强。
巨噬细胞是机体内生物学作用最为活跃的细胞,具有吞噬、杀伤及消化病原体、杀伤肿瘤细胞,并在特异性免疫应答中参与抗原的提呈及免疫调节作用[23]。淋巴细胞是体内免疫活性细胞,淋巴细胞增殖能力的强弱,反应机体免疫功能的高低[24]。本实验通过对碳廓清吞噬指数研究表明:马鹿角蛋白及其酶解物对单核巨噬细胞吞噬功能具有明显的促进作用,能提高小鼠对血中碳粒胶体廓清速度,酶解物组的作用更为明显;用ConA诱导小鼠脾淋巴细胞转化,马鹿角蛋白及其酶解物的促淋巴细胞增殖能力与空白对照组相比较具有显著差异性,后者的作用更明显。
[1] 邱芳萍, 马波, 王志兵, 等. 鹿角盘蛋白的分离纯化与活性研究[J]. 长春工业大学学报, 2007, 28(3): 144-147.
[2] 刘姗娟. 鹿角胶酶解工艺及其产物性能研究[D]. 武汉: 武汉理工大学, 2008.
[3] 苏凤艳, 李慧萍, 王艳梅, 等. 鹿花盘蛋白质的提取与生物活性测定[J]. 动物科学与动物医学, 2001, 18(2): 18-20.
[4] 范玉琳, 邢增涛, 卫功庆, 等. 鹿茸蛋白的提取分离及其抗肿瘤活性[J]. 经济动物学报, 1998, 2(1): 27-31.
[5] HETTIARACHCHY N S, ZIEGLER G R. Protein functionality in food systems[M]. New York: CRC Press, 1994: 261-310.
[6] 柴华, 赵谋明, 王金水. 食品蛋白质酶解改性提高功能特性的研究进展[J]. 食品工业科技, 2008(1): 286-288.
[7] 高健, 李强, 吕磊, 等. 马鹿角蛋白酶解工艺研究[J]. 特产研究, 2012, 34(2): 12-16.
[8] 田京伟, 杨建. 白藜醇苷体外抗氧化活性[J]. 中草药, 2001, 32(10): 978-980.
[9] 朱字旌, 张勇, 王纯刚, 等. 红三叶黄酮抗氧化性研究[J]. 食品科技, 2006(4): 78-81.
[10] 莫开菊, 柳圣, 程超. 生姜黄酮的抗氧化活性研究[J]. 食品科学, 2006, 27(9): 110-115.
[11] 卢连华, 周景洋, 颜燕, 等. 海参肽对小鼠免疫调节及抗疲劳能力的影响[J]. 山东医药, 2009, 49(25): 35-37.
[12] 牛嗣云, 庞晓静, 陈龙, 等. 松花粉对亚急性衰老模型大鼠抗衰老作用的实验研究[J]. 中国老年学杂志, 2007, 25(12): 1506-1508.
[13] 张永娟, 吕学军, 张大勇. 泥蚶总蛋白抗疲劳作用研究[J]. 食品研究与开发, 2010, 31(8): 183-185.
[14] 彭维兵, 何秋霞, 刘可春, 等. 花生肽对小鼠抗运动性疲劳的实验研究[J]. 山东科学, 2011, 24(5): 35-38.
[15] 杨帆, 王莹, 蔡东联, 等. 人参蚂蚁药酒对小鼠的抗疲劳作用[J]. 氨基酸和生物资源, 2011, 38(1): 1-3.
[16] 李永进, 杨睿悦, 扈学俸, 等. 火麻仁蛋白对小鼠抗疲劳和免疫调节功能的初步研究[J]. 卫生研究, 2008, 37(2): 175-178.
[l7] WILLCOX J K, ASH S L, CATIGNANI G L. Antioxidants and prevention of chronic disease[J]. Crit Rev Food Sci Nutr, 2004, 44(4): 275-295.
[18] 武瑞, 刘文, 王爽, 等. 中西复方乳剂对子宫内膜炎奶牛血清NO、SA、MDA 含量及SOD、NOS活性影响[J]. 中兽医医药杂志, 2008, 27(2): 7-9.
[19] 王亚东, 王海玉, 李立, 等. 五加皮酒抗疲劳作用的实验研究[J]. 中国卫生检验杂志, 2009, 19(6): 1404-1405.
[20] 田振军, 石磊, 刘小杰, 等. 过度训练对大鼠血清CK、LDH、SOD、SDH活性及UMb含量影响的研究[J]. 中国运动医学杂志, 2000, 19(1): 49-50.
[21] 伊佳, 嵇扬, 刘俊, 等. 枳椇子水提物抗疲劳作用及机制的实验研究[J]. 中药材, 2009, 32(6): 962-965.
[22] ZHANG Xiaorui, ZHOU Wenxia, ZHANG Yongxiang, et al. Macrophages, rather than T and B cells are principal immunostimulatory target cells of Lycium barbarum L. polysaccharide LBPF4-OL[J]. Journal of Ethnopharmacology, 2011, 136(3): 465-472.
[23] 陈栋梁, 刘莉, 于兰, 等. 白蛋白多肽对核苷的促吸收及增强小鼠细胞免疫功能的作用[J]. 食品科学, 2004, 25(1): 163-166.
[24] 帅学宏, 胡庭俊, 陈炅然, 等. 鬼臼多糖对小鼠免疫功能和抗氧化能力的影响[J]. 畜牧兽医学报, 2008, 39(7): 1000-1004.

