强化高温风干工艺对中式培根脂质分解氧化的影响
王 艳,刘昌华,章建浩*,靳国锋
(国家肉品质量安全控制工程技术研究中心,教育部肉品加工与质量控制重点实验室,农业部农畜产品加工与质量控制重点开放实验室,南京农业大学食品科技学院,江苏 南京 210095)
传统腊肉和西式培根随工艺时间的延长和后期高温成熟形成其特殊浓郁风味,深受消费者的喜爱。脂肪分解氧化是培根和腊肉工艺过程中极易发生的重要生化反应过程,对感官风味和品质质量产生重要影响,受工艺过程中温度、湿度条件和产品中盐分、水分、pH值等的影响,其中温度因子尤其重要。风干成熟工艺使肌肉中脂质在脂肪酶作用下分解,游离脂肪酸(FFA)大量增加,为培根风味形成提供了物质基础;后随温度升高游离脂肪酸分解速率大于生成速率,脂质氧化生成醛、酮等小分子化合物,积累风味化合物,但是脂质过度氧化又会对风味有不良影响,使产品产生酸败味。由于肉制品中脂质分解氧化对产品品质质量影响的两面性,国际与国内近几年对工艺过程脂质分解氧化机理进行了系统深入的研究。国外有学者[1]通过测定脂肪组成、游离脂肪酸、脂质氧化指标、特征风味物质变化研究了干腌火腿加工工艺过程中皮下脂肪分解氧化的影响,发现风干前期脂质就开始发生强烈的脂肪水解,亚油酸含量不断降低,脂质分解能够促进脂肪氧化。Yang Hongju等[2]研究了宣威火腿加工过程中甘油酯、磷脂和脂肪酸中游离脂肪酸的变化规律。Toldra[3]研究了不同水分活度条件下脂肪水解酶活力的变化情况,发现不断增加的酶活力与风味物质发展相一致。Muriel等[4]描述了利比亚干腌猪五花肉脂质分解产物游离脂肪酸与脂质氧化指标硫代巴比妥酸值、己醛和腐败味的相关性。Zhang Jianhao等[5-6]在研究金华火腿传统工艺过程中脂质分解氧化与风味形成变化规律基础上,通过研制风干发酵成熟现代工艺装备,对金华火腿采用强化高温成熟加快脂质分解氧化与风味形成,缩短工艺时间并降低氧化指标进行了有效探索。Jin Guofeng等[7]通过探究干腌培根温度这一工艺参数,从调控脂肪氧合酶活性的角度研究加速脂质分解氧化,促进风味形成,同时降低氧化指标的措施。
不同于以往研究采用长时间提高风干成熟温度的强化高温工艺,本实验在风干成熟前期就进行短时强化高温风干(65℃、0.5h),通过激活与脂质分解氧化相关的酶活力,使酶活性维持在一个较高的水平,加速脂质分解氧化,促进风味物质形成,同时降低脂质氧化指标,以达到提高其品质风味的目的。通过比较中式培根强化高温组和对照组加工工艺过程中脂肪水解酶活力、游离脂肪酸变化和脂肪氧合酶活力、硫代巴比妥酸值、过氧化值情况,以及它们之间的相关性,旨在探索其风干成熟过程中脂肪分解氧化规律,为中式培根现代新工艺应用推广提供一定的参考。
1 材料与方法
1.1 材料
猪五花肉购于南京卫岗苏果超市。
1.2 仪器与设备
PHS-3CW型pH复合电极 上海理达仪器厂;SPX-250型恒温恒湿箱 上海博迅实业有限公司医疗设备厂;RE-52AA型旋转蒸发仪 上海亚荣生化仪器有限公司;DC-12H型氮吹仪 上海安谱科学仪器有限公司;TRACE GC Ultra气相色谱仪(配AS3000自动进样器和Xcalibur色谱工作站) 美国Thermo Fisher公司;IKAT18basic型高速分散机 德国IKA公司;Allegra 64R型高速冷冻离心机 美国Beckman Coulter公司;722型可见光光度计 上海精密科学仪器有限公司;Spectra Max M2e酶标仪 美国Molecular Devices公司;UV-2450型紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 培根制作
新鲜猪五花肉→整形→腌制→强化高温风干→风干成熟→成品
将猪五花肉分割成均匀的18块,每块平均质量约500g。按用盐量占肉的质量分数为1.8%的量干腌肉块,将盐均匀涂抹于肉块表面,然后将其放于4℃的冰箱里腌制3d。腌制结束,移入恒湿恒温箱风干成熟,先在温度65℃、相对湿度74%的条件下高温风干0.5h,然后在起始温度18℃、相对湿度72%的控温控湿条件下(期间每天升温1.5℃,湿度下降0.5%)风干成熟8d后即得成品。其中强化高温组为经65℃强化高温0.5h制作的中式培根的实验组;对照组为未进行风干前期强化高温处理,同实验组其他工艺制作条件完全相同的中式培根组。
1.3.2 取样和抽样工艺点
抽样工艺点:在原料、腌制结束、强化高温结束、风干3d、风干6d、风干8d共6大工艺点抽样,如表1所示。取各处理组工艺点样品,剔除筋腱、脂肪,留肌肉层作为材料,真空包装,―20℃条件下贮存备用。

表1 中式培根腌制高温风干强化成熟工艺参数Table 1 Parameters for intensified high-temperature drying-ripening of Chinese bacon
1.3.3 指标测定
1.3.3.1 总脂质提取
参照Folch等[8]的方法, 45℃条件下用真空旋转蒸发仪提纯得到油脂纯品。
1.3.3.2 脂质分离
根据García Regueiro等[9]方法进行。
1.3.3.3 脂肪酶提取及活力测定
酶液提取利用Henándz等[10]的方法;利用考马斯亮蓝法测定蛋白质含量,分析酶活力。中性脂肪酶活力测定参照Vestergaard等[11]方法。酸性脂肪酶活力测定同样参照Vestergaard等[11]的方法。磷脂酶活力测定利用Motilva等[12]的方法。
以上所有测定均重复3次,酶活力采用标准曲线法进行,分别用以上3种酶测定所用缓冲液配制系列浓度的4-甲基形酮溶液作标准曲线。酶活力单位(U)定义为:1g酶蛋白在1h内产生1nmol的4-甲基形酮为1个酶活力单位。
1.3.3.4 脂肪氧合酶提取及活力的测定
脂肪氧合酶的提取、亚油酸底物制备及酶活力测定参照Gata等[13]的方法。
1.3.3.5 脂质氧化指标测定
TBARs值测定按照Salih等[14]的方法。POV测定按GB/T 5009.37—2003《食用植物油卫生标准的分析方法》。
1.3.3.6 游离脂肪酸测定及气相色谱(GC)分析
游离脂肪酸甲酯化:向脂质提取分离后的游离脂肪酸中加入2mL质量分数10%三氟化硼-甲醇,加少量2,2-二甲氧基丙烷作为除水剂(吸收甲酯化产生的微量水),60℃水浴30min,使FFA甲酯化。冷却,加1mL蒸馏水和1mL正庚烷振荡,静置分层后完全吸取上层有机层,加入十七酸甲酯作为内标,用氮吹仪挥干溶剂,用正庚烷定容,以备色谱测定。
气相色谱(G C)分析:各种游离脂肪酸甲酯采用气相色谱仪分析,色谱柱:D B-2 3 F A M E 柱子(60m×0.25mm,0.25μm);升温程序:初温90℃,保持2min,以10℃/min升到180℃,保持5min,再以5℃/min升到240℃,保持12min;载气(高纯氮)流速为1mL/s;进样量:1μL,分流比1:70;进样口温度240℃;火焰离子监测器(FID)检测温度240℃。
标准曲线的制作:参考章建浩等[6]方法,稍作修改。以十七酸甲酯作内标物进行GC分析测定,以各标样脂肪酸甲酯与内标峰面积的比值为纵坐标,标样梯度为横坐标,建立游离脂肪酸标准曲线方程。将GC测定样品的脂肪酸甲酯峰面积与内标十七酸甲酯峰面积比值代入标准曲线方程,即可计算各种FFA的浓度。
1.4 统计与分析
数据用Microsoft Excel进行整理,用SAS 8.2统计软件进行方差分析(ANOVA),不同平均值之间利用Fisher’s最小显著差异法(LSD)进行差异显著性检验,P<0.05为差异显著。
2 结果与分析
2.1 加工过程中脂肪酶活力的变化

图 1 中式培根加工过程中中性酯酶(A)、酸性酯酶(B)和磷脂酶活力(C)的变化Fig.1 Changes in neutral lipase (A), acid lipase (B) and phospholipase (C) activities during processing
中性脂肪酶是中式培根加工过程中主要的脂肪分解酶,由图1可知,其酶活力始终高于酸性酯酶和磷脂酶的活力。不论强化高温组还是对照组3种脂肪水解酶活力在整个加工过程中基本都呈持续下降趋势,但相对于对照组,强化高温组脂肪酶活力在强化高温结束均发生显著增强(P<0.05),中性酯酶、酸性酯酶和磷脂酶活力分别增加了30.65%、63.64%和87.10%。在之后风干阶段酶活力始终高于对照组,说明强化高温处理可以激活脂肪水解酶活力,使酶活力保持较高的水平。这可能是因为65℃强化高温处理,实际上肉块内部温度只达到45℃左右,接近脂肪酶的最适温度,导致更多的底物与酶发生反应,使脂肪酶表现较高的催化活性,在加工前期脂质就发生较大程度地分解。
到成熟结束,中性脂酶、酸性脂酶、磷脂酶的活力分别下降了69.5%、75.4%和69.2%,除酸性酯酶外,其他2种酶活都高于对照组。此结论与Zhou等[15]的研究结果类似,加工过程中金华火腿肌肉中3种酶活力都显著下降,且中性脂酶活力也是保持最高水平。但与本研究结论不同,Jin Guofeng等[16]研究发现干腌培根在加工过程中酸性脂酶的活力始终高于其他2种酶活力,这可能与原料、加工工艺的不同有关。
2.2 加工过程中式培根肌肉中游离脂肪酸的变化

表2 中式培根强化高温工艺过程肌肉中游离脂肪酸含量的变化 Table 2 Changes in muscle free fatty acid contents of Chinese bacon during processing mg/g
由表2可知,饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)含量在风干过程中有显著变化(P<0.05)。SFA在风干6d后达到最大值,而MUFA在风干3d就达到最大值,之后呈显著降低(P<0.05)的变化趋势,但到成品时仍然高于原料中的含量。SFA上升趋势显著(P<0.05),增加最多,风干8d时与原料相比增加了5.52mg/g脂质,其中棕榈酸(C16:0)和硬脂酸(C18:0)变化最大;MUFA稍有增加,差异不显著;PUFA呈先增加后减少的变化趋势,在强化高温结束时就达到最大7.17mg/g脂质,然后显著降低,到成熟结束时含量不到强化高温时的一半,其中亚油酸(C18:2)减少最多。
游离脂肪酸的变化是一个动态平衡的过程,一方面脂肪分解生成FFA,另一方面FFA氧化分解。与傅樱花[17]研究的腊肉加工过程中主要FFA种类一致,中式培根中棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)是FFA的主体成分,始终占FFA含量的大部分,在原料中占78.49%,到风干成熟结束时占81.62%。由图2可知,4种脂肪酸含量在工艺过程中均呈现先升高后降低的趋势。原料中4种FFA含量有明显差异,与对照组相比,经强化高温处理FFA含量有显著增加(P<0.05)。不饱和程度越高,FFA越快达到最大值。饱和脂肪酸棕榈酸和硬脂酸在风干成熟6d后达到最大值;油酸含量在风干3d结束时达到最大值,亚油酸含量在强化高温结束时就处于最高水平,比对照组增幅达41.73%,差异极显著(P<0.01)。同时不饱和程度越高,FFA含量下降的幅度越大,到加工后期随加工温度的升高,饱和脂肪酸棕榈酸和硬脂酸含量略有下降,但到加工结束时强化高温组和对照组成品的FFA趋于一致;不饱和脂肪酸油酸、亚油酸比饱和脂肪酸更易氧化,从风干中期开始就急速减少,到成熟结束时成品中含量比对照组降低了32.84%(P<0.05)。

图 2 中式培根加工过程中主要游离脂肪酸含量的变化Fig.2 Changes in major FFA in Chinese bacon during processing
2.3 加工过程中脂肪氧化的变化
由图3可知,强化高温风干成熟工艺对加工过程中POV和TBARs值都有较显著影响(P<0.05)。无论是强化高温组还是对照组,脂质氧化指标在整个工艺过程中的变化趋势是一致的,都是先升高后降低的趋势。在低温腌制阶段POV显著增大,在强化高温组风干成熟加工工艺中最高值出现在强化高温阶段,而对照组风干成熟工艺中最高值出现在之后的风干成熟3d结束时,最高POV分别为0.131、0.123g/100g脂肪,说明在风干初期已经发生脂质氧化,强化高温可以加速脂质氧化速率。之后POV显著下降(P<0.05),且风干阶段强化高温组始终低于对照组,风干结束后强化高温组最终产品POV为0.022g/100g,比对照组降幅达45.00%,表明强化高温风干工艺可以有效降低产品POV。

图 3 TBARs值(A)和POV(B)在中式培根加工过程中的变化趋势Fig.3 Changes in TBARs (A) and POV (B) in Chinese bacon during processing
与POV的变化趋势相似,TBARs值也呈现先上升后降低的过程。这与傅樱花[17]研究的中国传统腊肉加工过程中TBARs的变化趋势相一致。强化高温组TBARs最大值比对照组提前出现,表明强化高温处理加快了脂质氧化速率,挥发性风味化合物快速积累。进入风干阶段TBARs又都显著下降(P<0.05),风干阶段强化高温组始终低于对照组。强化高温风干成熟工艺中式培根最终产品的TBARs值为0.17mg/kg肌肉,降幅达26.10%,低于张杨萍等[18]研究的干腌培根。
2.4 加工过程中脂肪氧合酶(LOX)活力的变化
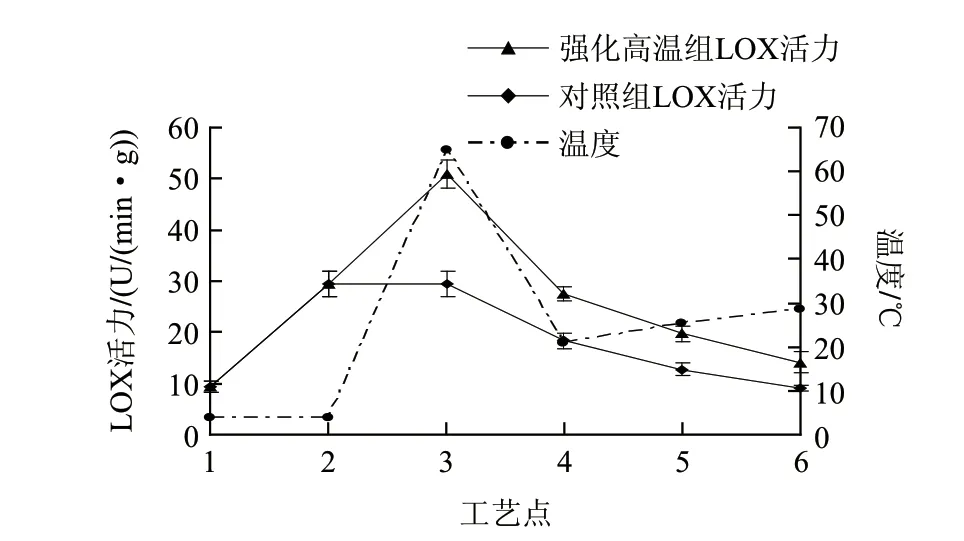
图 4 风干成熟工艺过程中式培根肌肉脂肪氧合酶活力的变化Fig.4 Changes in muscle lipoxygenase activity of Chinese bacon during processing
由图4可知,LOX活力在腌制阶段显著上升(P<0.05),腌制结束后随着风干成熟过程的进行,对照组LOX活力逐渐下降,到风干成熟8d结束,LOX活力达到最低为(9.00±0.59)U/(min·g),略高于原料中酶活力。在腌制阶段LOX活力显著增加可能是由于LOX是一种非血红素铁蛋白,盐后的POV和TBARs都显著提高,此时铁离子发生转变,酶被激活;之后随着生产过程的进行,酶活力又不断下降是由于细胞组织中的蛋白酶释放和盐的浓缩效应使LOX受到了破坏。与对照组相比,实验组经过强化高温后,LOX活力显著升高达(51.02±0.72)U/(min·g),是原料阶段酶活力的5倍以上,与对照组相比LOX活力增幅为73.42%(P<0.05),并且之后的风干成熟阶段活力均高于对照组。说明温度是影响LOX活力的重要因子,65℃的强化高温可以激活酶的活力,使催化活力效能最优化,导致温度对LOX活力的促进作用大于盐分对其的抑制作用,有利于LOX催化脂质氧化。
2.5 强化高温风干成熟工艺过程中式培根各指标的相关性

表3 中式培根强化高温工艺过程中肌肉各指标之间的Pearson相关系数Table 3 Pearson’s correlation coefficients among vairous muscle parameters of Chinese bacon subjected to intensifed high-temperature drying-ripening
由表3可知,酸性脂肪酶活力与∑PUFA的相关性要大于中性脂肪酶和磷脂酶与∑PUFA的相关性,表明酸性脂肪酶是催化脂肪分解为FFA,特别是PUFA的重要脂肪酶。这可能与中式培根加工过程中肌肉的pH值始终保持酸性脂肪酶作用的最适酸性范围有关(pH5.4~6.4)。脂质氧化指标TBARs值、POV和脂肪氧合酶活力之间呈极显著(P<0.01)正相关。亚油酸含量与∑PUFA呈极显著(P<0.01)正相关,说明亚油酸是中式培根中最主要的多不饱和脂肪酸。以亚油酸为代表的多不饱和脂肪酸含量与脂质氧化指标TBARs值、POV和脂肪氧合酶活力之间呈极显著(P<0.01)正相关,一方面说明亚油酸容易被氧化,脂质氧化程度与其含量有重要关系,亚油酸含量越高,脂质氧化程度越强;另一方面说明培根肌肉中LOX主要以亚油酸为底物;再者表明脂质分解与脂质氧化之间有一定的相关性,脂质分解可以促进脂质氧化。
3 讨论与结论
强化高温风干成熟工艺即通过在风干前期短时高温强化中式培根,可以激活脂肪水解酶和脂肪氧合酶的活力来达到调控脂质分解氧化的目的。据相关报道[19-20],对干腌肉制品进行强化高温处理,不仅可以显著提高FFA含量,有利于小分子风味物质积累,而且能够缩短工艺时间,降低氧化指标。本研究强化65℃、0.5h高温条件与报道的长时间梯度升温不一样,但得到的结果基本一致。经强化高温处理3种脂肪水解酶活力均提高,且在后续风干阶段也保持较高水平,催化脂质快速分解,使产物FFA增加量维持在较高水平,脂质氧化反应底物有较快增加。FFA不饱和程度越高,其含量增加的速度越快。以亚油酸为代表的多不饱和脂肪酸含量显著增加(P<0.05),在强化高温结束时就达到最大值。由相关性分析,表明脂质分解可以促进脂质氧化。Coutron-Gambotti等[1]研究也发现干腌火腿皮下脂肪强烈的脂肪水解能促进脂肪氧化。这是由于FFA是脂质分解和氧化的枢纽性化合物;随加工时间延长,温度逐渐升高,脂质氧化加快,使脂质氧化的速率大于分解速率,FFA分解速率大于生成速率。∑SFA、∑MUFA和∑PUFA含量风干阶段后期都发生不同程度的减小,FFA不饱和程度越高,下降的幅度越大,越容易被氧化,特别是MUFA的油酸和PUFA的亚油酸下降显著(P<0.05)。在脂质氧化方面,由于强化高温处理使肉块内部温度快速达到45℃左右,接近LOX最适温度,激活了LOX活力,与对照组相比,增幅达73.4%,从而有利于催化FFA进一步氧化,加快脂质一级氧化产物——氢过氧化物的形成,使POV最大值达到的时间提前。一方面由于中式培根中脂质一级氧化所需的活化能(Ea)大于二级氧化所需的Ea,强化高温加速脂质一级氧化的同时,更容易加快脂质二级氧化的发生,也使TBARs最大值达到的时间也提前[21];另一方面风干前期强化高温处理可促进脂肪氧合酶活力,加速风味前提物质氢过氧化物的形成,而到工艺后期盐含量快速升高酶活性被抑制,但不断升高的温度又会加快氢过氧化物分解,这样不但降低了最终产品的脂质氧化指标POV和TBARs值,保证产品更安全可靠;而且使得有更多时间用于醛、醇、酮、羧酸等风味化合物的积累,提高产品的风味品质。
采用强化高温现代工艺能够显著激活脂肪水解酶和脂肪氧合酶活力,使其催化活性在相当长的时间内处于高水平,加速中式培根肌肉脂质分解FFA生成,特别是不饱和脂肪酸增加量显著提高,促进脂质进一步氧化使其留有更多的时间用于小分子风味化合物的生成,有利于风味积累和感官品质改善,同时有效降低最终产品的POV和TBARs值,提高产品的安全性。因此,强化高温风干成熟新工艺调控脂质分解氧化速率,改善腌腊肉制品风味品质是可行的。
[1] COUTRON-GAMBOTTI C, GANDERMER G. Lipolysis and oxidation in subcutaneous adipose tissue during dry-cured ham processing[J]. Food Chemistry, 1999, 64: 95-101.
[2] YANG Hongju, MA Changwei, QIAO Fadong, et al. Lipolysis in intramuscular lipids during processing of traditional Xuanwei ham[J]. Meat Science, 2005, 71: 670-675.
[3] TOLDRA F. The role of muscle enzymes in dry-cured meat products with different drying conditions[J]. Trends in Food Science & Technology, 2006, 17: 164-168.
[4] MURIEL E, ANDRES A I, PETRON M J, et al. Lipolytic and oxidative changes in Iberian dry-cured loin[J]. Meat Science, 2007, 75: 315-323.
[5] ZHANG Jianhao, JIN Guofeng, WANG Jiawei, et al. Effect of intensifying high-temperature ripening on lipolysis and lipid oxidation of Jinhua ham[J]. LWT Food Science and Technology, 2010, 44: 473-479.
[6] 章建浩, 曾弢, 朱健辉, 等. 金华火腿传统加工过程中脂质分解氧化及其相关性研究[J]. 南京农业大学学报, 2005, 28(4): 117-121.
[7] JIN Guofeng, ZHANG Jianhao, YU Xiang et al. Crude lipoxygenase from pig muscle: partial characterization and interactions of temperature, NaCl and pH on its activity[J]. Meat Science, 2011, 87(3): 257-263.
[8] FOLCH J, LEES M, STANLEY G H S. A sample method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[9] GACTCÍA REGUEIRO J A, GIBERT J, DÍAZ I. Determination of neutral lipids from subcutaneous fat of cured ham by capillary gas chromatography and lipid chromatography[J]. Journal of Chromatography A, 1994, 667: 225-233.
[10] HERNÁNDEZ P, NAVARRO J L, TOLDRA F. Lipid composition and lipolytic enzyme activities in porcine skeletal muscles with different oxidative pattern[J]. Meat Science, 1998, 49(1): 1-10.
[11] VESTERGAARD C S, SCHIVA ZAPPA C, VIRGILI R. Lipolysis in dry-cured ham maturation[J]. Meat Science, 2000, 55(1): 1-5.
[12] MOTILVA M J, TOLDRA F, FLORES J. Assay of lipase and esterase activities in fresh pork meat and dry-cured ham[J]. Zeitschrift für Lebensmittel Untersuchung und-Forschung, 1992, 195(5): 446-450.
[13] GATA J L, PINTO M C, MACIAS P. Lipoxygenase activity in pig muscle: purification and partial characterization[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2573-2577.
[14] SALIH A M, SMITH D M, PRICE J F, et al. Modified extraction 2-thiobarbituric acid method for measuring lipid oxidation in poultry[J]. Poultry Science, 1987, 66(9): 1483-1488.
[15] ZHOU G H, ZHAO G M. Biochemical changes during processing of traditional Jinhua ham[J]. Meat Science, 2007, 77: 114-120.
[16] JIN Guofeng, ZHANG Jianhao, YU Xiang, et al. Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J]. Food Chemistry, 2010, 123(2): 465-471.
[17] 傅樱花. 腊肉加工过程中游离脂肪酸的变化研究[J]. 食品科技, 2006(3): 56-59.
[18] 张杨萍, 章建浩, 靳国锋, 等. 中式培根制作工艺及其对理化品质指标和蛋白质水解的影响[J]. 食品科学, 2011, 32(4): 15-20.
[19] 章建浩, 靳国锋, 王永丽, 等. 强化高温成熟缩短工艺时间对干腌火腿蛋白质水解的影响[J]. 农业工程学报, 2009, 25(1): 97-101.
[20] 王永丽, 章建浩, 靳国锋, 等. 风干成熟工艺对风鸭脂质分解氧化影响的研究[J]. 食品科学, 2009, 30(14): 81-86.
[21] JIN Guofeng, HE Lichao, HUANG Feng, et al. Effects of temperature and NaCl percentage on lipid oxidation in pork muscle and exploration of the controlling method using response surface methodology[J]. Food Chemistry, 2012, 131(3): 817-825.

