金黄色葡萄球菌噬菌体不敏感菌株的分离以及噬菌体JS01吸附位点的研究
贾静静,史 锋,*,王利平,王小元
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
金黄色葡萄球菌(Staphylococcus aureus)是一种革兰氏阳性致病菌,也是一种主要的食源性致病菌,在临床上能够引发心内膜炎、骨髓炎、肺炎等疾病[1];在食品加工过程中,易传播,导致食物中毒[2]。据美国疾控中心报道,由金黄色葡萄球菌引起的食物中毒位居第2位,占整个细菌性食物中毒病例的33%,加拿大则高达45%。中国每年发生的此类中毒事件也非常多[3]。2008年4月3日,维维大亨高钙奶粉因污染金黄色葡萄球菌而导致百名儿童中毒[4]。控制金黄色葡萄球菌的方法有物理法、化学法[5],然而这些方法都不尽理想,而且金黄色葡萄球菌对抗生素的耐药性越来越强[6]。因此,近年来利用特异性噬菌体控制金黄色葡萄球菌越来越受到研究者的关注。
当噬菌体侵入金黄色葡萄球菌时,为了吸附到细胞上,会选择细胞表面的一种成分作为其吸附的受体[7],如磷壁酸、糖蛋白或者肽聚糖[8]。一种噬菌体的宿主范围取决于它与宿主细胞表面受体之间的特异性吸附能力的大小。而吸附位点的特异性和吸附能力大小也影响着噬菌体对其宿主菌污染或感染的抑制效果。因此确定一种噬菌体与宿主菌相互作用时的吸附位点显得尤为重要。对于大肠杆菌等革兰氏阴性菌的噬菌体来说,其吸附的受体已被详细地报道[9]。例如:T系列噬菌体对大肠杆菌B菌株的吸附位点为细胞外膜蛋白OmpA[10];λ系列噬菌体对大肠杆菌K12的吸附位点为细胞表面LamB蛋白等[11]。然而有关革兰氏阳性菌噬菌体的吸附位点的报道则比较少。1969年,Chatterjee[12]研究发现当金黄色葡萄球菌的磷壁酸结构中缺乏N-乙酰葡萄糖胺(GlcNAc)时,会对噬菌体产生抗性。Hill[13]的研究表明编码乳酸菌细胞表面上噬菌体受体的基因发生了点突变,使受体结构发生变化,会对噬菌体产生抗性。直到2010年,Rosanna等[1]才确定了噬菌体M吸附金黄色葡萄球菌A170的位点为GlcNAc。受噬菌体侵染后出现的这种对噬菌体具有抗性的菌株被称为噬菌体不敏感突变株(bacteriophage-insensitive mutant,BIM)。BIM菌株的出现一方面降低了噬菌体对宿主菌的裂解能力,会对病原菌的控制效果产生不利影响;另一方面可以大幅降低突变菌株的毒力,并保留其免疫原性,因此有望被开发成减毒疫苗而具有有利的应用前景。
本实验室从环境中筛选到的噬菌体JS01裂解金黄色葡萄球菌ATCC25923时,产生并分离到了BIM菌株ATCC25923R,并对两种菌株的菌落形态、生长状况以及受噬菌体JS01的裂解情况进行了对比,研究了ATCC25923和ATCC25923R的磷壁酸结构的差异,确定了噬菌体JS01的吸附位点。这对于了解JS01与其宿主菌的相互作用并提高其抗菌性能具有积极的意义。
1 材料与方法
1.1 材料与试剂
宿主菌金黄色葡萄球菌ATCC25923 中国普通微生物菌种保藏管理中心(CGMCC);金黄色葡萄球菌噬菌体不敏感菌株ATCC25923R以及噬菌体JS01由本实验室分离;TSB培养基(大豆肉汤培养基) 美国BD公司;蛋白胨、酵母膏 英国Oxoid公司;N-乙酰葡萄糖胺 美国BBI公司;辛基-琼脂糖凝胶4FF 美国GE Pharmacia公司。
1.2 仪器与设备
THZ-300C型恒温培养摇床 上海一恒科技有限公司;Operation Manual Rotavapor®RII旋转蒸发仪 瑞士Büchi公司;Trace MS气相色谱-质谱联用仪 美国菲尼根公司;Turbo Matrix TD热脱附进样器 美国PE公司;DC-12氮吹仪 上海安谱科学仪器有限公司。
1.3 方法
1.3.1 金黄色葡萄球菌的培养以及噬菌体的增殖
挑取单菌落接种至LB液体培养基中,37℃振荡培养过夜,以1:100的比例转接至新鲜LB培养基中,37℃继续培养。至OD600nm值为1.0后按一定的比例加入噬菌体,37℃振荡培养至培养液澄清,离心,取上清液,用0.22μm水相微孔滤膜过滤后,保存在4℃冰箱中,以备使用。
1.3.2 噬菌体不敏感菌株的分离
金黄色葡萄球菌ATCC25923摇床培养至OD600nm值为1.0后,以MOI (即噬菌体数/初始细菌数)为0.1的比例加入噬菌体,6h后取出100μL培养液,10倍梯度稀释,取100μL涂布,37℃条件下培养24h,单菌落划线纯化3~5代后,得到的菌落即为噬菌体不敏感菌株,记作ATCC25923R,保存。观察得到的BIM菌株的菌落形态,测定其生长状况,以及噬菌体对其裂解状况。
1.3.3 金黄色葡萄球菌ATCC25923和ATCC25923R磷壁酸的提取与结构分析
磷壁酸的提取参照Andreas等[14]提到的方法。得到的磷壁酸粉末1mg加入3mL 2mol/L三氟乙酸(TFA)溶解,封口,120℃烘箱中水解反应2h,取出,减压蒸干,加甲醇蒸干3次,重复操作以完全除尽TFA。水解后残余物加入100mg NaBH4和2mL水,室温条件下放置过夜进行还原反应。加入冰醋酸以除去过量的NaBH4,再于旋转蒸发仪上浓缩样品至黏稠状态,加入3~5mL甲醇-冰醋酸(5:1,V/V),蒸干3次,继续用甲醇蒸干2次,得到白色粉末,放入105℃烘箱加热15min以除去水分。然后加入3mL乙酸酐,于101℃烘箱中乙酰化反应1h,取出,多次加甲苯于50℃水浴减压共沸蒸干至粉末状。最后加适量水溶解粉末状样品,用氯仿萃取3次,合并氯仿层,水洗3次,分出氯仿层浓缩后进行气相色谱-质谱分析。气相色谱-质谱分析时,色谱柱为PB-5毛细管柱;程序升温:150℃保持1min,以10℃/min升至280℃,保持6min;载气(H2)流速0.8mL/min,进样量10μL;质量扫描范围m/z 35~400。
1.3.4 不同化合物对噬菌体裂解的影响
过夜培养金黄色葡萄球菌ATCC25923,以1:100的接种量转接至20mL含有不同化合物的TSB培养基中,37℃继续培养至OD600nm值为1.0,按MOI为0.1的比例加入噬菌体JS01,1h后测定培养液的OD600nm值。所测试的化合物包括0、5、10、20mmol/L的葡萄糖、GlcNAc,0μg/L和8μg/L的金黄色葡萄球菌ATCC25923、ATCC25923R磷壁酸(提取见1.3.3节)。
2 结果与分析
2.1 噬菌体不敏感菌株的分离
噬菌体JS01裂解金黄色葡萄球菌ATCC25923的过程中,在裂解的初期,培养液中的活菌数会急速下降,随着裂解时间的延长,菌体浓度上升(图1A),产生了噬菌体不敏感菌株(BIM)。于是从裂解后期的裂解液中分离出1株BIM菌株ATCC25923R(图1C)。

图 1 金黄色葡萄球菌ATCC25923噬菌体不敏感菌株的分离 Fig.1 Isolation of bacteriophage-insensitive mutant strain of S. aureus ATCC25923
2.2 金黄色葡萄球菌ATCC25923和ATCC25923R的生长性能与噬菌体裂解性能
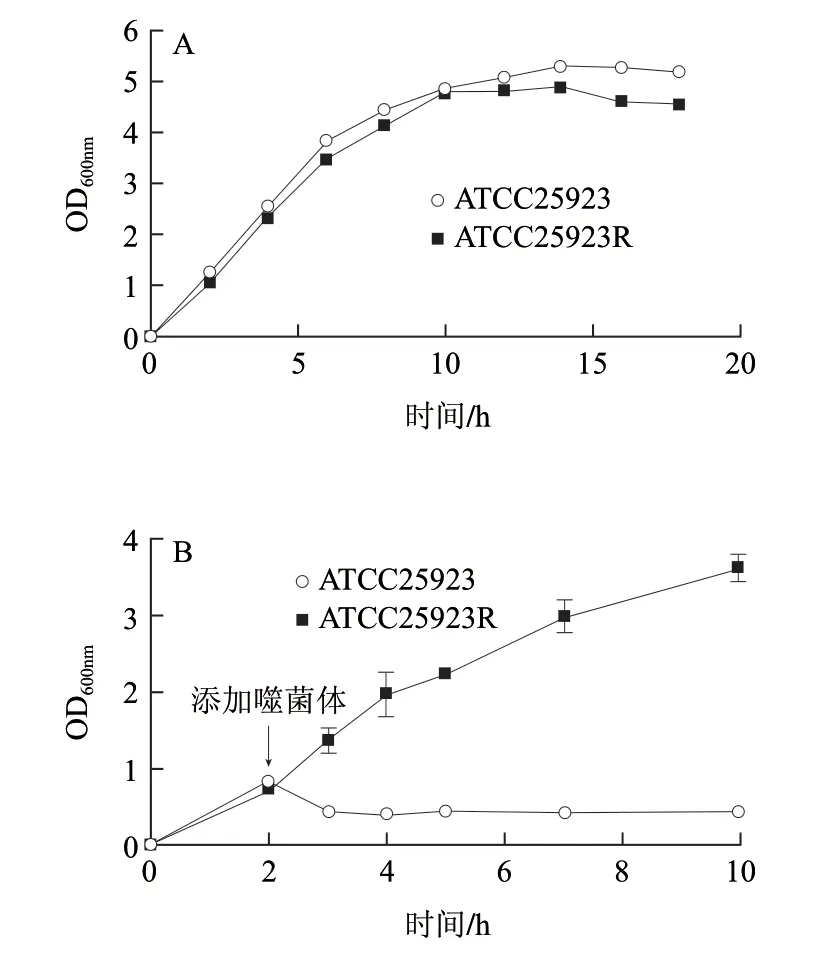

图 2 ATCC25923R与ATCC25923菌株性质对比Fig.2 Comparison between ATCC25923R and ATCC25923 strains
ATCC25923和ATCC25923R的生长曲线显示,两种菌株的生长基本一致,都是在12h后达到稳定期(图2A)。而从菌落形态上观察,ATCC25923R(图1C)比ATCC25923的菌落(图1B)更大,边缘光滑湿润,颜色更深。噬菌体JS01对两者的裂解能力也不同,将噬菌体JS01加入ATCC25923R的过夜培养液以后,菌体浓度(OD600nm值)继续上升,ATCC25923R不能被噬菌体所裂解,而将JS01加入ATCC25923培养液后,OD600nm值会急速下降至0.278(图2B),菌液变澄清(图2C)。说明噬菌体不敏感突变株ATCC25923R与出发菌ATCC25923相比,菌株发生了变化,因此进一步分析金黄色葡萄球菌ATCC25923和ATCC25923R表面的磷壁酸结构。
2.3 金黄色葡萄球菌ATCC25923和ATCC25923R表面的磷壁酸结构差异

图 3 ATCC25923R与ATCC25923磷壁酸的GC-MS图谱Fig.3 GC-MS analysis of teichoic acid
从金黄色葡萄球菌ATCC25923和ATCC25923R中提取磷壁酸,用GC-MS分析了两菌株磷壁酸结构的差异。GC-MS图谱显示(图3),ATCC25923R与ATCC25923的磷壁酸结构中糖组分的主体衍生化物质为六酰基-D-葡萄糖醇,对应的出峰时间为13.88min,敏感菌ATCC25923中此成分的比例明显高于非敏感菌。而在ATCC25923R菌株的磷壁酸结构中,还多出一种物质五酰基-戊糖醇,其出峰时间为11.03min,说明两者的磷壁酸结构存在着差异。
2.4 噬菌体的吸附位点分析
金黄色葡萄球菌ATCC25923R的菌落形态以及对噬菌体的敏感性与ATCC25923相比,发生了很大的变化,说明当噬菌体吸附细菌时,细胞表面组成成分发生了变化,那么哪个成分可以作为噬菌体的受体?对此进行了深一步的研究。
在ATCC25923对数期培养液中加入噬菌体JS01后,经过1h,菌液变澄清,OD600nm值由1.0急速下降至0.278;而未加噬菌体的培养液OD600nm值则从1.0继续增加至1.780(图4),说明噬菌体对ATCC25923有很好的控制效果。当ATCC25923的培养液中含有20mmol/L GlcNAc时,加入噬菌体JS01作用1h后培养液的OD600nm值从1.0略降至0.695,明显高于不含GlcNAc的对照(OD600nm=0.278)。说明由于GlcNAc的存在,一部分ATCC25923逃避了噬菌体JS01的吸附和裂解,即一部分噬菌体与GlcNAc这一底物相结合,而没有与宿主菌表面受体相吸附,从而裂解金黄色葡萄球菌ATCC25923。随着GlcNAc浓度的降低,培养液的OD600nm值相对于没有加入GlcNAc的对照组的增加幅度不断减少。说明GlcNAc参与噬菌体的吸附,因此它是噬菌体JS01裂解ATCC25923时的吸附位点。

图 4 GlcNAc存在时噬菌体JS01对ATCC25923的裂解作用Fig.4 Lysis of ATCC25923 by phage JS01 in the presence of GlcNAc
在ATCC25923的培养液中添加20、10mmol/L或者5mmol/L葡萄糖时,JS01作用1h后培养液的OD600nm值分别降低0.276、0.256和0.284,与不含培养液的对照组(OD600nm=0.278)相接近(图5),即葡萄糖对噬菌体的裂解作用没有任何影响,说明葡萄糖在噬菌体与宿主菌相互吸附的过程中没有参与宿主菌的竞争,也没有加强噬菌体的裂解效果,因此葡萄糖不是噬菌体的吸附位点。

图 5 葡萄糖存在时噬菌体JS01对ATCC25923的裂解作用Fig.5 Lysis of ATCC25923 by phage JS01 in the presence of glucose
最后本实验又测试了提取的A T C C 2 5 9 2 3 和ATCC25923R的磷壁酸对噬菌体JS01裂解效果的影响。当培养基中添加8μg/L的ATCC25923或ATCC25923R的磷壁酸时,噬菌体作用1h后培养液的OD600nm值分别降低到0.276、0.302,与不含培养液的对照组(OD600nm=0.278)相接近(图6),而且不管是加入从ATCC25923菌株还是从ATCC25923R菌株提取出来的磷壁酸都没有差异,说明细菌磷壁酸结构的变化并没有影响噬菌体对它的吸附作用,突变菌株的磷壁酸结构中的主导成分没有发生变化,同时也说明整个磷壁酸结构不是噬菌体吸附ATCC25923的位点。

图 6 磷壁酸存在时噬菌体JS01对ATCC25923的裂解作用 Fig.6 Lysis of ATCC25923 by phage JS01 in the presence of teichoic acid from ATCC25923 and ATCC25923R
3 讨 论
金黄色葡萄球菌是一种食源性病源菌,利用特异性噬菌体控制金黄色葡萄球菌的污染和感染已成为食品安全领域和医学领域研究的趋势与重点。本实验中的噬菌体JS01能够快速有效地杀死金黄色葡萄球菌ATCC25923。然而,这种控制作用随着时间的延长而效果减弱,ATCC25923发生突变,产生了噬菌体不敏感菌株ATCC25923R。突变菌株的菌落相比于出发菌株形态更大,颜色更深,同时对噬菌体JS01产生了抗性。据文献报道,菌株对噬菌体产生抗性的原因有很多,例如:1)在噬菌体吸附时,金黄色葡萄球菌表面会形成一种蛋白质A,这种蛋白质与免疫球蛋白G结合,掩盖噬菌体的吸附位点,而阻碍噬菌体的吸附[15];2)噬菌体对荚膜包裹的金黄色葡萄球菌的裂解效果比对无荚膜的菌株明显减弱,荚膜作为一种阻碍物阻止噬菌体与宿主菌表面吸附位点的结合[16];3)一些二价阳离子如Ca2+、Mg2+能够影响细菌表面所携带的静电荷,从而影响噬菌体与细菌之间的碰撞而促进噬菌体的吸附[17]等。本研究对敏感菌株ATCC25923和不敏感菌株ATCC25923R磷壁酸结构的分析显示,不敏感菌株的磷壁酸结构发生了变化,这可能是导致两者对JS01敏感性差异的一个原因,这还有待于进一步的实验证实。
一般来说,细菌是在紫外照射或噬菌体裂解时间延长时发生突变,产生噬菌体不敏感菌株BIM。但这种突变呈现一定的不稳定性,有时突变细胞经过多次的纯化后,可以恢复对噬菌体的敏感性,因此不影响噬菌体作为一种医疗佐剂或者食品保护剂的抗菌效果[18]。鉴于噬菌体对人体的无毒性、安全性和可食性,使得它在治疗病原菌感染和控制食源病菌的污染方面具有积极的应用价值。而且最近的研究表明BIM菌株还有其他有益的用途。如在一个金黄色葡萄球菌BIM菌株A172中,13个与毒素有关的编码基因的转录与表达水平大幅度下降,致使菌株毒力降低。A172还能调节小鼠体内TNF-α、IFN-γ、IL-1β基因的转录。更为重要的是,A172能够有效地保护小鼠,免于受致死剂量的毒性菌株A170感染,因此提示出BIM菌株在免疫上的广阔应用前景[1]。
噬菌体吸附金黄色葡萄球菌时,其吸附位点可能是磷壁酸、肽聚糖或者糖蛋白。在本实验中,考察了当葡萄糖、GlcNAc、磷壁酸存在时,噬菌体JS01对金黄色葡萄球菌ATCC25923裂解效果的变化。结果发现,只有当培养基中含有GlcNAc时,噬菌体裂解ATCC25923的效率才会下降,而且随着GlcNAc浓度的提高,裂解效率下降程度增大;当培养基中含有葡萄糖时,裂解效率与对照组保持一致;在培养基中加入ATCC25923和ATCC25923R菌株的磷壁酸时,裂解效率不变,表明只有GlcNAc是噬菌体JS01的吸附位点。这些研究为揭示噬菌体JS01的裂解机制和受体位点及其应用奠定了基础。
[1] ROSANNA C, NUNZIA N. Bacteriophage-resistant Staphylococcus aureus mutant confers broad immunity against staphylococcal infection in mice[J]. PLos One, 2010, 5(7): e11720. doi:10.1371/journal.pone.0011720.
[2] 贾云. 食品安全与检验[M]. 北京: 中国石化出版社, 2009: 312-315.
[3] 凌巍, 于宏伟. 金黄色葡萄球菌(Staphylococcus aureus)的分布研究[J]. 中国食品学报, 2008, 8(2): 147-153.
[4] 魏志恒. 金黄色葡萄球菌及其溶血素基因分布研究[D]. 保定: 河北农业大学, 2009.
[5] GARCIA P, MARTINEZ B, OBESO J M. Bacteriophages and their application in food safety[J]. Lett Appl Microbiol, 2008, 47: 479-485.
[6] LOWY F D. Antimicrobial resistance: the example of Staphylococcus aureus[J]. J Clin Invest, 2003, 111(9): 1265-1274.
[7] 诸葛健, 李华忠. 微生物学[M]. 北京: 科学出版社, 2004.
[8] LINDBERG A A. Bacteriophages receptors[J]. Annu Microbiol Rev, 1973, 27: 205-236.
[9] LABRIE S J, SAMSON J E, MOINEAU S. Bacteriophage resistance mechanisms[J]. Nature Reviews Microbiology, 2010, 8(5): 317-327.
[10] DREXLER K, DANNULL J, MUTSCHLER B, et al. Single mutations in a gene for a tail fiber component of an Escherichia coli phage can cause an extension from a protein to a carbohydrate as a receptor[J]. J Mol Biol, 1991, 219(4): 655-663.
[11] CHARBIT A, WERTS C, MICHEL V, et al. A role for residue 151 of LamB in bacteriophage lambda adsorption: possible steric effect of amino substitutions[J]. J Bacterol, 1994, 176(11): 3204-3209.
[12] CHATTERJEE A N. Use of bacteriophage-resistant mutants to study the nature of the bacteriophage receptor site of Staphylococcus aureus[J]. J Bacteriol, 1969, 92(8): 519-527.
[13] HILL C. Bacteriophage and bacteriophage-resistance in lactic acid bacteria[J]. FEMS Microbiol Rev, 1993, 12: 87-108.
[14] ANDREAS P, MICHAEL O. Inactivation of the dlt operon in Staphylococcus aureus confers sensitivity to defensins, protegrins, and other antimicrobial peptides[J]. J Biol Chem, 1999, 274(13): 8405-8410.
[15] NORDSTROM K. Prevention of bacteriophage adsorption to Staphylococcus aureus by immunoglobulin G[J]. J Virol, 1974, 14(2): 203-206.
[16] WILKINSON B J, HOLMES K M. Staphylococcus aureus cell surface: capsule as a barrier to bacteriophage adsorption[J]. Infect Immun, 1979, 23(2): 549-552.
[17] 司稚东, 何晓青. 噬菌体学[M]. 北京: 科学出版社, 1996: 30.
[18] FLYNN G O. Evaluation of a cocktail of three bacteriophages for biocontrol of Escherichia coli O157:H7[J]. Appl Environ Microbiol, 2004, 70(6): 3417-3424.

