CD59在小鼠脑缺血再灌注损伤中的表达及意义
赵 军,晏沐阳,张传福,刘丽霞,宋宏彬
1解放军总医院 心血管病研究所,北京 100853;2军事医学科学院 疾病预防控制所,北京 100071;3解放军第261医院,北京 100094
CD59是补体系统中重要的补体调节蛋白,在补体激活终末阶段抑制攻膜复合物(membrane attack complex,MAC)的形成,保护细胞免遭补体激活造成的损伤[1]。但其在脑缺血-再灌注损伤中的表达和意义并不清楚。我们通过建立小鼠脑缺血再灌注动物模型,应用免疫荧光组织化学法和荧光定量PCR技术,检测脑组织中不同时间点补体调节蛋白CD59的表达变化情况,初步探讨其在脑缺血-再灌注免疫损伤中的可能意义。
材料和方法
1 材料 健康雄性昆明小鼠48只,体质量(23±3) g,由军事医学科学院实验动物中心提供。随机分为正常组、缺血再灌注6 h、24 h、48 h、72 h、96 h,每组8只。
2 脑缺血-再灌注动物模型建立 参考Longa等[2]的方法并做适当改变,制备小鼠脑缺血再灌注动物模型。用1%戊巴比妥钠按照50 mg/kg腹腔注射麻醉。在小鼠颈部做正中切口,长度约为1 cm,逐步分离小鼠右侧颈总动脉、颈外动脉并结扎。在颈总动脉结扎部位远心端剪口,将直径约为0.125 cm的鱼线插入,进线长度为1~1.5 cm,通过右侧颈内动脉到达右侧大脑中动脉起始处。1 h后拔出,引起再灌注。
3 神经功能缺失评分 按照Longa评分标准的5分法稍加改进进行评分:0分无神经缺损征;1分提尾时左前肢内收,不能完全伸直;2分行走向左倾倒;3分向左旋转;4分不能自己行走或昏迷。1~4分为有效模型[3]。
4 脑组织损伤病理检查 脑组织多聚甲醛固定,蔗糖脱水后行冰冻切片,厚6 μm。切片丙酮4 ℃固定30 s,后稍水洗;苏木素染液染色3 min,1%盐酸酒精分化10 s,水洗2 s;促蓝液返蓝10 s,自来水流水冲洗1 min;0.5%伊红染液染色2 min,自来水冲洗;80%酒精、95%酒精、无水乙醇梯度脱水各1 min,二甲苯Ⅰ1 min,二甲苯Ⅱ1 min,中性树胶封片,显微镜观察拍照。
5 荧光定量RT-PCR检测 NReasy Mini Kit提取脑组织mRNA,逆转录成cDNA后,用下列引物扩增,CD59:上游 5'-TTCTgTTCCACAgCTgTTAgCC-3',下游5'-TgATTgTTTCCAACACCTTTgA-3',使用GAPDH作为内参基因:上游5'-TgCCCCCATgTTTgTgATg-3',下游5'-TgTggTCATgAgCCCTTCC-3'。
6 免疫荧光检测 按实验选取的时间点处死小鼠取材,脑组织多聚甲醛固定,蔗糖脱水后行冰冻切片,厚6 μm。切片置丙酮中4 ℃固定10 min;用0.01 mol/L PBS洗3次,每次5 min。封闭:10%正常羊血清溶液,37 ℃封闭1 h,甩去封闭液后加一抗 CD46(Santa Cruz Bio-technology),1∶100(PBS稀释),37 ℃孵育1 h,PBS洗3次,每次5 min;Cy3标记的二抗,1∶50(PBS稀释,避光),37 ℃孵育1 h,PBS洗3次,每次5 min;DAPI染核,抗荧光淬灭封片剂封片,荧光显微镜观察拍照,并用Image-pro plus6.1图像分析软件进行分析。
7 统计学处理 使用SPSS10.0软件进行统计学分析,计量资料比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
1 神经功能缺失评分 与对照组相比,小鼠神经功能缺失评分随缺血-再灌注时间的延长逐渐增高,至24 h达最高(P<0.01),至再灌注48 h(P<0.01)时保持较高水平,72 h后逐渐恢复。见图1。
2 脑组织损伤区组织形态学观察 HE染色后,光镜下观察神经细胞组织形态学变化,发现正常组脑神经细胞结构完整,细胞核较大,细胞及间质无水肿,伴随再灌注时间推进,海马区脑神经细胞多数神经细胞核固缩,神经细胞坏死,伴有水肿,24 h达损伤高峰,72 h以后海马区组织形态有所恢复。见图2。
3 脑组织中CD59 mRNA的表达变化 与空白对照组相比,随着缺血-再灌注时间的延长CD59 mRNA的表达量逐渐减少,24 h最低(P<0.01),48 h后逐渐升高(P<0.01)。见图3。
4 海马区CD59蛋白的表达变化 正常对照组海马区及周围可见大量CD59蛋白沉积,从缺血-再灌注6 h开始,在海马区及周围表达量逐渐减少,24 h最低,48 h后逐渐接近正常。见图4。
讨 论
脑血管病中缺血性脑血管病占80%以上,以其高发病率、高致残率和高病死率严重威胁人类生命健康,早期的溶栓治疗和保护神经是治疗缺血性脑血管病的主要治疗方法,但溶栓药物有严重的并发症,如出血、缺血-再灌注引起的脑水肿和病变血管再闭塞等问题[4-5]。
近年来研究证明,补体激活在脑缺血-再灌注炎症损伤中扮演着重要角色[6-8]。补体调节蛋白CD59通过结合C8、C9,调节C5b-9复合物的形成和功能,防止攻膜复合物MAC对同种或自身细胞的溶解破坏。有研究证实,在猫ALI和ARDS模型中CD59表达下调,在人类罕见疾病如阵发性睡眠性血红蛋白尿中,CD59的表达缺失与血栓形成风险的增加有密切关系[9-10]。
我们通过免疫组化及荧光定量PCR的方法观察了CD59的表达规律,结果发现,正常小鼠脑组织中CD59大量表达,在缺血-再灌注后6 h缺血区神经元及胶质细胞胞浆中CD59表达已开始明显减少,缺血-再灌注后24 h表达最低,持续至48 h,72 h后表达逐渐升高。比较补体调节蛋白CD59的表达变化情况与脑组织损伤的相关性,发现它与脑组织损伤程度呈平行关系。表明缺血-再灌注后CD59的表达变化与脑组织损伤直接相关,是脑组织的保护因素之一。目前有研究证实,作为重要的补体调节蛋白SCR1对大鼠脑缺血再灌注损伤有确切的保护作用,下一步,可以通过检测SCR1在小鼠脑缺血-再灌注不同时间的表达变化,与CD59的表达进行对比,进一步阐释CD59的表达将有助于减轻脑组织损伤,从而为脑保护治疗提供新的思路[11]。
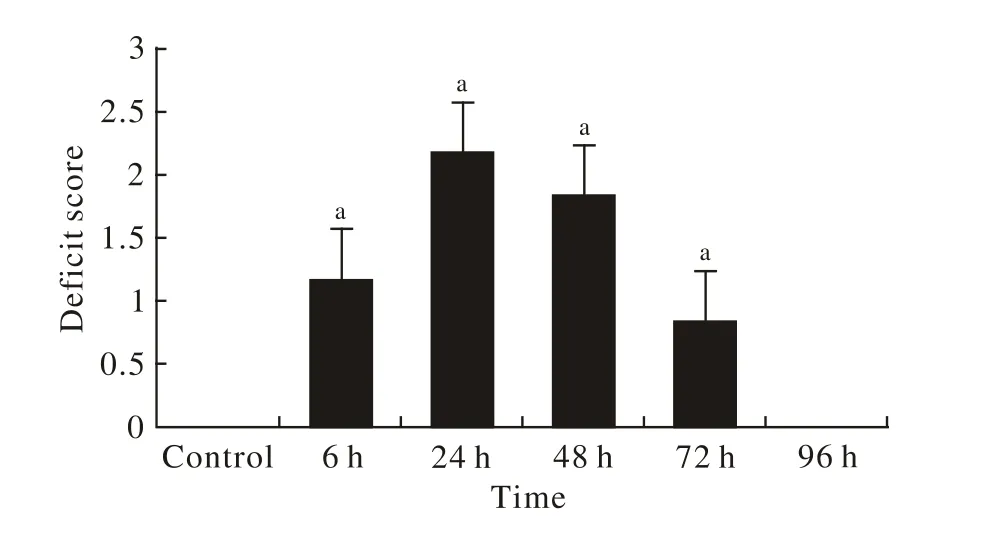
图1 脑缺血再灌注各组神经行为学评分(n=8/组) (与正常组比较,a: P<0.01)Fig.1 Neurological score of different ischemia-reperfusion groups(n=8)
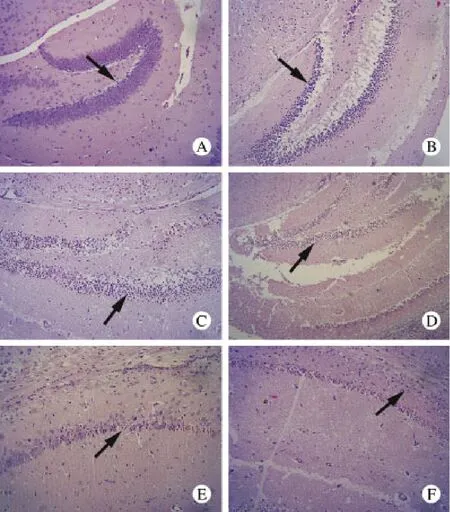
图2 各组脑缺血再灌注损伤区病理观察(×10)A: 正常对照组; B:缺血-再灌注6 h组; C:缺血-再灌注24 h;D:缺血-再灌注48 h组; E:缺血-再灌注72 h组; F:缺血-再灌注96 h组Fig.2 Pathological injury in control group (A) and ischemiareperfusion groups at 6 h(B), 24 h(C), 48 h(D), 72 h(E) and 96 h(F)(×10)
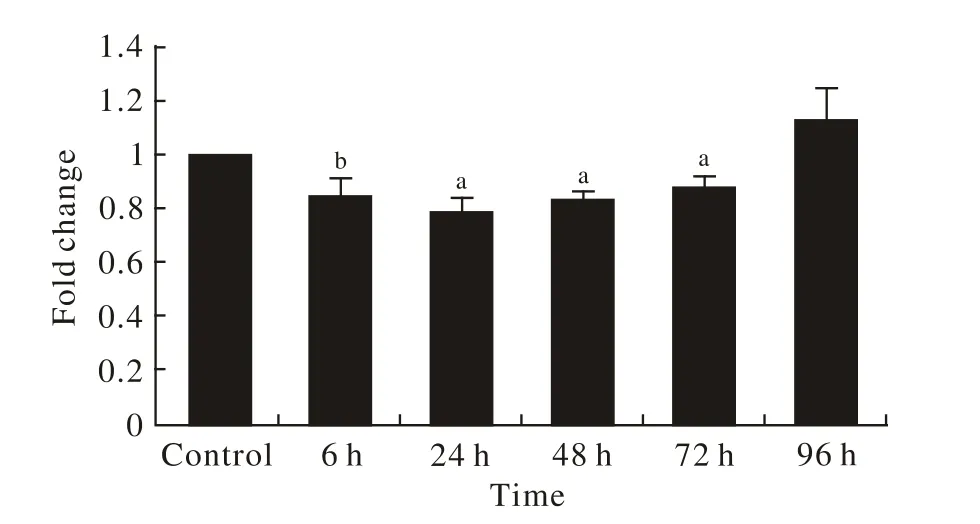
图3 脑缺血再灌注后各组CD59 mRNA的表达变化(a: P<0.01; b: P<0.05 vs control)Fig.3 CD59mRNA expressions in different groups after cerebral ischemia-reperfusion
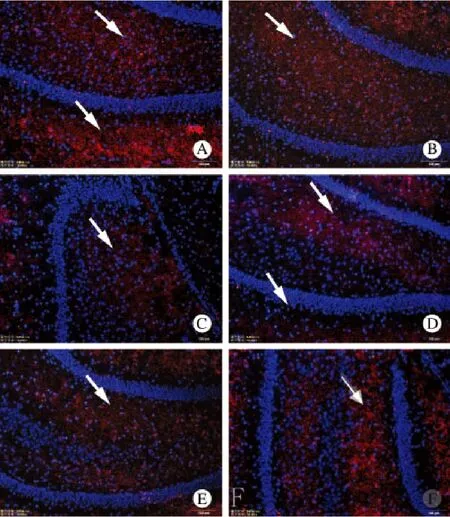
图4 各组脑缺血再灌注损伤区CD59免疫荧光表达变化(×10)A:正常对照组; B:缺血再灌注6 h组; C:缺血再灌注24 h组;D:缺血再灌注48 h组; E:缺血再灌注72 h组; F:缺血再灌注96 h组Fig.4 Immunofluorescence staining showing CD59 expression in control group (A) and ischemia-reperfusion groups at 6 h(B),24 h(C), 48 h(D), 72 h(E) and 96 h(F)(×10)
1 Stahel PF, Flierl MA, Morgan BP, et al. Absence of the complement regulatory molecule CD59a leads to exacerbated neuropathology after traumatic brain injury in mice[J]. J Neuroinflammation, 2009, 6:2.
2 Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989, 20(1): 84-91.
3 Ljunggren B, Brandt L, Säveland H, et al. Outcome in 60 consecutive patients treated with early aneurysm operation and intravenous nimodipine[J]. J Neurosurg, 1984, 61(5): 864-873.
4 张子明,李惠兰.中风临床与康复[M].北京:华夏出版社,2007:
5 Henninger N, Bratane BT, Bastan B, et al. Normobaric hyperoxia and delayed tPA treatment in a rat embolic stroke model[J]. J Cereb Blood Flow Metab, 2009, 29(1): 119-129.
6 Pan J, Konstas AA, Bateman B, et al. Reperfusion injury following cerebral ischemia : pathophysiology, Mr imaging, and potential therapies[J]. Neuroradiology, 2007, 49(2): 93-102.
7 Komotar RJ, Kim GH, Otten ML, et al. The role of complement in stroke therapy[J]. Adv Exp Med Biol, 2008, 632 :23-33.
8 Arumugam TV, Woodruff TM, Lathia JD, et al. Neuroprotection in stroke by complement inhibition and immunoglobulin therapy[J].Neuroscience, 2009, 158(3): 1074-1089.
9 杨康,刘维永.猫创伤性ALI和ARDS中CD59和CD46的表达和意义[J].第四军医大学学报,2000, 21(5):624-626.
10 Trendelenburg M. Complement inhibition by anti-C5 antibodies--from bench to bedside and back again[J]. Swiss Med Wkly, 2007,137(29-30): 413-417.
11 Li S, Xian J, He L, et al. The protective effect of SCR(15-18) on cerebral ischemia-reperfusion injury[J]. Neurol Res, 2011, 33(8):866-874.

