携带hHCN4基因重组腺病毒载体体外转染大鼠BMSCs的实验研究
佟玉娜,王高频
辽宁医学院附属第一医院 心内科,辽宁锦州 121000
多年来,因为电子起搏器的不足如缺乏对神经体液的自主调节等,构建生物起搏器逐渐进入人们的视野。目前超极化激活及环化核苷酸门控阳离子通道基因(HCN)具有起搏活动所必须的独特特征备受关注。研究表明HCN4在窦房结细胞起搏离子流中起着核心、特异性作用[1-2]。骨髓间充质干细胞(BMSCs)体外培养扩增快、易于外源基因的导入与表达,并具有多向分化潜能,可向成骨、成脂细胞等方向分化,成为理想基因治疗的种子细胞[3-6]。由于HCN4是维持窦房结起搏细胞电生理功能的特异性基因,本研究则用携带hHCN4基因的重组腺病毒载体体外转染大鼠BMSCs,通过RT-PCR和Western Blot方法检测目的基因在BMSCs中有mRNA和蛋白水平的表达,证实hHCN4基因在BMSCs中能够表达,为进步证实携带hHCN4基因的BMSCs具有起搏功能提供依据,继而将携带hHCN4基因的BMSCs作为生物起搏细胞,为基因和细胞相结合治疗缓慢性心律失常构建生物起搏器奠定基础。
材料和方法
1 实验动物 200~250 g健康2个月大鼠10只(雌雄不拘),由辽宁医学院实验动物中心提供。
2 主要试剂和仪器 重组腺病毒载体Ad-hHCN4-IRES/eGFP(辽宁医学院附属第一医院骨科重点实验室构建);LipofectamineTM 2000(Invitrogen);DMEM培养液(GIBCO公司)、胎牛血清(Hyclone公司);Trizol RNA提取液(Invitrogen公司);逆转录试剂盒(Fermentas);RIPA(碧云天生物技术研究所);大鼠抗人HCN4单克隆抗体(Abcam公司);辣根过氧化物酶标记兔抗大鼠IgG二抗(碧云天生物技术研究所)。荧光显微镜(Olympus)、梯度PCR仪(Thermo)、Western Blot电泳仪、电泳槽、转膜仪(Bio-Rad)、Labworks凝胶图像分析系统(UVP)。
3 BMSCs的分离、培养及传代 取200~250 g健康2个月大鼠,断颈处死,75%乙醇浸泡15 min,无菌条件下取大鼠股骨和胫骨,磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗干净,切除两端干骺端,DMEM培养液反复冲洗骨髓腔,200目筛网过滤,2 000 r/min离心20 min,去除上清液,加含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养液制成单细胞悬液,接种于塑料培养瓶中,置于37 ℃、5% CO2饱和湿度条件下行原代培养(P0代)。3 d后更换培养液,换液前PBS冲洗2次,以去除未贴壁的造血细胞,加含10% FBS的DMEM培养液继续培养,以后每3 d换液一次,进一步去除未贴壁细胞,待细胞汇合80%以上时用0.25%胰蛋白酶消化、传代。培养至第3代(P3代)以上用于转染并拍照。
4 重组腺病毒载体转染BMSCs 用已经构建成功的重组腺病毒载体Ad-hHCN4-IRES/eGFP体外转染大鼠BMSCs。转染采用LipofectamineTM 2000试剂盒,取P3代生长良好的BMSCs。用无抗生素的培养液将细胞接种于6孔板中,接种密度为(0.5~2)×105。第2天,细胞达到80%~90%融合。换液,加入2 ml不含抗生素的培养液。将4.0 μg质粒pAV-hHCN4-IRES/eGFP用Opti-MEMⅠ培养液稀释至50 μl,轻轻混匀;取10 μl LipofectamineTM 2000滴入40 μl的Opti-MEMⅠ培养液中,室温孵育5 min。将稀释的质粒和稀释的Lipofectamine TM 2000混合,轻轻混匀,室温下孵育20 min。将此100 μl的混合液加入细胞孔中,37 ℃5% CO2培养箱中孵育5~6 h后,更换含血清的新鲜培养液。24~48 h后在荧光显微镜下依据绿色荧光判断质粒是否转染至BMSCs中。
5 RT-PCR检测转染细胞hHCN4基因mRNA的表达 将未转染和转染Ad-hHCN4-IRES/eGFP 48 h后的BMSCs消化并离心收集,按照Trizol说明书提取总RNA进行逆转录反应。以cDNA产物为模板、β-actin为内参,进行RT-PCR,所用引物见表1。hHCN4基因扩增条件为94 ℃、45 s,63.6℃、45 s,72 ℃、1 min,共34个循环。β-actin扩增条件为94 ℃、45 s,55.3 ℃、45 s,72 ℃、1 min,共 34 个循环。产物用1%的琼脂糖凝胶电泳,凝胶成像系统照相并分析结果。
6 Western Blot检测hHCN4基因蛋白的表达PBS冲洗细胞2遍,加入蛋白裂解液,冰上静置30 min,然后将此混合液转移到1.5 ml离心管中,4 ℃、12 000 r/min×30 min离心,以RIPA蛋白提取试剂分别提取转染Ad-hHCN4-IRES/eGFP后和未经转染处理的BMSCs的细胞总蛋白。一抗hHCN4和β-actin均按1∶1 000倍稀释;二抗采用辣根过氧化物酶标记兔抗大鼠IgG抗体,按1∶5 000倍稀释。用ECL试剂盒显色,有目的蛋白表达的条带呈黑色,各条带扫描后采用凝胶图像分析系统分析。
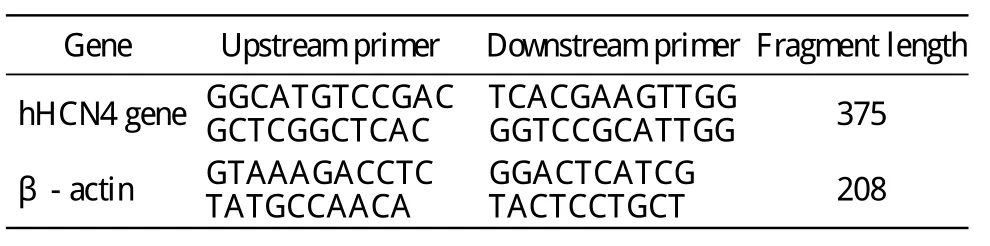
表1 RT-PCR目的基因和对照基因的引物序列Tab.1 Primer sequences of target and control genes for PCR
结 果
1 BMSCs形态学特点 刚分离出的P0代细胞呈圆形,大小不等,细胞膜完整光滑,其中杂细胞较多;8~10 h后逐渐贴壁生长,24 h后基本贴壁,48 h后多数为成纤维样的梭形细胞;72 h后首次换液,大部分细胞已伸展呈多角形;7~10 d细胞集落逐渐增多并基本达90%以上融合;经1∶2传代后,造血细胞基本消失,贴壁细胞体积较大,生长迅速,大多为长梭型。P3代后细胞大小趋于均匀,以梭形细胞为主,部分小规则,细胞状态趋于稳定。见图1。
2 Ad-hHCN4-IRES/eGFP转染大鼠BMSCs 转染24 h后,荧光显微镜下可见绿色荧光(图2),根据绿色荧光阳性细胞百分率判断腺病毒介导的基因转染效率。有细胞绿色荧光表达说明部分细胞已经成功转染并表达目的基因。调整转染后细胞密度在(100~200)×105/L之间,0.25%胰酶消化,血球计数板普通视野下计细胞数A,换荧光下相同视野计荧光细胞数a,计算转染效率[转染效率(%)=a/A×100%]。转染24 h后转染效率约为20%~30%。
3 转染Ad-hHCN4-IRES/eGFP大鼠BMSCs hHCN4 mRNA检测 转染72 h后 提取BMSCs总RNA,用RT-PCR法检测hHCN4 mRNA的表达。结果显示,转染后BMSCs可检测出hHCN4 mRNA,而未转染的BMSCs未能检测到hHCN4 mRNA,见图3。
4 转染Ad-hHCN4-IRES/eGFP大鼠BMSCs hHCN4蛋白表达Westem Blot检测 结果显示,Ad-hHCN4-IRES/eGFP转染组BMSCs可检出hHCN4蛋白表达,而未转染组的BMSCs未检测到hHCN4蛋白表达,见图4。

图1 骨髓间充质干细胞(BMSCs) A: P0代(×100); B: 10 h后贴壁(×200); C: P3代(×100)Fig.1 Bone marrow mesenchymal stem cells A: Primary generation; B: After 10 h adherent; C: Third-generation(×100)

图2 转染重组腺病毒的大鼠骨髓间充质干细胞见绿色荧光蛋白表达(×100)Fig.2 Expression of green fluorescence protein in rat bone marrow mesencyhmal stem cells after recombinant adenovirus transfection

图3 RT-PCR检测转染后hHCN4-mRNA的表达Fig.3 RT-PCR showing expression of trans-fected hHCN4 mRNA M: DGL600 Marker; 1, 2: After trans-fection; 3, 4: Untransfected

图4 Western blot 检测转染后hHCN4蛋白的表达Fig.4 Western blot showing expression of transfected hHCN4 protein 1, 3: After transfection; 2, 4: Untran-sfected
讨 论
Brown,Difrancesco[7]在窦房结起搏活动中研究发现超级化激活环化核苷酸门控阳离子通道基因(hyperdarization activated cyclic nucleotide gated cation channed,HCN)具有超极化激活、钠钾离子通透、细胞内cAMP调节、微弱的单通道电导及被细胞外铯特异性阻断等特性,是起搏电流形成的分子基础。HCN家族成员有4个,其中HCN1、HCN2及HCN4在心脏中表达。Xiao等[8]采用RTPCR法检测窦房结和心房组织中HCNs的表达,结果示人窦房结组织中主要表达HCN4,占75%。心脏正常节律性跳动有赖于窦房结正常发放冲动以及完善的传导系统。各种原因造成窦房结或房室结起搏细胞数量减少或功能衰退可进一步导致严重的心动过缓,引起窦房结功能障碍或房室传导阻滞[9]。最新研究表明,HCN4的主要作用是使起搏的频率维持在一定水平并随着机体的不同生理状态而对频率进行调节[10]。因此,HCN4通道对窦房结潜在起搏活动的产生有至关重要的作用,成为目前最受关注的起搏备选基因[11]。
骨髓间充质干细胞(BMSCs)存在于骨髓腔中,是一类具有多项分化能力的干细胞,能够分化为成骨细胞、脂肪细胞、软骨细胞等中胚层细胞[12]。在其他一些动物实验甚至临床人体实验中,并没有观察到BMSCs明显的致严重室性心律失常的事件发生,提示BMSCs用于心脏移植具有较大的安全性[13]。2005年Beeres等[14]体外培养实验显示,人BMSCs能修复心肌传导阻滞。由于BMSCs具有较多优点:1)易获取、传代,对人体无害,不存在法律及伦理问题;2)免疫原性较低,不存在组织配型及免疫排斥问题;3)易于外源基因的导入和表达;4)具有多向分化潜能,已成为目前理想的基因治疗靶细胞。
本实验将携带hHCN4基因的重组腺病毒载体转染大鼠BMSCs后的24~48 h观察到部分BMSCs在荧光显微镜下可见绿色荧光颗粒,这说明含绿色荧光蛋白的重组腺病毒载体已成功转染到BMSCs中并正常表达,通过绿色荧光蛋白的表达检测转染效率和研究转染成功的细胞。更重要的是本实验通过RT-PCR及Western Blot检测法从mRNA和蛋白水平的表达证实通过转染可使BMSCs表达hHCN4基因,进一步证实基因和细胞可融洽的结合以构建生物起搏器。
本实验对细胞联合基因治疗进行了探索,取得了较为满意的结果。转染后BMSCs能够表达hHCN4基因,但是携带hHCN4基因的BMSCs是否具有生理性起搏电流的特征?是否能与其共培养的心肌细胞产生通讯功能?是否能够替代因病变失去起搏功能的细胞或传导系统?我们将进行下一步研究,为构建生物起搏器提供更多的基础依据,以期该领域的研究成果早日应用于临床当中。
1 仝识非,宋治远,姚青,等. mHCN4基因修饰小鼠骨髓间充质干细胞重建起搏离子流通道[J]. 中国心脏起搏与心电生理杂志,2007,21(1):51-54.
2 Stieber J, Herrmann S, Feil S, et al. The hyperpolarization-activated Channel HCN4 is required for the Generation of pacemaker action potentials in the embryonic heart[J]. Proc Natl Acad Sci U S A,2003, 100(25): 15235-15240.
3 Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses[J]. Blood, 2005, 105(4):1815-1822.
4 Ozawa K, Sato K, Oh I, et al. Cell and gene therapy using mesenchymal stem cells (MSCs)[J]. J Autoimmun, 2008, 30(3):121-127.
5 潘新元,梁博伟,赵劲民,等.膜联蛋白A1在兔骨髓间充质干细胞体外诱导成骨和成脂早期的表达[J]. 中国组织工程研究,2012,16(23):4181-4186.
6 周浩粤,邱汉婴,卢炯斌,等. 兔骨髓间充质干细胞体外向心肌样细胞诱导分化:缝隙连接蛋白43的表达变化[J]. 中国组织工程研究与临床康复,2010,14(19) :3431-3435.
7 Brown H, Difrancesco D. Voltage-clamp investigations of membrane currents underlying pace-maker activity in rabbit sino-atrial node[J] .J Physiol, 1980, 308 :331-351.
8 Xiao YF, Chandler N, Dobrzynski H, et al. Hysteresis in human HCN4 channels: a crucial feature potentially affecting sinoatrial node pacemaking[J]. Sheng Li Xue Bao, 2010, 62(1): 1-13.
9 Baruscotti M, Robinson RB. Electrophysiology and pacemaker function of the developing sinoatrial node[J]. Am J Physiol Heart Circ Physiol, 2007, 293(5): H2613-H2623.
10 Stieber J, Hofmann F, Ludwig A. Pacemaker channels and sinus node arrhythmia[J]. Trends Cardiovasc Med, 2004, 14(1):23-28.
11 王妮娜,刘如秀.窦房结细胞起搏基因HCN4的研究进展[J].医学综述,2011,17(10):1441-1444.
12 Gerke V, Moss SE. Annexins: from structure to function[J].Physiol Rev, 2002, 82(2): 331-371.
13 Mills WR, Mal N, Kiedrowski MJ, et al. Stem cell therapy enhances electrical viability in myocardial infarction[J]. J Mol Cell Cardiol,2007, 42(2): 304-314.
14 Beeres SL, Atsma DE, Van der Laarse A, et al. Human adult bone marrow mesenchymal stem cells repair experimental conduction block in rat cardiomyocyte cultures[J]. J Am Coll Cardiol, 2005, 46(10):1943-1952.

