颅面部肿瘤所致低磷软骨病2例并文献复习
王颖倩,巴建明,王先令,吕朝晖,窦京涛,杜 锦,谷伟军,杨国庆,杨丽娟,金 楠,母义明
解放军总医院 内分泌科,北京 100853
肿瘤相关性低磷软骨病(tumor-induced osteomalacia,TIO)是一种非常少见的代谢性骨病。患者主要表现为全身骨痛、无力以及骨骼畸形,生化特征主要是肿瘤相关的肾脏排磷增加及维生素D代谢异常[1]。迄今,国际上报道不超过200例,肿瘤的定位主要是在四肢长骨以及皮肤和软组织等,发生于颅面部的间叶组织肿瘤极其罕见,临床上容易发生误诊、误治。本文报告2例中年女性病例,外院误诊为类风湿关节炎,我院最终确诊为颅面部肿瘤所致TIO[2-4]。
病例资料
病例1:女性,43岁。患者于2007年开始出现弥漫骨痛、肌无力并进行性加重。外院先后诊断为“类风湿性关节炎”、“致密性骨炎”,给予非甾体类消炎药、糖皮质激素等治疗,骨痛症状无缓解。2010年3月患者突然出现右眼向鼻侧凝视及水平复视,外院诊断为右侧眼肌麻痹,应用强的松(75 mg/d)、甲钴胺、维生素B1治疗1个月,凝视症状无缓解,于2010年4月2日来我院治疗。个人、家族史无特殊。体格检查:入院时身高153 cm,体质量45 kg,宽基步态。全身皮肤黏膜无黄染及皮下结节。右侧眼球向鼻侧凝视、外展受限、水平复视明显。胸椎轻度后凸畸形,脊柱及四肢压痛明显,腰骶椎叩击痛阳性。四肢活动受限。入院后查血常规、尿常规、肝肾功能、血气分析正常。抗核抗体、类风湿因子、免疫球蛋白电泳均正常。血清钙(2.14 mmol/L,正常范围2.25~2.65 mmol/L)及甲状旁腺激素PTH(71.09 pg/ml,正常范围10~65 pg/ml)水平轻度异常。持续的低血磷(0.43~0.52 mmol/L,正常范围0.9~1.6 mmol/L),显著增高的磷酸盐清除率(45 ml/min,正常范围6.3~15.5 ml/min)及碱性磷酸酶水平(260.1 U/L,正常范围<130 IU/L)。X线片显示全身广泛骨质软化。结合临床资料,除外导致低磷软骨病的常见病因,疑诊为TIO。行111铟奥曲肽扫描显示:鼻骨右侧放射性稍增高(图1)。遂行颅底CT及MRI检查示:右侧颞骨岩尖部骨质破坏,局部见1.7 cm×1.3 cm软组织密度肿块,增强扫描不均匀异常强化;右侧海绵窦受累,颈内动脉部分被包绕,诊断为右侧岩骨尖肿瘤性病变。结合上述检查结果,临床诊断TIO成立,右眼内斜凝视与肿瘤侵犯右侧海绵窦、压迫外展神经有关。转至耳鼻喉科行电视鼻内镜经蝶窦颅鼻贯通肿瘤切除术,由于术中难以确定肿瘤起源,肿瘤切除不完全。术后组织病理及免疫组化结果提示磷酸盐尿性间叶肿瘤(混合结缔组织亚型),从而确诊TIO。术后第1、3、4、5、6、7、8天血磷由术前的0.25 mmol/L分别上升至0.49、0.37、0.48、0.66、0.51、0.57、0.58 mmol/L,但仍低于正常范围。骨痛及肌无力症状部分缓解,于2010年5月12日出院。
病例2:女性,42岁。主因腰部及髋关节疼痛伴进行性加重于2010年6月6日至我院就诊。在当地多家医院就诊,考虑为“椎间盘突出”、“双侧股骨头坏死”,“双侧髋关节滑膜炎”,对症治疗无效。患者用药史及家族史无特殊。体格检查:入院时身高142 cm,体质量54 kg。步行受限(10 m内),需借助双拐缓慢行走,全身皮肤黏膜无皮下结节,四肢关节无红肿、畸形。化验检查:多次查血清钙及甲状旁腺激素(parathyroid hormonr,PTH)在正常范围,持续低血磷(0.49~0.61 mmol/L,正常范围0.9~1.6 mmol/L),磷酸盐清除率(32 ml/min,正常范围6.3~15.5 ml/min)及血清碱性磷酸酶活性(358.7 U/L,正常范围<130 IU/L)显著增加。结合患者临床资料,加之病例1的诊断经验,亦拟诊TIO。111铟奥曲肽扫描示左鼻窦部放射性摄取增加。遂行CT(图2)及MRI检查示:左鼻腔和筛窦部有血流丰富的软组织肿块,诊断为左鼻腔和筛窦部肿瘤性病变。转至耳鼻喉科行内镜下手术,在蝶窦右后方见肿物,并将其彻底切除。病理和免疫组化结果提示磷酸盐尿性间叶肿瘤(混合结缔组织亚型)。由于肿瘤切除完全,患者术后血磷上升比病例1迅速,在术后第2、3、4、5、6天分别上升至0.94,1.05,1.23,1.15及1.09 mmol/L。于2010年6月29日出院。
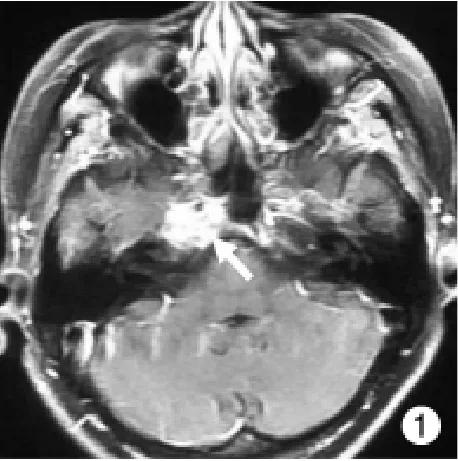
图1 病例1头颅MRI扫描发现右侧岩部尖一1.7 cm×1.3 cm大小增强病变,伴有海绵窦浸润和右侧颈内动脉鞘部分包绕Fig.1 Cranial magnetic resonance imaging (MRI) scan revealing a 1.7 cm ×1.3 cm enhanced lesion occupying right petrous apex with cavernous sinus infiltrated and internal carotid artery encasement partially surrounded in the right side in cases 1
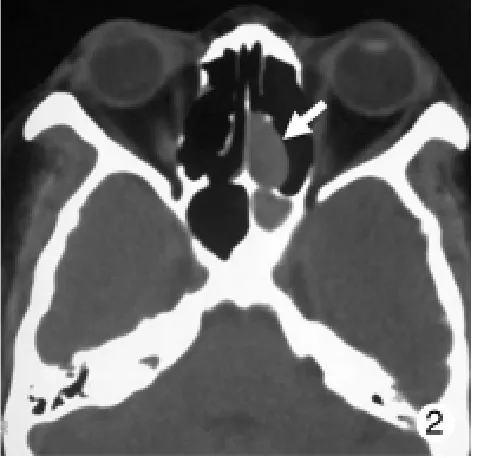
图2 病例2头颅CT显示左鼻腔和筛窦处存在一1.2 cm×2.1 cm大小软组织肿块Fig.2 Cranial CT showing a 1.2 cm×2.1 cm soft mass in the left nasal cavity and ethmoid sinus in cases 2
讨 论
骨软化症是由于骨基质矿化不全所致的代谢性骨病。有多种病因:罕见的代谢遗传性疾病(常染色体显性低磷佝偻病、X-连锁低磷佝偻病)、肾小管酸中毒、慢性肾衰等[5]。在临床工作中可能会遇到一些反复低血磷的骨痛、肌无力、骨骼畸形患者,这些患者在骨科、风湿科、内分泌科等反复就诊,常常被误诊为风湿性关节病、骶髂关节炎等疾病,长期得不到正确诊治。此类患者有一个问题容易被忽视,即顽固性低磷血症。即使低磷血症被发现,口服大剂量补磷制剂及1,25(OH)2Vit D3仍然不能被纠正,而且上述症状改善不明显[5]。
Macane于1947年首次报道肿瘤可以引起低磷软骨病。随后,1959年Prader简单阐述了间叶性肿瘤与软骨病的关系。近几年逐渐证实,部分顽固性低磷软骨病的病因即为间叶组织肿瘤,并将这部分软骨病称为TIO。引起TIO的肿瘤常常体积很小,应用常规影像学检查很难定位,从而容易延误诊断[6]。文献报道过的病例中延误诊断的中位时间约6年,其中最长的病例延误诊治超过20年。一旦肿瘤定位明确并完全切除,低血磷症能够迅速被纠正,而且患者的临床症状会逐渐缓解[7]。
关于TIO的发病机制研究表明,某些间叶组织肿瘤细胞可以自主过度分泌一种或几种利磷因子,最常见的是纤维生长因子23(FGF23)[8]。该因子可以通过抑制近端肾小管钠-磷泵的作用,减少磷的重吸收,从而促进肾脏对磷的排泄,导致高尿磷、低血磷,进而引起骨骼矿化障碍和骨质软化性改变[9]。这些利磷因子还可以抑制1,25(OH)2Vit D3的合成,可以解释为何一些TIO患者中1,25(OH)2Vit D3水平低。
TIO相关肿瘤除了一小部分位于皮下组织或长骨表面,可以通过仔细的体格检查发现外,大都位于较隐匿的部位,所以无目的性的影像学检查常常较难发现肿瘤。Seufert等首先证实多数TIO相关肿瘤有生长抑素受体亚型2的表达,并且可以和111铟标记的奥曲肽结合,因此同位素标记的奥曲肽扫描有助于TIO肿瘤的定位[6,10]。本文两例应用奥曲肽扫描均得到肿瘤的正确定位。但并非所有TIO相关肿瘤均有生长抑素受体的表达,所以奥曲肽扫描阴性者,不能完全排除TIO诊断。一般来讲,应用奥曲肽扫描大致定位后,行CT、MRI等检查进行精确定位。对于奥曲肽扫描阴性者,PET检查有时有阳性表现。目前奥曲肽扫描联合FGF23静脉分段取血是一种较好的肿瘤定位方式[9]。TIO相关肿瘤大都是生长缓慢的良性、多形性、间叶组织来源的肿瘤,分类为磷酸盐尿性间叶肿瘤,其中混合结缔组织亚型最常见。
本文病例1,由于右侧海绵窦受累,肿瘤无法完全切除,故其低磷血症并未完全纠正。鉴于此,我们建议患者应用奥曲肽继续治疗[6]。幸运的是病例2的肿瘤得以完全切除,术后血磷水平恢复正常,临床症状显著改善。TIO最有效的治疗方法是间叶组织肿瘤的完全切除(如病例2)。血清磷、骨化三醇及肾小管磷重吸收率在术后几个小时或几天内即可恢复正常。但血清中骨钙素和碱性磷酸酶水平需要相对较长时间才能恢复正常[11]。对于肿瘤无法切除的患者,若之前应用奥曲肽扫描证实肿瘤有生长抑素受体的表达,可以应用生长抑素类似物治疗,在一些患者中能够缓解症状并使血磷水平恢复正常[6]。
综上所述,对于中青年起病、长期顽固严重低磷软骨病患者,通过病史询问、家族史调查及实验室检查除外常见病因后,要高度重视TIO的筛查。奥曲肽扫描联合X线、CT、MRI检查可明确多数TIO相关肿瘤定位。诊断明确后,手术完全切除肿瘤可以治愈TIO;对于肿瘤浸润而无法全切者,可以考虑在口服补磷的基础上,长期应用生长抑素治疗,亦可达到疾病的长期缓解。
1 Jiang Y, Xia WB, Xing XP, et al. Tumor-induced osteomalacia:an important cause of adult-onset hypophosphatemic osteomalacia in China : Report of 39 cases and review of the literature[J]. J Bone Miner Res, 2012, 27(9): 1967-1975.
2 Chokyu I, Ishibashi K, Goto T, et al. Oncogenic osteomalacia associated with mesenchymal tumor in the middle cranial fossa: a case report[J]. J Med Case Rep, 2012, 6(1):181.
3 Pedrazzoli M, Colletti G, Ferrari M, et al. Mesenchymal phosphaturic neoplasm in the maxillary sinus: a case report[J]. Int J Oral Maxillofac Surg, 2010, 39(10): 1027-1032.
4 Kurien R, Manipadam MT, Rupa V. Oncogenic osteomalacia in a patient with an ethmoid sinus tumour[J]. J Laryngol Otol, 2010,124(7): 799-803.
5 Gore MO, Welch BJ, Geng W, et al. Renal phosphate wasting due to tumor-induced osteomalacia : a frequently delayed diagnosis[J].Kidney Int, 2009, 76(3): 342-347.
6 Chong WH, Molinolo AA, Chen CC, et al. Tumor-induced osteomalacia[J]. Endocr Relat Cancer, 2011, 18(3): R53-R77.
7 巴建明,桑艳红,陆菊明,等. 12例肿瘤性骨软化症的临床诊治及术后随访[J]. 中华内分泌代谢杂志,2011,27(1):19-23.
8 金文胜,吕朝晖,陆菊明,等. 肿瘤引起的低磷软骨病-一例报道并文献回顾[J]. 中华内分泌代谢杂志,2006,22(3):298-300.
9 Hu FK, Yuan F, Jiang CY, et al. Tumor-induced osteomalacia with elevated fibroblast growth factor 23: a case of phosphaturic mesenchymal tumor mixed with connective tissue variants and review of the literature[J]. Chin J Cancer, 2011, 30(11): 794-804.
10 Harbeck B, Schöcklmann H, Seekamp A, et al. Tumor-induced osteomalacia: successful treatment by radio-guided tumor surgery[J] .J Clin Rheumatol, 2009, 15(1): 31-34.
11 Wang XL, Mu YM. Emphasis should be placed on the diagnosis and therapy of tumor induced osteomalacia[J]. Chin Med J (Engl),2011, 124(2): 163-165.

